基于教材解讀與真實情境模擬的催化劑教學實踐
摘 要:在教學中創設有效情境是調動學生學習興趣的最好動力,這樣能夠激發學生的好奇心和靈感。各種高效、經濟、選擇性強的催化劑的研制是重大課題,高中化學教學也要重視催化劑的研究。教師應對教材文本中催化劑的表述進行深刻解讀,并以真實情境下催化反應的工業或實驗模擬圖輔助教學,幫助學生建構催化劑認知模型,使其能夠建立解決復雜化學問題的思維框架。對此,文章闡述了催化劑的相關研究、催化劑教學的現狀以及相關教材解讀,并列舉了模擬真實情境的催化劑教學實踐,以供參考。
關鍵詞:催化劑;教材文本;真實情境;教學啟示;思維框架
作者簡介:劉現林(1976—),男,浙江省杭州第十四中學。
催化劑是化學研究中永恒的主題。催化劑在生產和生活中有廣泛的應用,有關催化劑的教學也需要與時俱進。高中生已從定性思維進入定量思維階段,可以對催化劑進行較為嚴格、真實的學習[1]。
一、催化劑相關研究
文獻中與“催化劑”匹配的大多是新型、高效催化劑的研究進展,基于高中學生認知水平且與教材文本相關的催化劑反應機理和選擇應用有關的文章較少[2]。新課程改革以來,模擬化工生產真實情境的催化劑應用評價主要從自發反應、反應歷程、活化能、反應速率、平衡移動、催化劑選擇等角度入手[3]。
二、催化劑教學現狀及相關教材解讀
學生通過《化學反應原理》的學習可了解到,催化劑之所以能夠促使反應的速率加快,最主要的原因是其能夠降低化學反應的活化能。催化劑的催化效果受環境的影響比較大,比如溫度、pH、比表面積等,但催化劑不改變化學平衡轉化率。當前,與催化劑相關的教學僅僅停留在簡單動手做實驗、表層理解的階段,導致學生尚未能夠依據催化反應及其變化的信息建構模型,建立解決復雜化學問題的思維框架,也沒有從催化劑知識學習的初級思維上升到高階思維。這就需要教師對教材文本中催化劑的表述作深刻解讀與研究。
(一)新課標對催化劑的教學要求
(二)催化反應的兩種理論解釋
碰撞理論和過渡態理論是用于解釋催化作用的兩個理論。碰撞理論指出,唯有活化分子之間的碰撞才有可能引起反應,又稱有效碰撞理論。
Eyring和Pzer基于碰撞理論提出過渡態理論,指出化學反應并不是通過簡單的碰撞就能完成的,反應物到生成物的過程中必須經過一個高能量的過渡態。基態是分子比較穩定的初始狀態;過渡態是分子極其不穩定的狀態,分子在此狀態極易重新組合形成新物質。活化能指的是將1mol反應物中的所有分子由基態轉化為過渡態所需要的能量,而降低化學反應當中的活化能就是催化劑所具備的重要作用。
吸熱反應的正反應和逆反應的活化能都會受到催化劑的影響。放熱反應的活化能會受到催化劑的影響。實驗證明,催化劑與反應歷程、活化能的關系都可以歸結到催化劑能有效降低活化能,提高活化分子百分數,增大有效碰撞的頻率。顯然,催化反應正是碰撞理論和過渡態理論的綜合體現。
三、模擬真實情境的催化劑教學實踐
情境模擬具有以下四個特點:第一,實踐性。情境模擬與傳統的教學模式不同,其是利用情境仿真出復雜的情況,然后引導學生利用知識解決問題,從而實現從實踐到理論再回歸實踐的要求。第二,綜合性。情境模擬通過設置,使情境具有一定的開放性和包容性,學生可以將學到的東西運用到具體的問題情境中,利用聯系、發展的眼光來看待并分析問題。第三,參與性。真正將學生作為課堂的主體,教師起到組織和引導的作用,鍛煉學生的觀察能力、分析能力與交流能力,這與單向的講解完全不同。第四,實效性。情境模擬的方式更加形象直觀,便于學生理解,有助于學生解決一些比較抽象、難以理解的問題。
科學理解可以分為描述性理解、定性式理解、定量式理解、符號式理解等若干階段,化學課程的設計者需要據此作通盤考慮[4]。
首先,在對催化劑的相關內容進行教學設計時,教師需要選取一些能夠對學生思維形成挑戰而且具有化學反應應用價值的素材。其次,在開展模擬工業真實情境的教學活動中,教師要注重發展學生的演繹推理、系統假設等思維能力。最后,教師帶領學生開展相關的研究活動時,要注重培養學生分析圖像和解釋實驗現象的能力,并結合一些具體的生產實例,引導學生對反應條件的選擇以及優化進行合作討論,進而幫助學生形成從各個角度調控化學反應的基本思路,促使學生在化學學習的過程中形成“綠色化學”的觀念,并能運用辯證的思維看待問題。下面,筆者從三例模擬工業真實情境的圖像和數據解讀催化劑教學。
(一)催化劑與轉化率(或產率)的關系
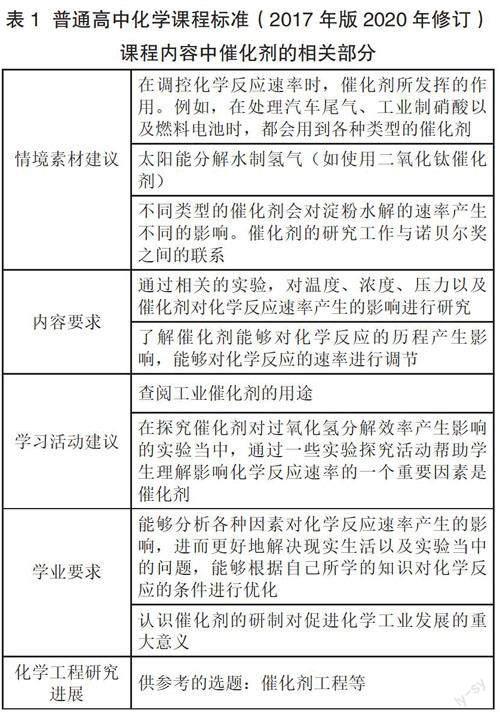
[例1]已知反應:NH4Cl(s)+CH3OH(g)NH3(g)+CH3Cl(g)+H2O(g)。圖1是在反應的過程中運用了幾種不同的催化劑而得到的關系圖,在實驗的過程中反應時間以及催化劑的用量等條件都相同,且n(甲醇)/n(氯化銨)=1/2。
[問題1]圖1表明:當其他條件相同時,多孔球型γ-Al2O3催化活性明顯高于分子篩催化劑,試解釋其原因。
[參考答案1]當其他條件相同時,多孔球型γ-Al2O3能更大程度地降低該反應的活化能,增大單位體積內活化分子百分數,從而提高CH3Cl生成速率。
[變式1]請在圖2中分別畫出無催化劑、分子篩催化劑、多孔球型γ-Al2O3三種情況下“反應過程—能量”示意圖。與標準答案對照,學生答案中有催化劑參與的反應普遍只有一個峰。顯然,學生對催化反應并不理解。普通的一級反應一般只有一個峰。但有催化劑參與的反應是先與反應物形成一個不穩定的中間物,此反應在能量進程圖中顯示一個峰,不穩定的中間物分解或繼續與反應物作用形成生成物與等量性質不變的催化劑,圖中出現第二個峰。
[問題2]分析圖3中a、b、c三條曲線中的點,思考哪些可能是CH3Cl的平衡產率,哪些不是CH3Cl的平衡產率。
[參考答案2]催化劑不能改變平衡轉化率(或產率)。但在平衡前,加入催化效率高的催化劑,相同時間內反應物的轉化率更高,所以工業上往往尋找高效催化劑。產率高者更可能達到平衡,因此c曲線可能為平衡產率,a、b曲線肯定不是平衡產率。
[變式2]當其他條件都相同,溫度為370℃且使用三種不同類型的催化劑時,請在圖3當中繪制出CH3Cl的產率隨時間變化而發生變化的曲線,分別運用a、b、c對相應的曲線進行標注。學生答案與標準答案基本一致。顯然,學生對于催化劑的表觀作用掌握到位。
教師在課堂教學中通過實例層層遞進,引導學生對預測、方案、結論進行完整論證,才能培養學生的系統思維能力,并幫助學生建立系統思維框架,提高學生分析、解決問題的能力,學生才能輕松作答變式1和變式2。
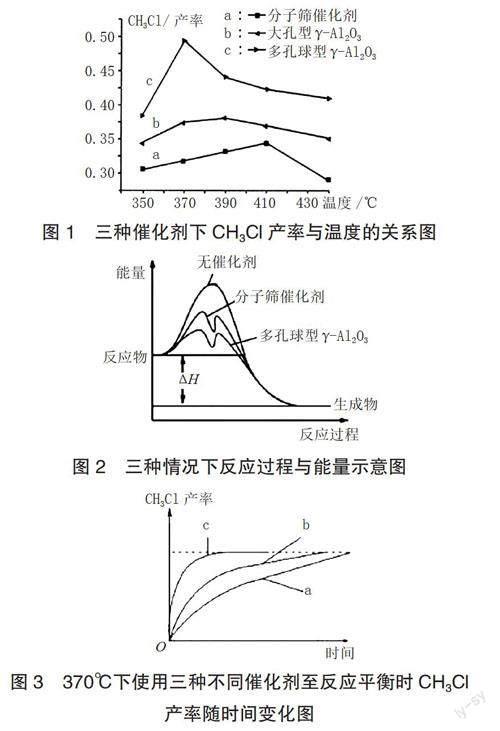
[例2]已知反應:NO(g)+NO2(g)+2NH2(g)2N2(g)+3H2O(g)ΔH<0。如果采用的還原劑為NH3,煙氣以一定的速率通過兩種不同的催化劑時,對產生氣體當中的氮氧化物含量進行測量,最終得到煙氣脫氮率,結果如圖4所示:
[問題1]由圖4可知,在催化劑①的作用下,煙氣脫氮率先增大后減小,請指出100~250℃脫氮率增大的可能原因。
[參考答案1]100~250℃脫氮率增大可以用兩種理論解釋。a.碰撞理論——溫度升高,單位體積內活化分子百分數增加,反應速率增大;b.過渡態理論——催化劑活性隨溫度升高而增大,從而加快速率。而速率的加快使相同時間內的脫氮率增大。
[問題2]在圖4交叉點A處,使用催化劑①或②,上述反應? ? ? (肯定/可能/肯定沒有)達到平衡,并說明理由。
[參考答案2]肯定沒有達到平衡。若A點是平衡點,則溫度升高,平衡逆向移動,脫氮率下降,這與催化劑②所呈現的圖像相矛盾。
[問題3]在圖4催化劑①的作用下,請指出250~400℃脫氮率下降的可能原因。
[參考答案3]反應尚未達到平衡,催化劑活性下降造成脫氮率下降。
[問題4]由圖4可知,在催化劑②的作用下,煙氣脫氮率先增大后減小,請指出450~500℃脫氮率下降的可能原因。
[參考答案4]a.反應已達平衡,溫度升高,平衡逆向移動;b.溫度升高,催化劑活性下降。
[變式3]請在圖5中繪制出平衡脫氮率隨溫度變化的可能曲線圖。學生的答案中只給出C點之前已經達到平衡的曲線,但未畫出存在平衡點更高的曲線。顯然,學生沒能完全領會圖5中最高點的含義。
教師在課堂實例中要有意識地說明建構思維模型的重要作用,只有這樣,學生才能夠更好地把握模型建立與論證證據之間的關系,才能更完整地回答變式3。
(二)催化劑與反應選擇性之間存在的關系
[例3]當存在Cu/ZnO催化劑時,CO2和H2之間可以發生兩個不同的反應,相對應地,會形成CH3OH和CO兩種產物。具體會發生如下反應:
[問題]根據表2中的數據可以看出,在溫度相同的情況下,種類不同的催化劑往往會對CO2轉化成CH3OH反應的選擇性產生非常大的影響,試分析其中的原因。
[教師過渡]a.有很多的化學反應往往不止產生一種產物,但是通過對催化劑的控制可以實現對反應方向的控制。因此,在工業生產時要優先考慮對目標產物選擇性高的催化劑。選擇性是指所消耗的原料中轉化成目的產物的百分率,即選擇性=轉化成目標產物的指定反應物的量/已轉化的指定反應物的量×100%。b.化學平衡是由熱力學決定的,ΔGθ=-RT㏑Kp,其中Kp為反應的平衡常數,ΔGθ是狀態函數,表示產物與反應物的標準吉布斯自由能之差,只決定于過程的始終態,而與過程無關。催化劑的存在不影響ΔGθ值,它只能縮短到達平衡所需的時間,而不能移動平衡點。
[參考答案]這時并沒有達到反應的平衡點,采用不同的催化劑往往會對反應Ⅰ產生不同的催化能力,在這一刻,對甲醇的選擇性會受到影響。可見,反應未達平衡,催化劑才能體現選擇性。
催化劑與轉化率、反應選擇性的關系,催化劑的效率與反應條件的關系等教學的開展依托真實情境的工業或實驗模擬圖,教師的啟發與過渡可幫助學生搭建解決催化劑相關問題的思維模型和框架,使學生的學習有事半功倍的效果。調查顯示,學生對此節課內容的掌握程度達到90%以上。
“催化劑教學”是將學習化學知識和技能的過程轉變為聯系社會生產、生活實際進行科學研究并形成科學素養的典型代表。情境模擬為教學提供了很大的便利,它是理論聯系實際的橋梁,開辟了一條從課堂走向社會的道路,還能調動學生的積極性,讓他們從被動學變為主動學,提高了學生的實踐能力和認知能力,在實際生活中應用也十分廣泛,能夠科學分析問題,使學生愿意主動去學習。通過教師的積極引導,這樣的教學會有事半功倍的效果,對學生以后的工作和學習都有幫助,能為他們步入社會打下基礎。
[參考文獻]
張映明.化學教材中與催化劑有關的幾個問題[J].化學教育,2013,34(2):10-13.
吳晗清,李豆豆.“催化劑”認知困境與教學對策[J].化學教學,2018(3):87-91.
尹滄浪.基于真實情境下催化劑考查形式的多維分析[J].中學化學教學參考,2018(10):65-66.
鐘啟泉,崔允漷,張華.《基礎教育課程改革綱要(試行)》解讀[M].上海:華東師范大學出版社,2001.

