細菌感染誘發細胞自噬的研究進展
鄧亦寧,張云科,焦曉宇,彭 辰,吳文學
(1. 中國農業大學 動物醫學院,北京 100193; 2. 國家動物疫病快速診斷實驗室,北京 100193;3. 中國醫學科學院 醫學實驗動物研究所,北京 100021)
作為生物體基本的結構與功能單位,細胞具有嚴格的代謝體系,以適應不同的環境條件、維持機體穩態與能量平衡。細胞自噬(autophagy)是一種高度保守的分解代謝途徑,通過降解不必要的、不需要的或功能失調的細胞成分,包括半衰期較長的或錯誤折疊的蛋白質,甚至是損傷的細胞器,如線粒體、核糖體、內質網等,嚴密調控細胞穩態[1]。通常情況下,自噬通路的激活是由于細胞處于營養缺乏的狀態,自噬體(autophagosome)包裹細胞質組分,通過分解代謝為細胞提供營養物質,此時自噬是沒有選擇性的,這種非選擇性的自噬也被認為是經典的自噬途徑(canonical autophagy)。近年來,許多研究表明,細胞傾向于有選擇地借助自噬降解底物,胞內外的各種刺激因素,如細胞器受損、有毒蛋白質的聚集或氧化應激,均可誘導細胞自噬[2]。根據包裹底物的不同,具有底物選擇性的自噬又被分為線粒體自噬(mitophagy)、聚集體自噬(aggrephagy)、過氧化物酶體自噬(pexophagy)、病原體自噬(xenophagy)等。病原體自噬,即細菌等病原微生物入侵時,自噬體包裹入侵的病原后與溶酶體融合,清除胞內細菌[3]。同時,根據自噬體的形成過程及運送方式的不同,可將細胞自噬分為3 類:①巨自噬(macroautophagy):形成具有雙層膜結構的自噬體包裹胞內物質。一般情況下所說的自噬指的是巨自噬[4]。②微自噬(microautophagy):溶酶體或液泡表面的形變直接吞沒胞漿成分[5]。③分子伴侶介導的自噬(chaperone-mediated autophagy, CMA): 具有KEFRQ 樣基序的蛋白在分子伴侶(如HSP70)的幫助下,通過LAMP-2A 轉運體直接轉運到溶酶體[6]。
自噬在清除胞內廢物、維持細胞能量水平、應對環境變化等方面都發揮著重要的作用。細菌感染細胞時,通過多種途徑激活病原體自噬。細胞接受到自噬誘導信號后,在胞漿中形成多個自噬體膜發生中心,形成杯狀的吞噬泡(phagophore),隨后吞噬泡的雙層膜結構延伸,包裹胞漿內的目標組分,封閉后形成300~900 nm 的自噬體,微管相關蛋白輕鏈3(microtubule-associated proteins 1A and 1B, MAP1LC3/LC3)由胞漿(LC3-I)轉位到自噬體膜(LC3-II)。目前認為,自噬體膜并不直接來源于高爾基體或內質網,而是在包漿中重新生成的,具體機制尚不清楚。成熟的自噬體與溶酶體(lysosome)融合形成自噬溶酶體(autolysosome),在自噬溶酶體中,內容物被降解、回收。病原體自噬激活后,一方面通過對包裹細菌的降解限制胞內細菌的增殖,另一方面,包裹細菌的自噬體也為細菌提供了便宜的生存環境,許多細菌進化出在自噬體中增殖后通過破壞自噬體膜逃逸細胞自噬的機制。本文將從細菌激活自噬途徑、自噬反應通路、細菌逃逸或利用細胞自噬機制以及利用自噬治療感染性疾病方法5 個方面展開,深入闡明細菌感染與細胞自噬的動態平衡機制,以期為后續的細胞自噬研究提供資料與參考。
1 細菌激活細胞自噬途徑
自噬體識別胞內細菌并限制其增殖,可視為一種天然免疫(innate immunity)通路。如圖1-A,革蘭氏陰菌外膜的脂多糖(lipopolysaccharide,LPS)或革蘭氏陽菌外壁的肽聚糖(peptidoglycan,PGN)成分分別被toll 樣受體4(toll-like receptor 4,TLR4)或核苷酸結合寡聚結構域1(Nucleotide Binding Oligomerization Domain Containing 1, NOD1)和NOD2 識別,TLRs 與NOD 樣受體(NODlike receptors, NLRs)激活后在細菌入侵細胞、細胞攝取或吞噬細菌時均可促進自噬[7]。如圖1-B,與TLRs 和NLRs 不同,維甲酸誘導基因 Ⅰ 樣受體(Retinoic-acid-inducible gene I like receptors,RLRs)識別病原體核酸,通過激活干擾素調節因子3(interferon regulatory factor 3, IRF)-干擾素(Interferon,IFN)激活天然免疫系統對抗病原感染,自噬負調控RLRs,清除過量產生的IFN 防止長時間激活天然免疫對宿主細胞產生傷害[8]。細菌進入胞質后,還可被選擇性自噬接頭蛋白(sequestosome 1, SQSTM1/p62-like receptors, SLRs)識別[9],已有研究發現多種SLRs 激活自噬通路,如SQSTM1 /p62、NDP52 和OPTN 蛋白等介導細菌識別[10],此外,參與過氧化物酶體和聚集體自噬的NBR1 蛋白等也被發現有類似SLRs 的作用[11]。如圖1-C,除SLRs 介導的選擇性自噬外,補體C3(complement component C3, C3)被證實為病原體自噬的替代激活物,C3 標記細菌后,隨細菌進入胞質,直接與ATG16L1(autophagy-related protein 16 like protein 1)結合,刺激宿主病原體自噬并限制胞內細菌增殖[12]。三重基序家族蛋白(family of tripartite motif,TRIM)在自噬和免疫中也具有關鍵功能,TRIM16在半乳凝素3(galectin 3)的協助下招募ULK1(unc-51-like kinase 1)、BECN1(beclin 1)和ATG16L1操縱轉錄因子EB(transcriptional factor EB, TFEB)的核轉位,激活自噬通路并促進自噬體與溶酶體融合[13]。
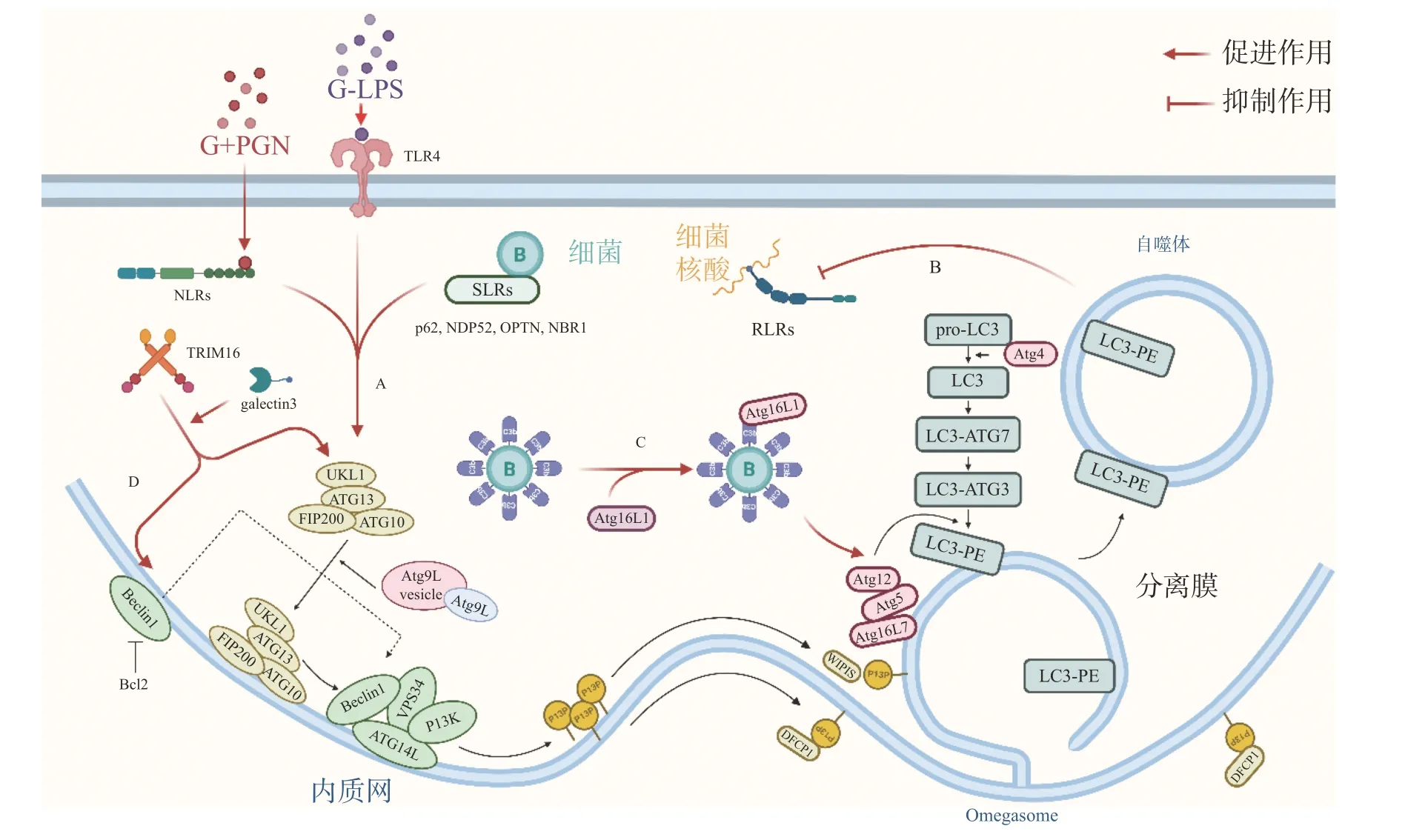
圖1 細菌激活細胞自噬途徑
2 自噬反應通路
自噬激活后,被招募的ULK / ATG1 激酶復合物、Beclin 1、ATG16L1 復合體等自噬相關蛋白(autophagy related protein, ATG)聚集到細菌周圍成核,在ATG12 類泛素化連接系統(ubiquitin like system, UBL)中,ATG12 作為類泛素蛋白與ATG5 共價連接,隨后ATG5-ATG12 與ATG16L1的N 端結合,ATG16L1 中部的螺旋卷曲結構域(coiled-coil domain, CCD)二聚化,形成一個約240 ku 的ATG5-ATG12-ATG16L1 復合物,該復合物發揮類泛素連接酶E3(E3 ubiquitin ligases)的作用,協助磷脂酰乙醇胺(phosphatidylethanolamine, PE)與微管相關蛋白1A / 1B-輕鏈3(microtubule- associated proteins 1A and 1B, MAP1LC3 /LC3)的羧基末端共價連接,組裝、延長吞噬泡的雙層膜結構[14]。LC3 插入到吞噬體(phagosome)的膜結構中,參與其雙層膜的延伸與閉合,促進自噬體的成熟。自噬體成熟后,大部分ATG 蛋白脫離雙層膜,而被PE 修飾的LC3(LC3-PE / LC3-II)仍存在于自噬體的內外膜上,所以,對胞內LC3 的檢測與示蹤是目前常用的檢測自噬通路的方法[15]。自噬體成熟后,突觸融合蛋白17(syntaxin 17,STX17)定位于其外膜,促進自噬體與溶酶體融合,形成自噬溶酶體降解胞內細菌[16]。
除了典型的病原體(圖2-A)激活自噬途徑外,胞漿中的抗菌肽(antimicrobial peptides , AMPs),如泛素偶聯物(ubiquitin conjugates)和核糖體蛋白(ribosomal proteins),也會協助自噬的激活并將自噬體定位到細菌周圍(圖2-B),這種現象被成為抗菌肽遞呈(antimicrobial peptide delivery)[17]。在中性粒細胞等吞噬細胞中,細菌被TLR 或Fc 受體配體識別,LC3、Beclin 1、ATG16L1 復合體轉位到內含細菌的核內體(endosome)膜結構上,促進底物與溶酶體融合(圖2-C),這一過程被稱為LC3 相關吞噬作用(LC3-associated phagocytosis, LAP)。與經典自噬通路不同的是,此時自噬相關蛋白定位的核內體/吞噬體為單層膜結構,其形成需要吞噬細胞NADPH 氧化酶產生的活性氧簇(reactive oxygen species, ROS),而不依賴于ULK 復合物[18]。值得注意的是,自噬體膜被逃逸的細菌破壞后,暴露在膜表面的多糖被半乳糖凝集素(galectin)識別,一方面能促進病原體自噬,另一方面還會誘發自噬介導的膜修復(membrane repair)功能(圖2-D),修復受損的吞噬體膜,延緩細菌逃逸。
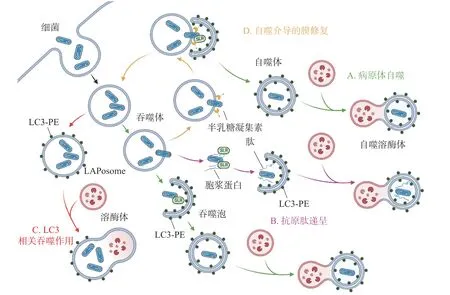
圖2 細菌誘發不同自噬相關通路
3 胞內細菌抑制或逃逸細胞自噬
自噬作為新型天然免疫通路,其模式識別受體(pattern recognition receptors, PRRs)在感染后對病原的特異性識別尤為關鍵。根據遺傳進化與系統發育分析,目前細菌公認有Ⅰ-Ⅶ型分泌系統(secretion systems),其分泌的效應蛋白(effectors)可模擬或直接共價修飾宿主蛋白,實現免疫逃逸。
在自噬激活早期,為躲避細胞自噬,細菌分泌效應蛋白抑制PRRs 的識別。如圖3-A,產單核細胞李斯特菌(Listeria monocytogenes)感染細胞后通過分泌打孔毒素(pore-forming toxin, PFO)、溶血素O(listeriolysin O, LLO)破壞吞噬泡膜,從吞噬泡中逃逸后在細胞質中游離復制[19]。此外,L.monocytogenes表面的ActA 蛋白與細胞Arp2/3 復合物結合,使微絲蛋白聚集,進而躲避自噬PRRs 的識別,當細菌actA基因缺失后,被自噬體包裹的比例明顯增加[20]。A 族乙型溶血性鏈球菌(Group AStreptococcus, GAS)分泌的毒力因子SpeB 可降解包括SQSTM1 / p62、NDP52 和NBR1在內的SLRs,抑制自噬激活[21]。除拮抗SLRs 外,鼠傷寒沙門氏菌(Salmonella typhimurium)感染細胞后釋放的效應蛋白Sop 通過促進TRIM56 和TRIM65 的泛素化使其降解,從而抑制IFN-γ 驅動的自噬[22]。福氏志賀氏菌(Shigella flexneri)分泌的III 型效應蛋白IcsB 或VirA 均可以抑制宿主自噬系統對細菌的識別,且二者獨立作用于自噬通路中[23]。類似地,S. typhimurium或S. flexneri分別進化出膜蛋白酶 IcsP 或PgtE 以擺脫補體C3 的標記從而躲避C3 驅動的細胞自噬[12]。金黃色葡萄球菌(Staphylococcus aureus)分泌的α溶血素(αtoxin, α-hemolysin)可與ATG16L1 及其他一些ATG 蛋白介導外泌體(exosomes)釋放的ADAM10特異性結合,在降低細胞毒性的同時提高細菌的入胞率[24]。
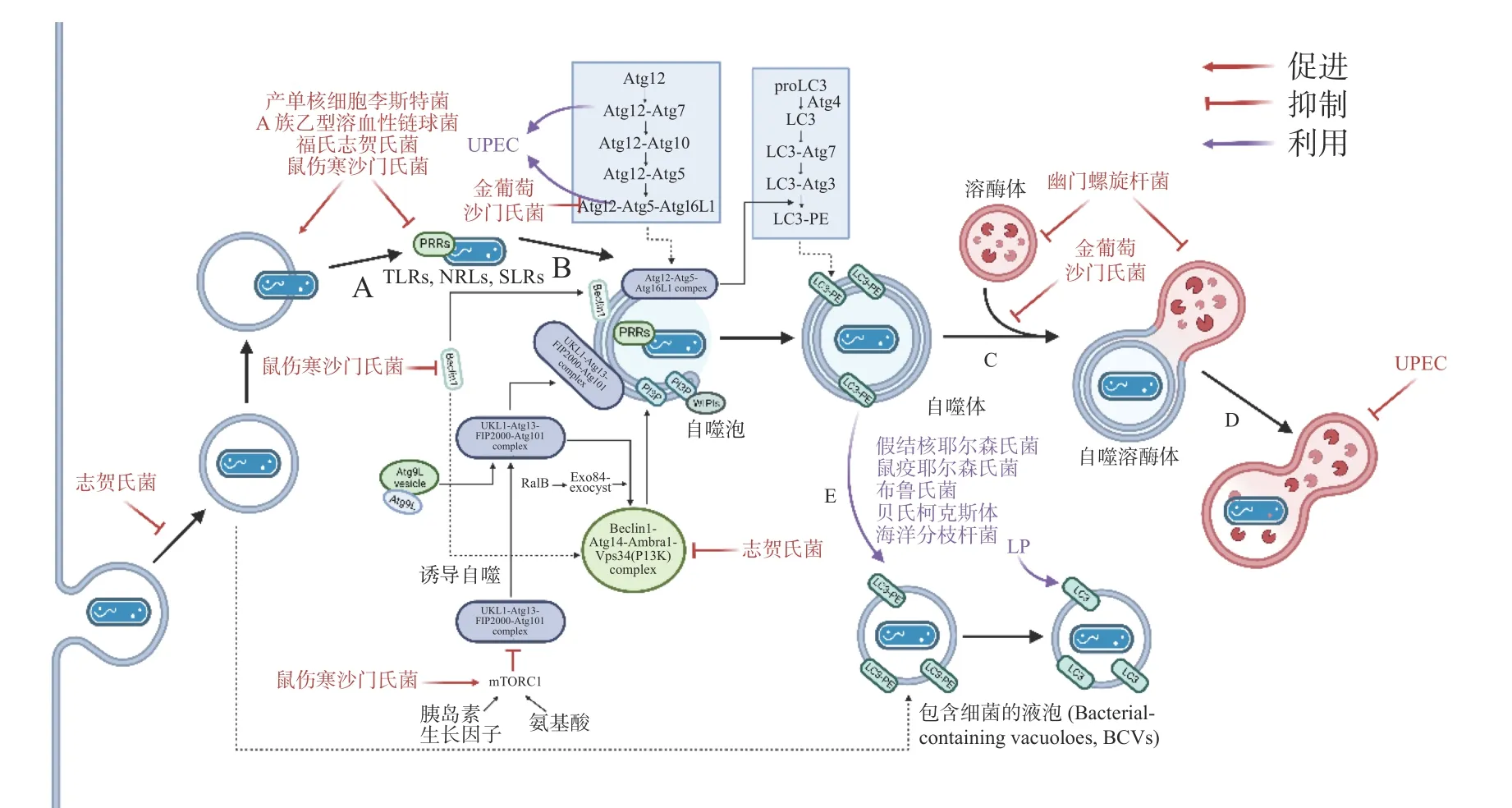
圖3 胞內細菌抑制或利用細胞自噬
病原體自噬激活后,其最大特點是形成一個將待降解物質包裹起來的雙層膜結構,即自噬體。自噬體的形成是病原體自噬應對胞內細菌感染的重要步驟。為抑制自噬體的形成與成熟,諸多細菌進化出干擾ULK1、ATG5 以及ATG16L1等核心ATG 的分子機理,如圖3-C。S. typhimurium通過III 型分泌系統(type III secretion system,T3SS)效應蛋白SrrB 促進單磷酸腺苷活化的蛋白激酶(AMP-activated protein kinase, AMPK)/ Sirt1 /LBK1 復合物的降解來破壞AMPK 途徑的激活,上調mTOR(mechanistic target of rapamycin)水平,抑制ULK 復合物的形成[25]。S. aureus進入NIH 3T3 細胞后,刺激MAPK14 / p38 對ATG5 的磷酸化以抑制自噬體的成熟[26]。Dinic M 等[27]發現這一過程也同時抑制了溶酶體與自噬體的融合。沙門氏菌(Salmonella)T3SS 效應器SseF 和SseG 可破壞GTPase Rab1A 的鳥嘌呤核苷酸交換因子(nucleotide exchange factor, GEF)與轉運蛋白顆粒III(transport protein particle III, TRAPPIII)的相互作用,這將阻礙ULK1 復合物的組裝并下調磷脂酰肌醇3-磷酸(phosphatidylinositol 3-phosphate,PI3P)的合成,抑制吞噬泡的成核及膜延伸。最新研究發現,沙門氏菌效應蛋白SopF 及其等位效應蛋白通過促進ADP 核糖修飾V-ATPase 復合物特異抑制ATG16L1 的招募,且這一修飾不影響VATPase 泵H+的能力[28]。
自噬體與溶酶體的融合后,水解酶(hydrolytic enzymes)、酸性磷酸酶(acid phosphatase)、α-葡萄糖苷酶(α-glucosidase)等溶酶體酶分解、消化胞內菌,這些酶在 pH 值約為5 時活性最佳,因此,抑制自噬體與溶酶體融合、提高自噬溶酶體pH 可促進胞內細菌的存活。生理條件下, 6-磷酸甘露糖受體(mannose-6-phosphate receptors, M6PR)負責將合成的水解酶從反式高爾基體網絡(trans-Golgi network, TGN)運輸到內吞溶酶體[29]。沙門氏菌分泌的效應因子SifA 與小鳥苷三磷酸酶 Rab9 結合,阻斷M6PR 運輸的同時降低水解酶的活性[30]。與沙門氏菌類似,幽門螺桿菌(Helicobacter pylori)入侵細胞后,宿主細胞中M6PR 逆向運輸,溶酶體酸化被抑制[31]。此外,Capurro 等[32]的研究證明,H. pylori產生的空泡毒素A(vacuolating cytotoxin A, VacA)通過靶向溶酶體鈣離子通道 TRPML1 破壞自噬溶酶體的形成,自噬體即便捕獲、包裹了細菌,卻無法借助溶酶體酶殺滅它們,同時,這樣的胞內小室還為細菌提供了較好的增殖環境(圖3-D)。除抑制M6PR 的運輸,尿路致病性大腸桿菌(uropathogenicEscherichia coli, UPEC)通過提高溶酶體pH 值、激活溶酶體特異性鈣離子通道逃避自噬降解,該通道使鈣離子穿過溶酶體膜到胞質,觸發溶酶體的胞吐作用(exocytosis),導致UPEC 的排出[33]。
4 胞內細菌促進并利用細胞自噬
除抑制細胞自噬外,某些胞內寄生菌還能通過誘導、利用自噬促進自身增殖。這些細菌在自噬缺陷細胞中表現出復制缺陷,而用自噬激活劑促進細胞自噬后同時促進了細菌增殖。
自噬為細胞提供基本的營養物質,而在感染情況下,某些細菌入侵細胞后,劫持自噬體或ATG 用于自身復制(圖3-E)。多數情況下,它們會主動誘導自噬,同時阻止自噬體的成熟以及自噬體與溶酶體的融合。UPEC 通過劫持ATG16L1和ATG7 將鐵蛋白上的鐵離子釋放出來,利用游離的鐵離子促進自身的生長[34]。H. pylori利用膽固醇-葡萄糖苷轉移酶(cholesteryl-glucoside transferase)來操縱宿主細胞的膽固醇代謝,將糖基化或脂化的膽固醇用于自身細胞壁合成[35]。此時自噬水平的提高,不僅不能幫助細胞清除細菌,反而促進了細菌對胞內營養物質的獲取。此外,Lai 等[36]發現,H. pylori對膽固醇的代謝調節抑制了溶酶體與自噬體的融合,敲低ATG12、ATG5 以及Beclin1 等ATG 后抑制了H. pylori的胞內增殖。S. aureus的α毒素(α-toxin)可誘導ATG5 依賴性自噬,降低細胞cAMP 水平,去除ATG5 的細胞中S. aureus載量減少,提示自噬是S. aureus增殖所必需的。
細菌入侵細胞后,在宿主細胞內形成包裹細菌的液泡(bacteria-containing vacuoles),這些液泡為細菌的胞內增殖提供了有利的空間和充足的營養,成為細菌利用細胞自噬的策略之一。嗜肺軍團菌(Legionella pneumophila, LP)被細胞吞噬后,在胞內形成包裹軍團菌的液泡(Legionellacontaining vacuoles, LCVs),從內質網(endoplasmic reticulum, ER)招募囊泡并獲得LC3 等自噬標志物,使LCVs 快速轉變為自噬體[37]。這一過程被指依賴于的Ⅳ型分泌系統(Type Ⅳ secretion system,T4SS)效應蛋白LegA9,其通過自噬促進細胞對LCVs 的識別,感染2 h 后抑制細胞自噬,LP 的活率也有所降低,提示LCVs 向自噬的轉變促進了LP 的成活。但是,Choy 等[38]隨后發現,LP 通過分泌LpSPL 和RavZ 特異性識別LC3-II,并將其C 端甘氨酸與酪氨酸之間的酰胺鍵切割,LC3-II 不再能被PE 修飾,所有類型的細胞自噬通路被抑制。LP 一方面通過LegA9 將LCVs 靶向自噬,避免被宿主細胞立刻捕獲殺死;另一方面借助LpSPL 和RavZ 抑制自噬,這樣的雙重策略說明細菌既可以利用細胞自噬實現自身增殖,又通過調節自噬進行免疫逃逸。
除了LP 外,其他一些細菌也采用了類似策略,假結核耶爾森氏菌(Yersinia pseudotuberculosis)在胞內形成包裹耶爾森氏菌的液泡(Yersiniacontaining vacuoles, YCVs), YCVs 上有自噬標志物LC3,雷帕霉素(rapamycin, RAPA)刺激細胞自噬,YCVs 大小增大,液泡內細菌載量增加[39]。不僅如此,Pujol 等[40]發現,鼠疫耶爾森氏菌(Yersinia pestis)也有在LC3-II 修飾的YCVs 中復制的特性,他們推測自噬體可能與次級內體(late endosome)一起作為膜來源,促進YCVs 的延伸與擴展。布魯氏菌(Brucella)在ER 衍生的包裹布魯氏菌的液泡(Brucella-containing vacuoles, BCVs)中復制,BCVs 劫持ULK1、Beclin1 等自噬起始因子,形成類似自噬體的隔室[41]。自噬幫助細菌修復包裹細菌的液泡,在海洋分枝桿菌(Mycobacterium marinum)中更為典型,M. marinum促進自噬相關基因的表達的同時,借助效應蛋白ESX-1 阻斷自噬通量(autophagic flux), 通過促進自噬修復包裹分支桿菌的液泡(Mycobacteria-containing vacuoles,MCVs)[42]。
5 感染性疾病治療中的自噬調節
作為新型天然免疫通路,借助細胞自噬控制胞內細菌的增殖可成為抗生素治療的替代途徑,自噬調節劑不僅能于不同階段調節自噬,還能通過促進或抑制自噬治療感染性疾病。目前,已有一些自噬調節劑于臨床上廣泛使用(圖4-A):RAPA、二甲雙胍(metformin)和利美尼定(rilmenidine)等自噬誘導劑用于預防腎移植排斥或治療2 型糖尿病和高血壓等[43];氯喹(chloroquine,CQ)和羥氯喹(hydroxychloroquine, HCQ)等抗瘧疾藥物目前正作為自噬拮抗劑在臨床試驗中用于治療某些耐藥癌癥[44]。此外,HCQ 聯合強力霉素(doxycycline)被用于治療C. burnetii引起的慢性Q 熱(Q fever)心內膜炎[45]。
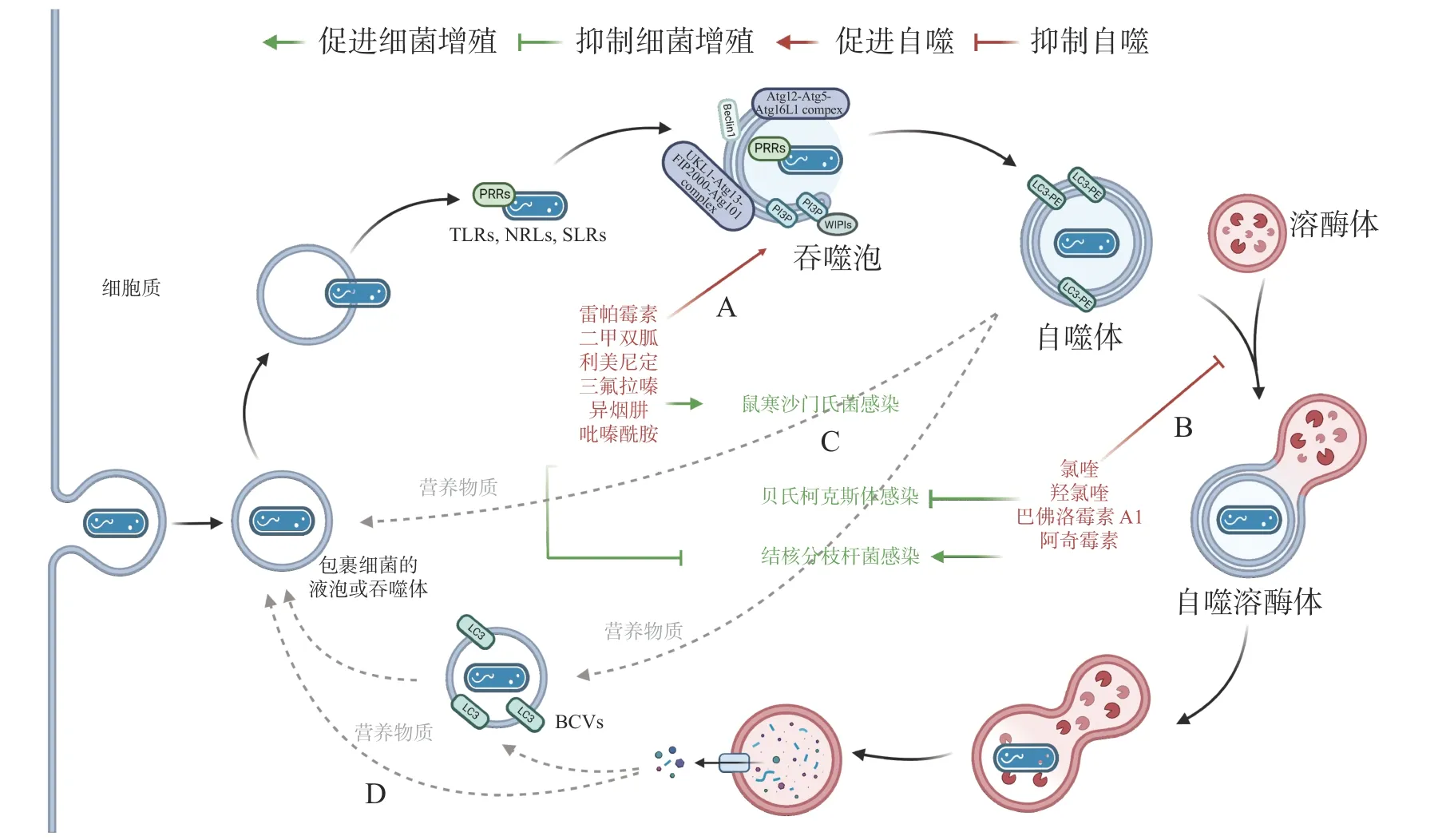
圖4 細胞自噬的藥物調節
有研究發現,異煙肼(isoniazid, INH)和吡嗪酰胺(pyrazinamide, PZA)等是廣泛用于治療結核分枝桿菌(Mycobacterium tuberculosis)的藥物,它們不僅能直接殺死細菌,還能通過誘導細胞自噬,促進宿主對胞內M. tuberculosis的清除[46]。阿奇霉素(azithromycin, AZI)通過抑制溶酶體酸化阻斷M. tuberculosis自噬降解,長期使用AZI 可能導致條件性分枝桿菌感染[47]。INH 或 PZA 等自噬誘導劑可成功治療結核病,而AZI 等自噬抑制劑促進M. tuberculosis感染,表明自噬是細胞對抗M. tuberculosis感染的有效途徑之一。與M. tuberculosis類似,Conway 等[48]發現三氟拉嗪(trifluoperazine)可抑制S. typhimurium在HeLa 細胞中的復制,而這種抑制作用是ATG16L1 依賴的,表明利用細胞自噬可促進胞內細菌的清除(圖4-C)。
藥物調節自噬可作為對抗胞內細菌感染的候選策略,促進細胞自噬在應對一些細菌入侵時效果顯著,但如(圖4-D)所示,UPEC、H. pylori和LP 等細菌利用細胞自噬促進自身生長,所以,在使用自噬調節劑治療傳染性疾病時不僅需要高度謹慎,在治療過程中還須實時監測感染風險。
6 展 望
細菌感染誘發的細胞自噬作為天然免疫及細胞代謝的一部分,是細胞內細菌清除與增殖之間的博弈,有著復雜的分子機理和重要的生物學功能。在細菌入侵過程中,一方面細胞通過自噬途徑清除胞內病原體,另一方面細菌借助自噬獲得胞內營養。目前,細胞如何借助自噬系統識別、清除細菌,細菌進化出了哪些自噬逃逸機制尚不完全明了。今后,隨著更多的自噬相關蛋白及影響自噬通路的細菌蛋白的發現,人們對自噬體識別細菌機制的認識會更加深入。同時,自噬與細胞其他信號通路之間存在著復雜的關聯,簡單地聚焦于細胞自噬與細菌感染的相互作用不能完全解釋胞內細菌載量的變化,需要進一步探索各天然免疫通路之間的竄擾(crosstalk),開展相關研究。
通過研究認識自噬在天然免疫系統中的作用,明確細菌逃逸、利用細胞自噬的分子機理,對于利用自噬調節對抗細菌感染、開發針對細胞內細菌感染的新藥靶點、構建新的細菌防控策略尤為重要。但值得注意的是,細菌感染誘發細胞自噬具有兩面性,在用藥治療的過程中,須高度謹慎,并在治療過程中實時監測。

