18F-FLT Micro PET/CT顯像評價奧拉帕尼對裸鼠乳腺癌模型的放療增敏作用
王思淇,陶偉濤,許阿磊,薛楊央,汪 會
乳腺癌是女性常見的癌癥之一,也是導致女性死亡的主要原因[1]。放療主要依靠高能電離輻射和活性氧的作用,來誘發細胞內DNA鏈的損傷,進而滅殺腫瘤細胞。然而,乳腺癌的放療低敏感性仍然是治療效果不佳的重要原因之一[2-3]。隨著人類對乳腺癌認識的不斷加深,出現了許多分子水平的靶向治療手段,為乳腺癌的治療提供了新方法。聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制劑(PARP inhibitor, PARPi)可以阻斷腫瘤細胞DNA的損傷修復通路并有放療增敏作用[4]。奧拉帕尼(Olaparib)是市場上第一個PARP抑制劑,它可以抑制PARP的活性。PARP是修復單鏈DNA斷裂的一個主要因素。抑制PARP可以導致更多有害的雙鏈DNA斷裂,并增加基因組的不穩定性,導致細胞死亡[5-6]。正電子發射計算機斷層顯像(positron emission computed tomography,PET/CT)是臨床常用的診斷方法,對腫瘤的臨床診斷和療效評價具有重要意義。該實驗通過建立MCF-7乳腺癌裸鼠模型,探討18F-FLT Micro PET/CT顯像在評價Olaparib的放射增敏作用中的價值。
1 材料與方法
1.1 細胞株及主要試劑人乳腺癌MCF-7細胞購自中科院上海細胞庫;胎牛血清和0.25%胰酶均購自美國Gibco公司;Dulbecco改良Eagle培養基(Dulbecco′s modified eagle medium, DMEM)和磷酸鹽緩沖液均購自美國Hyclone公司;Olaparib購自美國Sigma公司;Ki-67及PCNA免疫組化試劑均購自武漢賽維爾生物技術有限公司。
1.2 實驗動物24只雌性BALB/C裸鼠,SPF級,4~5周齡,體質量20~25 g,購自浙江維通利華實驗動物技術有限公司[生產許可證號:SCXK(浙)2019-0001]。該研究動物實驗方案經安徽醫科大學動物實驗倫理審查委員會批準(批號:LLSC20190249)。
1.3 主要儀器Inveon Micro PET/CT購自德國西門子公司;放療采用VARIAN 23 EX 醫用直線加速器購自美國VARIAN公司;FLT前體購自北京派特生物技術有限公司;18F-FLT由上海交通大學醫學院附屬瑞金醫院核醫學科生產,放化純度>95% 。
1.4 腫瘤模型的建立和分組24只BALB/C裸鼠采用隨機數字表法隨機分為4組:對照組、單純放療組、Olaparib組和Olaparib+放療組,每組 6 只。收集處于對數生長期的乳腺癌MCF-7細胞,細胞密度均調整至 5×106個/ml,根據分組然后分別于裸鼠右上肢腋下注射 0.2 ml細胞,待腫瘤最大直徑≥0.8 cm 時進行動物實驗。單純放療組:使用6 Mev電子線進行局部照射,照射野10 cm×10 cm;單次照射劑量4 Gy,隔日照射1次,共4次,7 d完成,累計照射劑量16 Gy;Olaparib組:按照每只每天50 mg/kg的劑量行Olaparib生理鹽水懸濁液灌胃處理,共 7 d。Olaparib+放療組:灌胃方法及劑量同Olaparib組,放療方法及劑量同單純放療組。對照組:給予每天生理鹽水灌胃,未經照射。各組裸鼠治療前一天和治療結束后48 h,分別用游標卡尺測量每只裸鼠腫瘤長短徑,根據公式計算腫瘤體積:體積=長徑×短徑2×0.5。
1.518F-FLT Micro PET/CT顯像與圖像分析4組乳腺癌裸鼠模型均于放療前及第4次放療結束后48 h,行 Micro PET/CT顯像。裸鼠于顯像前夜禁食,可自由飲水。在掃描開始前 60 min,將裸鼠固定,每只裸鼠通過尾靜脈注射18F-FLT約 5.55 MBq(150 μCi),掃描前給予1%異氟烷麻醉并俯臥位固定于掃描床上進行顯像。顯像完成后,由2位高年資的核醫學科醫師對PET /CT 圖像進行分析,選擇病灶18F-FLT放射性濃聚最高的層面測量SUVmax和平均標準化攝取值(SUVmean)作為統計指標。通過公式計算各腫瘤組織TPV:TPV=SUVmean×腫瘤體積。各組裸鼠顯像全部完成后,采取頸椎脫臼法處死裸鼠。
1.6 免疫組化分析取出腫瘤組織,將各組裸鼠移植瘤稱重,然后計算抑瘤率,其公式為:抑瘤率(%)=(對照組腫瘤平均質量-治療組腫瘤平均質量)/對照組腫瘤平均質量×100%。稱量完畢后立即用質量分數4%多聚甲醛溶液固定,石蠟包埋,4 μm切片行Ki-67及PCNA免疫組化檢測。在高倍視野下每張切片隨機選擇5個視野拍照分析,并使用Image-Pro Plus 6.0軟件進行定量分析。

2 結果
2.118F-FLT Micro PET/CT顯像結果24只裸鼠 Micro PET/CT 顯像右上肢腋下均可見結節狀放射性攝取不同程度增高灶,腫瘤與周圍組織分界清晰,部分腫瘤內見片狀放射性攝取缺損區。見圖1。治療前,4 組腫瘤SUVmax、TPV及腫瘤體積差異無統計學意義(F=0.041、0.061、0.045,P>0.05),治療結束后48 h,4 組腫瘤SUVmax、TPV及腫瘤體積差異有統計學意義(F=43.119、13.861、44.313,P<0.001);對照組和Olaparib組腫瘤SUVmax較治療前升高;單純放療組和Olaparib+放療組腫瘤SUVmax較治療前減低,Olaparib+放療組腫瘤的SUVmax、TPV和腫瘤體積均低于單純放療組。見表1。經稱量4組瘤體體質量分別為(1.448±0.115)、(1.103±0.127)、(1.393±0.140)和(0.653±0.150),Olaparib+放療組瘤體體質量明顯低于其他3組(F=44.405,P<0.001),Olaparib+放療組較單純放療組相比瘤體體質量更小(t=5.598,P<0.05)。通過計算單純放療組、Olaparib組和Olaparib+放療組抑瘤率分別為23.82%、3.80%和54.89%。
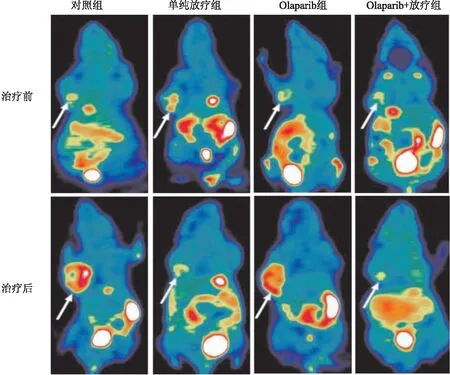
圖1 各組乳腺癌裸鼠治療前后18F-FLT Micro PET/CT 顯像圖
表1 各組乳腺癌裸鼠治療前后腫瘤SUVmax變化
2.2 免疫組化結果Ki-67和PCNA均在腫瘤組織中高表達。4組腫瘤組織中Ki-67表達的平均吸光度值分別為(64.932±7.288)、(49.382±9.482)、(63.748±6.920)、(35.060±7.183),差異有統計學意義 (F=16.289,P<0.001),其中Olaparib+放療組平均吸光度值明顯低于單純放療組(t=2.692,P<0.05)。4組腫瘤組織中PCNA表達的平均吸光度值分別為(80.460±6.702)、(63.280±6.800)、(79.826±3.700)、(48.102±3.885),差異有統計學意義(F=39.645,P<0.001),Olaparib+放療組平均吸光度值明顯低于單純放療組(t=4.333,P<0.01)。見圖2。

圖2 各組荷乳腺癌裸鼠腫瘤組織Ki-67及PCNA免疫組織化結果 ×400
2.3 SUVmax與 Ki-67及PCNA表達的相關性分析腫瘤SUVmax與Ki-67 、PCNA表達均呈明顯正相關(rKi-67=0.920,P<0.01;rPCNA=0.918,P<0.01)。見圖3。
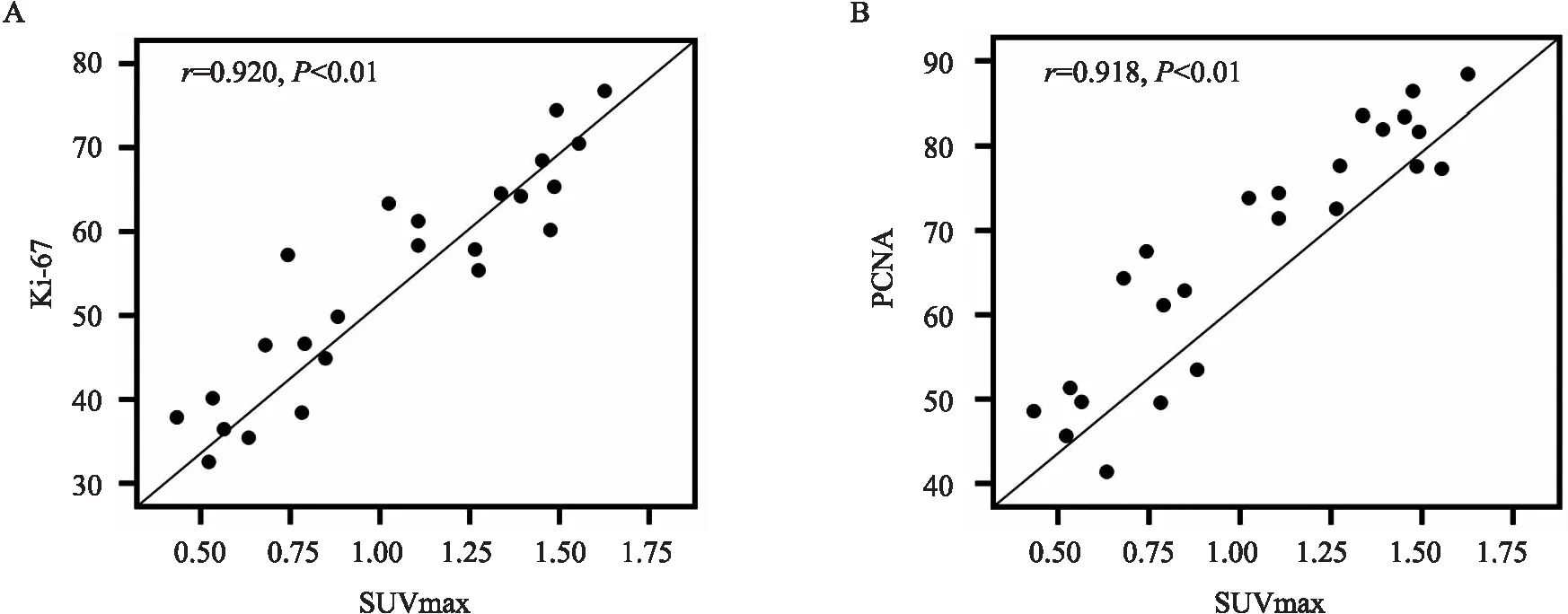
圖3 SUVmax與Ki-67及PCNA表達相關性分析
3 討論
乳腺癌是婦女癌癥死亡的第二大原因[7]。在臨床上由于乳腺癌對放療的敏感性較低,所以放療經常與其他治療方法聯合使用[8]。PARPi是第一個臨床批準的旨在利用合成致死性的藥物,在BRCA1或BRCA2中攜帶種系突變的患者中產生的腫瘤對PARPi敏感。然而,與其他靶向治療一樣,對PARPi的耐藥性出現在晚期疾病中,所以尋求組合治療方法是解決問題的方法之一。如將化療方案與PARPi組合、PARPi與抗CTLA4和抗PD1 / PDL-1等免疫療法的組合、PARPi與癌癥特異性特征起作用的藥物有益地結合等。該文將放療與PARPi結合,通過放療來對DNA鏈造成損傷,PARPi來抑制DNA鏈的修復,增加DNA修復的復雜性,從而造成更大的DNA損傷。Olaparib是PARPi的代表之一,具有抑制單鏈DNA斷裂修復的作用,以加速癌細胞的死亡。在其他研究中,奧拉帕尼還具有放射增敏的效果[9]。該實驗通過體內實驗構建裸鼠MCF-7乳腺癌模型,并將放療與Olaparib兩種治療手段聯合,由實驗結果得出聯合治療比單一治療更能抑制腫瘤的生長,也進一步表明了Olaparib確實具有放射增敏的效果。
PET/CT不僅可以用于乳腺癌的診斷與分析,還可以用于乳腺癌的療效判斷。近年來,18F-FLT作為一種胸苷嘧啶類似物,已被開發為增殖追蹤劑,它可以被胸腺嘧啶脫氧核苷激酶1(thymidine kinase 1,TK1)磷酸化后滯留在細胞內,用PET成像和測量增殖可以為該研究提供一種無創的分期工具和監測并評價放化療對腫瘤的早期療效,已被證實可用于乳腺癌[10],且腫瘤組織攝取18F-FLT的數量分別與Ki-67及PCNA有顯著相關性[11-12]。最大標準化攝取值(SUVmax)是PET/CT在腫瘤診斷中常用的半定量指標,經常被用于多種腫瘤的早期診斷、治療監測及預后評價中,在該實驗中通過監測SUVmax的變化來反映腫瘤組織對18F-FLT的攝取程度從而表現出腫瘤的增殖活性;治療后48 h,單純放療組和Olaparib+放療組的腫瘤SUVmax均較放療前降低,降低了對18F-FLT的攝取,體現出腫瘤組織的增殖受到了抑制;通過比較顯示Olaparib+放療組的腫瘤SUVmax、TPV和腫瘤體積明顯低于單純放療組,Olaparib+放療組的瘤體體質量明顯低于其他3組,并且抑瘤率最高。Olaparib聯合放療比單純放療可以更明顯降低腫瘤組織對18F-FLT的攝取,說明聯合治療可以更大程度上抑制腫瘤組織的增殖能力。
不受控制的增殖是癌癥的標志。在乳腺癌中,免疫組化評估細胞染色中Ki-67的比例已成為比較腫瘤樣品之間增殖的最廣泛使用的方法。Ki-67越來越多地在這些情況下用于臨床研究,包括作為臨床試驗的主要療效終點,有時用于臨床管理[13]。PCNA是DNA復制和修復的重要因素,因其在復制中的作用而被稱為增殖的分子標志物[14]。免疫組化結果顯示接受放療的兩組荷瘤裸鼠Ki-67及PCNA表達均低于未接受放療組,同時,Olaparib+放療組相比單純放療組有著更低的Ki-67及PCNA表達。此外SUVmax與Ki-67及PCNA表達分別均呈正相關,進一步驗證了18F-FLT Micro PET /CT 顯像能反映腫瘤細胞增殖能力。為乳腺癌的治療監測及制定個性化治療策略作出貢獻。

