TMEM106B基因多態(tài)性與阿爾茨海默病發(fā)病的關系及其機制
謝廷飛 譚蘭
(1 青島大學醫(yī)學部,山東 青島 266071; 2 青島市市立醫(yī)院神經內科)
阿爾茨海默病(Alzheimer’s disease,AD)作為全因癡呆的主要病因之一,其兩大核心病理學特征包括神經元細胞外淀粉樣斑塊沉積及神經元細胞內神經纖維纏結形成[1]。2018年,美國國家老齡化研究所和阿爾茨海默病協(xié)會提出β淀粉樣蛋白(Aβ)、病理性tau、神經變性的“研究框架”[AT(N)],用于AD的定義和診斷,還提出可以Aβ作為機體是否處于AD病理狀態(tài)的生物標志物[2]。另外,關于AD病因多項研究結果表明大腦神經元溶酶體功能障礙與AD的形成密切相關[3-4]。TMEM106B是一種編碼溶酶體跨膜蛋白的基因,多項研究發(fā)現(xiàn)其與包括AD在內的多種腦疾病有關[5-8]。前期研究發(fā)現(xiàn)AD患者大腦當中TMEM106B的表達水平(包括mRNA和蛋白)均呈顯著性降低[9],而rs1990622則是位于TMEM106B的3′端非翻譯區(qū),而且能夠多態(tài)性調節(jié)TMEM106B的表達[10],TMEM106Brs1990622與神經絲輕鏈蛋白(NfL)的水平存在著顯著關聯(lián)[11],但是TMEM106B與AD患者腦脊液(CSF)核心蛋白的關系至今尚未明確。另一方面,rs1990622位點多態(tài)性影響左側顳葉體積[12],但其是否影響AD關鍵腦區(qū)體積仍不清楚。故而明確TMEM106B蛋白參與AD的分子機制對于AD致病機制的深入理解以及藥物靶點的開發(fā)研究至關重要。本研究旨在探討rs1990622位點的多態(tài)性與AD神經病理學及影像學表型的關系,為進一步研究TMEM106B參與AD的機制提供依據(jù)。
1 資料與方法
1.1 一般資料
本研究納入研究對象均來自AD神經影像學計劃(ADNI)研究隊列(http://adni.loni.usc.edu)。本研究總共納入了308例非西班牙裔高加索受試者(已檢測TMEM106Brs1990622基因分型,同時評估了AD CSF核心蛋白),將上述308例受試者根據(jù)CSF β淀粉樣蛋白42(Aβ1-42)水平[13]分為AD病理組和非AD病理組。所有納入研究的受試者均具備基線腦結構MRI和各項神經心理學檢查結果,其中167例為載脂蛋白E(APOE) ?4基因攜帶者,141例為APOE?4非攜帶者。
收集患者的年齡、性別、受教育年限、基因型、AD CSF核心蛋白指標[包括Aβ1-42、總tau蛋白(T-tau)和磷酸化tau蛋白(P-tau)]及神經影像學指標[包括海馬、內嗅皮質及顳葉內側MRI結果及氟脫氧葡萄糖正電子發(fā)射計算機斷層掃描(FDG-PET)的標準攝入值(SUV)]。研究人群rs1990622基因分型結果基于Illumina Infinium Human610-Quad分型芯片及Hapmap數(shù)據(jù)庫獲得。具體SNP分型由Illumina BeadStudio軟件生成,并使用PLINK軟件進行了質量控制,標準為最小應答率>90%,最小等位基因頻率>0.01,哈迪溫伯格平衡檢驗P>0.05。FDG-PET SUV的計算以受試者小腦蚓部為參考區(qū)域,通過每個時間點對各受試者5個區(qū)域(左角回、右角回、雙側扣帶后回、左顳下回、右顳下回)進行平均,生成最終SUV[14]。本研究所使用的研究區(qū)域腦結構MRI數(shù)據(jù)來源于ADNI數(shù)據(jù)庫,影像處理技術細節(jié)參考前期發(fā)表文獻[15]。該項研究中僅使用AD相關關鍵腦區(qū)數(shù)據(jù),包括海馬、內嗅皮質、顳葉內側體積和腦容量。
1.2 統(tǒng)計學方法
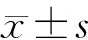
2 結 果
2.1 兩組受試者基本特征比較
納入人群中包括AD病理組受試者234例和非AD病理組74例。兩組受試者年齡、性別、受教育年限、基因型及腦容量比較無明顯差異(P>0.05),但Aβ1-42、T-tau、P-tau水平及APOE?4等位基因攜帶狀態(tài)、FDG-PET SUV、各腦區(qū)(內側顳葉、海馬、內嗅皮質)體積比較差異具有顯著統(tǒng)計意義(t=-6.137~50.792,P<0.05)。見表1。納入的AD關鍵表型在AD病理組和非AD病理組的分布及差異見圖1。

*為P<0.05,***為P<0.001,ns為P>0.05

表1 納入人群基線特征表
2.2 rs1990622位點多態(tài)性與AD生物學及影像學表型的關系
多因素線性回歸分析結果顯示,AD病理組中rs1990622位點多態(tài)性與CSF Aβ1-42水平存在顯著關聯(lián)(β=30.479,t=2.021,P<0.05),見圖2;而非AD病理組中未發(fā)現(xiàn)rs1990622位點多態(tài)性與AD任何關鍵表型存在關聯(lián)。

*為P<0.05,**為P<0.01,ns為P>0.05
2.3 混雜因素分層分析rs1990622位點多態(tài)性與AD關鍵表型的關聯(lián)性
散發(fā)性AD的風險因素包括性別、年齡[16]及APOE?4攜帶狀態(tài)[17],且TMEM106B與AD患者的與年齡[18]、性別[10]、APOE?4攜帶狀態(tài)[19]均有關,因此本研究對這些混雜因素進行分層分析。模型校正因素包括年齡、性別、教育年限、APOE?4攜帶狀態(tài)及基線診斷,腦MRI指標中需額外校正全腦容量。
將234例AD病理組受試者根據(jù)年齡、性別及APOE?4攜帶狀態(tài)進行分層分析,多因素線性回歸分析示,僅女性受試者中rs1990622位點多態(tài)性與CSF Aβ1-42存在顯著關聯(lián)(β=58.637,t=2.664,P<0.001)。見圖3。

**為P<0.01,***為P<0.001,ns為P>0.05
3 討 論
本研究總共納入了308例進行了TMEM106B rs1990622基因分型、人口學統(tǒng)計及AD CSF核心蛋白評估的同質性群體,利用其相關數(shù)據(jù)AD CSF核心蛋白(CSF Aβ1-42、T-tau及P-tau)水平和神經影像檢查結果,系統(tǒng)探討了TMEM106B參與AD的可能機制。結果發(fā)現(xiàn)在存在AD病理的女性人群中rs1990622位點多態(tài)性與CSF Aβ1-42的水平存在顯著關聯(lián)。
最近的一項全基因組關聯(lián)研究(GWAS)使用了包括ADNI的兩個獨立數(shù)據(jù)庫均發(fā)現(xiàn)TMEM106Brs1990622與AD的神經變性標記物CSF NfL水平存在著顯著關聯(lián)[11],為進一步探討TMEM106B與AD關鍵表型的關系,本研究將納入的308例受試者根據(jù)CSF Aβ1-42的水平進行了分組,其結果發(fā)現(xiàn)在AD病理組患者的rs1990622位點多態(tài)性僅與CSFAβ1-42蛋白水平存在著關聯(lián)性,這為未來研究體液TMEM106B蛋白能否在臨床上區(qū)分AD及非AD患者提供了依據(jù)。除此之外,混雜因素也可能會影響TMEM106B在AD中的作用,因此本研究又進一步對常見的混雜因素進行了分層分析,結果發(fā)現(xiàn)rs1990622位點多態(tài)性僅與女性CSF Aβ1-42蛋白水平相關,此結果與HU等[10]研究一致。
TMEM106B是一種溶酶體膜蛋白,在人腦組織中廣泛表達[5]。TMEM106B可與多種蛋白互作影響溶酶體的多項功能[5,20]。部分學者發(fā)現(xiàn)溶酶體酸化失調與AD的疾病風險有關,并且可誘導AD小鼠模型的神經元中Aβ積聚,產生老年斑[3]。而KLEIN等[21]發(fā)現(xiàn)TMEM106B與V型ATP酶復合體的亞基互作影響溶酶體的酸化,這也許能解釋rs1990622位點多態(tài)性與CSF Aβ1-42水平的關聯(lián),即TMEM106B蛋白可能通過調節(jié)溶酶體的酸化影響Aβ的清除,從而參與AD的發(fā)病機制。值得一提的是,TMEM106B基因在各種脊椎動物的進化過程中高度保守[10],為在模式動物中研究TMEM106B功能應用于人類提供了理論依據(jù),加之該基因影響AD的疾病風險且與AD CSF核心蛋白Aβ1-42水平存在關聯(lián),因此未來有必要探明TMEM106B和Aβ蛋白的互作關系及其在AD進程中扮演的角色。
更為重要的是,愈來愈多的研究發(fā)現(xiàn),TMEM-106B(120-154aa)蛋白降解后其片段形成的纖維與包括AD在內的神經退行性疾病關系密切[22-25],研究者們推測TMEM106B(120-254aa)蛋白在溶酶體內外的纖維化將觸發(fā)溶酶體功能障礙,即神經元或膠質溶酶體降解功能顯著降低,導致神經退行性疾病相關病理蛋白質(包括Aβ、TDP-43、tau或α-synuclein)的積累,從而會啟動或加速神經退化,最終引起神經退行性疾病一系列的相關癥狀。這些發(fā)現(xiàn)提示研究TMEM106B蛋白的代謝降解對探究包括AD在內的神經退行疾病的發(fā)生發(fā)展非常重要。
本研究亦存在部分局限性,首先,本研究納入人群缺乏體液TMEM106B蛋白檢測信息,未能全面探討基因表達層面與AD疾病表型的詳細機制,但本文的發(fā)現(xiàn)為后期進行相關臨床及分子研究提供了研究方向;此外,本研究為保證研究人群的同質性,分析隊列僅納入非西班牙裔白種人,因此研究結論的普適性存在一定局限,對于亞洲人群是否也保持結論的一致性,需要未來進一步探討;最后本研究隨訪數(shù)據(jù)經過質控后,納入人群較少,不足以進行相關混合效應模型分析。
綜上所述,本研究結果顯示TMEM106B基因的rs1990622位點多態(tài)性與CSF Aβ1-42水平顯著關聯(lián),表明TMEM106B可能通過影響CSF Aβ1-42蛋白代謝參與AD的疾病過程。根據(jù)TMEM106B對Aβ蛋白的潛在影響,調控TMEM106B表達可能是未來AD治療新的切入點。
作者聲明:譚蘭、謝廷飛參與了研究設計;謝廷飛參與了論文的寫作和修改。所有作者均閱讀并同意發(fā)表該論文,且均聲明不存在利益沖突。

