針灸預處理對急性胃黏膜損傷大鼠GRP78/Caspase-12/CHOP信號通路的影響
霍新慧,周知然,韋 芳,李 盼,蘭永利
(1.新疆醫科大學中醫學院,新疆 烏魯木齊 830001;2.新疆維吾爾自治區中醫醫院消化科,新疆 烏魯木齊 830099)
急性胃黏膜損傷(Acute gastric mucosal lesion,AGML)是指在內外部不良刺激的作用下,如顱內病變、嚴重外傷、大手術、休克,導致機體胃黏膜損傷,出現胃黏膜糜爛、潰瘍甚至出血的急性應激性病變。近年來,胃黏膜損傷的發病率呈上升趨勢。臨床上通常采用藥物治療,但存在不良反應,不適合長期使用。近年來,“治未病”逐漸成為研究熱點,針灸在該領域中占據著非常重要的作用[1]。本課題組前期研究已證實,針灸足三里穴、中脘穴可以加強胃黏膜微循環屏障,改善胃黏膜損傷[2]。內質網應激(Endoplasmic reticulum stress,ERS)是炎癥的特征之一,各種應激狀態均可導致ERS[3]。炎癥參與AGML的發生發展,葡萄糖調節蛋白78(Glucose-regulated protein 78,GRP78)作為ERS的標志性蛋白,是內質網跨膜蛋白的受體分子伴侶[4]。在機體ERS時,GRP78表達上調,從而發揮保護細胞的作用。CCAAT增強子結合蛋白同源蛋白(CCAAT enhancer-binding protein homologous protein,CHOP)是C/EBP轉錄因子家族中的一種重要蛋白,其在C/EBP基因中的作用是誘導細胞凋亡,所以CHOP蛋白表達水平可在一定程度反映ERS介導的細胞凋亡程度[5]。研究表明,半胱氨酸蛋白水解酶-12(Cysteine protein hydrolase-12,Caspase-12)基因表達水平在ERS誘發的凋亡過程中起著重要的促進作用,也是ERS誘導細胞凋亡的另一種信號轉導途徑,在內質網應激誘導的細胞凋亡途徑中具有關鍵作用[6-7]。因此,本研究通過建立急性胃黏膜損傷動物模型,進一步研究針灸預處理對急性胃黏膜損傷大鼠胃黏膜組織病理學及GRP78/Caspase-12/CHOP信號通路的影響。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物:SPF級健康大鼠52只,清潔級,雌雄各半,體重(180±20)g,由新疆醫科大學動物實驗中心提供。實驗動物使用許可證編號:SYXK(新)2018-0003。常規飼養,實驗室溫度(22±2)℃,相對濕度55%~60%,光照明暗交替12 H/D,自由飲食、飲水。實驗過程中動物處置方式與《關于善待實驗動物的指導性意見》以及相關動物倫理學要求一致。
1.1.2 實驗試劑及儀器:一次性針灸針(0.25 mm×13 mm,華佗牌);特制香煙型純艾條(4 mm×120 mm,南陽漢醫艾絨公司);懸灸支架(蘄春上工記艾灸器具公司);阿司匹林腸溶片(國藥準字HJ20160685,拜耳醫藥公司);大鼠腫瘤壞死因子-α(TNF-α) ELISA試劑盒(批號ZK-6601,上海臻科生物科技);大鼠白介素-1β(IL-1β) ELISA試劑盒(批號ZK-6601,上海臻科生物科技);大鼠環氧化酶-2(COX-2) ELISA試劑盒(批號ZK-6601,上海臻科生物科技);DAB顯色液(批號2040A1012,北京中杉金橋);酶標分析儀(型號Infinite F50,上海生物科技);顯微鏡(型號BX51T-PHD-J11,日本奧林巴斯);切片機(型號RM2016,德國徠卡)。
1.2 實驗方法
1.2.1 實驗動物分組與干預:52只健康大鼠在動物實驗室適應性飼養7 d,然后隨機分為正常組、模型組、艾灸預處理組、針刺預處理組,每組13只。正常組和模型組大鼠進行常規飼養,將大鼠自然固定于鼠板上,每次20 min,每日1次,共7 d。艾灸預處理組將大鼠仰臥位固定于鼠板上,參照《實驗針灸學》[8]中常用動物(大鼠)穴位定位法選取足三里穴(雙側)、中脘穴進行艾灸治療。操作方法:取穴后用彎剪剪去施灸點局部毛發,然后用記號筆標記穴位,將隔熱貼打孔,孔徑為0.5 cm,貼于選取的穴位及對照點處,艾條點燃后放置于艾灸架上,正對施灸部位,保持距離2 cm左右,3個穴位同時開始施灸,施灸溫度42 ℃左右,每次艾灸20 min,每日1次,共7 d。針刺預處理組:大鼠固定方式、所選穴位、治療時間和艾灸預處理組相同,針刺方法為指切進針法,操作者左手食指按壓所刺腧穴位置旁邊部位,用右手持針,緊靠左手指甲面快速進針,間隔5 min進行提插捻轉。每次均由同一人對大鼠進行操作。
1.2.2 模型的建立:參照課題組前期實驗制備AGML模型[9]。第7天艾灸預處理結束后,四組大鼠禁食不禁水24 h,第9天開始對各組大鼠進行無水乙醇聯合阿司匹林混懸液灌胃,建立AGML模型。按0.6 ml/100 g的劑量用灌胃針頭將無水乙醇注入模型組、艾灸預處理組、針刺預處理組大鼠胃內,1 h后再將200 mg/kg阿司匹林混懸液0.1 ml/100 g注入大鼠胃內,連續造模7 d。
1.2.3 取材:造模結束后,各組大鼠禁食24 h,禁水8 h,用10%水合氯醛0.3 ml/100 g腹腔注射麻醉,麻醉滿意后,暴露腹腔,取腹主動脈血,常溫靜置后,離心機離心取上清液,檢測相關因子水平。將大鼠全胃取出,用冰0.9%氯化鈉溶液沖洗,肉眼觀察胃黏膜損傷情況,蘇木素-伊紅(HE)染色觀察其組織病理學改變。
1.3 觀察指標
1.3.1 —般情況:每日定時觀察各組大鼠毛發光澤、飲食水量、大小便、精神狀態及活動情況,定期監測大鼠體重。
1.3.2 胃黏膜損傷指數(UI):按GUTH法計算評定UI[10]。損傷長度≤1 mm為1分;1 mm<損傷長度≤2 mm為2 分;2 mm<損傷長度≤3 mm為3分;3 mm<損傷長度≤4 mm為4分;損傷長度>4 mm為5分;損傷寬度>2 mm者計分加倍。每只大鼠的UI為各分值累計相加。
1.3.3 AGML大鼠組織病理學觀察:取1.0 cm×0.5 cm大小的胃黏膜組織,4%多聚甲醛固定標本、脫水、石蠟包埋、切片,HE染色后光鏡下觀察大鼠胃黏膜組織病理形態。
1.3.4 ELISA檢測血清炎癥因子水平:將大鼠血液標本常溫靜置10~15 min,4 ℃,3000 r/min離心20 min,提取上清液置于EP管中,-80 ℃冰箱保存待檢。ELISA法檢測胃黏膜損傷大鼠血清TNF-α、IL-6、COX-2水平。實驗過程嚴格按照ELISA試劑盒說明書執行。
1.3.5 免疫組化法檢測大鼠胃黏膜組織GRP78/Caspase-12/CHOP通路蛋白表達:檢測過程中嚴格遵照試劑盒說明書操作,常規石蠟包埋、組織切片經抗原修復后,滴加正常山羊血清液室溫封閉,滴加一抗工作液,4 ℃過夜,PBS洗滌3次后,滴加生物素化第二抗體、辣根酶標記鏈霉卵白素工作液,DAB顯色,復染,常規樹脂封片,鏡下觀察。
1.4 統計學方法 本研究采用SPSS 26.0統計學軟件進行數據分析。計數資料用均數±標準差表示,組間方差齊時采用單因素方差分析;P<0.05表示差異有統計學意義。
2 結 果
2.1 各組大鼠一般情況比較 在造模前、艾灸預處理及針刺預處理期間,四組大鼠毛發光澤,飲食水量、大小便、精神等一般狀態均正常,體重增加。在造模后,與正常組大鼠比較,模型組大鼠毛發無光澤,飲食水量減少,大便稀溏,精神不振,蜷縮懶動,狀態差,體重下降(P<0.05);與模型組比較,艾灸預處理組、針刺預處理組大鼠一般情況有明顯改善,體重增加(均P<0.05),且艾灸預處理組較針刺預處理組大鼠體重改善更明顯(P<0.05)。見表1。

表1 各組大鼠體重比較(g)
2.2 各組大鼠UI評分比較 見表2(圖1)。正常組大鼠胃黏膜光滑完整;模型組大鼠胃黏膜可見斑點狀破潰出血灶,UI評分顯著高于正常組(P<0.05);艾灸預處理、針刺預處理組大鼠胃黏膜僅見少量斑點狀出血點,UI評分明顯低于模型組(均P<0.05);與針刺預處理組比較,艾灸預處理組大鼠UI評分顯著降低(P<0.05)。

表2 各組大鼠UI評分比較(分)
2.3 各組大鼠胃黏膜組織病理學觀察 光鏡下,正常組大鼠胃黏膜表面上皮結構清晰完好,細胞排列整齊有序,未發現充血、紅染、脫落等炎性細胞浸潤現象。模型組大鼠胃黏膜上皮細胞結構破壞,結構不完整,細胞分布錯亂無序,細胞內可見明顯充血,表現出紅染的征象,出現炎癥細胞浸潤,胃黏膜組織損傷明顯。針刺、艾灸預處理組大鼠胃黏膜損傷征象明顯減輕,胃黏膜結構比較清晰,細胞部分有脫落,細胞內充血、紅染等病理征象明顯改善,炎癥細胞浸潤較少,且艾灸預處理組大鼠胃黏膜損傷減輕更明顯,可見新生的肉芽組織。見圖2。

圖2 各組大鼠胃黏膜組織病理學改變(HE染色,×400)
2.4 各組大鼠血清TNF-α、IL-6、COX-2水平比較 見表3。與正常組比較,模型組大鼠血清TNF-α、IL-6、COX-2水平顯著升高(均P<0.05)。與模型組比較,艾灸預處理組、針刺預處理組大鼠血清TNF-α、IL-6、COX-2水平顯著降低(均P<0.05),且艾灸預處理組降低更明顯(均P<0.05)。
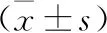
表3 各組大鼠血清TNF-α、IL-6、COX-2水平比較
2.5 各組大鼠GRP78、Caspase-12、CHOP表達情況比較 與正常組比較,模型組GRP78、Caspase-12、CHOP呈強陽性表達,細胞內充滿大量棕黃色顆粒;與模型組比較,針刺、艾灸預處理組大鼠GRP78、Caspase-12、CHOP結果陽性細胞數量減少,細胞內棕黃色顆粒減少,表達減弱,呈弱陽性,艾灸預處理組減少更明顯。見圖3。

圖3 各組大鼠GRP78、Caspase-12、CHOP水平比較(免疫組化染色,×200)
3 討 論
現代醫學研究認為,AGML是臨床常見的急癥,而炎癥反應是胃黏膜損傷難以改善和易反復發作的主要原因[11]。炎性因子TNF-α、IL-6是炎癥反應的重要標志物,可用于評價胃黏膜損傷的炎癥反應程度[12-13]。TNF-α、IL-6與胃黏膜損傷密切相關,TNF-α不僅能活化炎性細胞,加重炎癥反應,還是導致潰瘍愈合困難、反復發作的重要原因[14]。COX-2是消化道疾病發生發展的危險因素[15],也是引起炎癥反應的關鍵因素之一,在正常組織細胞中或者炎癥反應程度較低的組織中,COX-2含量極低或不表達;但當細胞受到炎癥等刺激時,其在炎癥細胞中會迅速合成并釋放,含量可升高至正常水平的10~80倍[16],導致炎癥反應和組織損傷。且有研究發現,COX-2水平在胃潰瘍組織中呈高表達,通過抑制COX-2可減少胃酸分泌,促進胃潰瘍愈合,減少復發[17-19]。胃黏膜在受到一定程度損傷后,可激活機體修復功能,其機制主要通過損傷后的上皮細胞增生來實現,多種保護因子參與了胃黏膜的細胞增殖修復過程,從而提高了胃黏膜的保護及防御功能,促進胃黏膜修復,避免損傷向深層發展[20-21];而應激狀態下,胃黏膜細胞糜爛充血導致表面上皮細胞再修復能力下降,促進炎癥因子TNF-α、IL-6、COX-2分泌,降低了黏膜自身的防御修復作用[22]。
研究表明,針灸預處理對胃黏膜具有一定的保護作用[23]。如明代高武在《針灸聚英》中首次提出“逆針灸”,即在疾病尚未發生時采用針灸治療,能扶助正氣,防止疾病發生。艾灸作為中醫的一種外治療法,對胃脘系疾病具有比較好的預防及治療作用[24]。在機體尚未發病時,通過艾灸對某些腧穴進行溫熱刺激,以激發人體經脈之氣,提高身體抵抗力和應變能力,降低免疫細胞對炎癥的反應,促進炎癥消除和組織的恢復,從而達到預防和治療的目的[25-26]。大量臨床和實驗研究結果也表明,艾灸能啟動抗炎、抑制凋亡、促修復等一系列抗胃黏膜損傷效應[27-28]。
胃黏膜損傷性疾病根據其臨床表現和特點可歸屬于中醫“胃脘痛”范疇。足陽明胃經與胃腑疾病有著密切的關系。足三里穴為足陽明胃經的合穴及胃之下合穴,具有益氣養血、調節胃腸功能、提高免疫力的作用[29-30]。故治療胃脘部疾病可首選足三里穴。歷代文獻對足三里穴的主治記載甚廣,曾有“三里功多數不清”之說。《針灸大全》云:“能通心腹脹,善治胃中寒,腸鳴并泄瀉”,《靈樞》中指出:“合治內府”,《養生類纂》說:“三里,五臟六腑也,溝渠也,常欲宣通,即無風疾”等,均可以采用針灸足三里穴治療胃脘部疾病。中脘穴位于任脈上,在心蔽骨與臍連線的正中,是足陽明胃經的募穴,特定穴中八會穴的腑會,也是手太陽經、手少陽經、足陽明經、任脈之會。中脘穴位于胃的中部,是養胃的重要穴位,具有疏肝養胃、和胃降逆、健脾利濕之效,主治一切腑病,尤胃腑優先[31-32]。足三里穴與中脘穴之配伍,屬于“合募配穴”,合用擅長治療胃病,調理胃腑。故本實驗選取了“足三里”“中脘”兩個穴位,均能治療胃部疾病,聯合使用效果更好。
本研究結果所示,無水乙醇結合阿司匹林混懸液灌胃建立大鼠AGML模型,模型組大鼠出現飲食水量減少,精神活動等一般狀態不佳,體重下降。HE染色結果可見大鼠胃黏膜上皮細胞結構破壞、充血、炎癥細胞浸潤、胃黏膜組織損傷明顯等病理征象,血清中促炎性細胞因子濃度升高。預先給予艾灸、針刺足三里和中脘穴的大鼠,促炎因子濃度低于模型組,可明顯減輕大鼠胃黏膜損傷,上皮細胞表面部分脫落,細胞內充血明顯改善,炎癥細胞浸潤較少,胃黏膜結構比較清晰,且作用較針刺預處理明顯。這可能與針灸能調節和恢復胃腸功能、增強自身防御、抑制ERS、降低炎性因子有關。
GRP78、Caspase-12、CHOP作為ESR的標志物,能釋放大量促炎因子,AGML在應激狀態下能使GRP78、Caspase-12、CHOP陽性細胞增加,從而啟動細胞凋亡通路。本研究采用免疫組化法檢測各組大鼠胃黏膜組織,結果可見模型組GRP78、Caspase-12、CHOP細胞表達呈強陽性,針刺、艾灸預處理組大鼠GRP78、Caspase-12、CHOP表達減弱,艾灸預處理組減少更明顯,提示針灸能減輕大鼠胃黏膜炎癥反應,抑制血清中促炎因子水平,釋放抗炎因子,促進胃黏膜損傷修復愈合,發揮胃黏膜保護作用。
綜上所述,針灸預處理可減輕AGML大鼠炎癥反應,其作用機制可能是通過抑制ERS,基于GRP78/Caspase-12/CHOP信號通路預防大鼠胃黏膜損傷。

