基于核酸適配體的納米金比色法快速檢測腸炎沙門氏菌
董蕾,黃利華,江津津,鄭玉璽
(廣州城市職業學院食品科學與美食養生學院,廣東 廣州 510650)
食源性致病菌是導致食品安全事件頻發的主要原因之一。在世界范圍內,每年感染沙門氏菌(Salmonella spp.)導致死亡或患病而造成的直接經濟損失超30 億美元[1-2]。沙門氏菌常見的主要有鼠傷寒沙門氏菌、腸炎沙門氏菌和豬霍亂沙門氏菌等,是引起全球細菌性食物中毒的主要食源性致病菌之一,其中腸炎沙門氏菌(Salmonella enteritidis)由于不分解蛋白質,食品基本不會發生感官變化,十分容易被忽略[3]。
傳統食源性致病菌檢測方法包括平板分離法[4]、分子生物學方法[5-7]、免疫學方法[8]等。平板分離法作為食品安全檢驗的金標準,需要依靠增菌培養、生化鑒定、血清分型等,其檢測周期長、靈敏度不高;同時檢測過程中可能出現非目標菌干擾、污染、質粒轉移等問題,影響檢測結果,出現假陽性或假陰性的問題[9];分子生物學方法要求技術條件高、檢測過程中一旦出現環境污染,則極易出現假陽性現象,影響檢測結果;免疫學方法前期抗體制備周期長、研發成本高、抗體穩定性較差,且易受檢測環境影響,很難滿足食品安全快速檢測中對食源性致病菌快速、靈敏、特異的檢測需求[10]。
適配體是一類能夠與蛋白結合、產生高特異性和親和度的單鏈核酸序列[11],其通常僅含有15~40 個堿基,分子量為5~25 kDa。其片段短、性質穩定,因此環境適應性好、易保存、不易降解;同時由于適配體為單鏈寡核苷酸DNA 或RNA,可形成各種所需的空間構象(如發卡結構、G-四聚體等),與食源性致病菌的標志性蛋白或致病毒素的特異性結構高特異性結合,而不與其他類似結構物產生交叉反應[12-13],從而實現高特異性識別和高親和性結合靶物質。且靶物質可為生物分子、化學分子及細胞等多種物質,探針也具有分子量小、無免疫原性、修飾簡單等特點[14-16],因此被廣泛應用于藥物生產、醫學檢測等領域[17]。近年來,研究者利用核酸適配體進行沙門氏菌檢驗,如Duan 等[18]篩選鼠傷寒沙門氏菌核酸適配體,將其結合熒光技術檢測鼠傷寒沙門氏菌,其檢出限可達25 CFU/mL;Xu等[19]結合金納米顆粒變色效應檢測沙門氏菌和大腸桿菌O157:H7,當有靶標出現時,金納米顆粒由紅色變為藍或紫色,其檢出限為105CFU/mL;Yuan 等[20]利用納米金適配體進行鼠傷寒沙門氏菌檢測時,檢出限可達7 CFU/mL,實現鼠傷寒沙門氏菌的可視化檢測,且檢測結果與傳統方法一致。
納米金(nano-gold,AuNPs)是金的微小顆粒,其具有優異的催化活性和獨特的光學特性,能與多種生物大分子結合,且不影響其生物活性。中等粒徑(10~20 nm)大小的納米金在分散態下呈紅色,高鹽情況下凝聚成藍色,而在含有單鏈DNA(ssDNA)條件下,ssDNA 的正電荷堿基自由狀態暴露,通過靜電吸附在納米金上,使納米金在高鹽溶液中仍保持穩定性,納米金溶液仍為紅色[21-22]。通過納米金進行檢驗,產生的變色比色反應,其靈敏度可達熒光檢測法的靈敏程度[23-24]。納米金在存在特異性靶標的情況下,適配體形成特定三維結構,與靶標特異性結合;而未吸附適配體的納米金則在高鹽溶液中發生聚集,最終使溶液呈深藍色。
本文通過配制納米金溶液,結合已開發的腸炎沙門氏菌核酸適配體,通過優化腸炎沙門氏菌適配體濃度,研究納米金-適配體體系的腸炎沙門氏菌檢測限、特異性及適用溫度;同時以人工污染樣品為例,評價納米金-適配體的加標回收率,從而構建一種操作成本低、特異性強的腸炎沙門氏菌檢測方法。同時,通過更換其他致病菌特異性的適配體,又可進行其他致病菌的快捷檢測,具有良好推廣效果。
1 材料與方法
1.1 主要材料及藥品
標準菌株:大腸埃希氏菌(Escherichia coli)標準菌株ATCC25922、金黃色葡萄球菌(Staphylococcus aureus)標準菌株ATCC6538、腸炎沙門氏菌(Salmonella Enteritidis)標準菌株CMCC(B)50335,購自中國醫學細菌菌種保藏管理中心。
冷鮮雞肉:市售,散裝稱重,于4 ℃保存。
木糖-賴氨酸-硫酸四癸鈉瓊脂(xylose-lysinesodium tetrahydrosulfate agar,XLT4)、腦心浸液肉湯(brain heart infusion broth,BHI)、緩沖蛋白胨水(buffered peptone water,BPW)、M9 基礎培養基(M9 minimal medium)、LB 培養基(Luria-Bertani):廣東環凱生物科技有限公司;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)(分析純):賽默飛世爾科技(中國)有限公司;聚乙二醇20000(polyethylene glycol,PEG)、三羥甲基氨基甲烷[tris(hydroxymethyl)aminomethane,Tris]、NaCl、KH2PO4、KCl、MgCl2、4-羥乙基哌嗪乙磺酸、氯金酸(HAuCl4·4H2O)、檸檬酸三鈉(均為分析純):上海阿拉丁生化股份有限公司;腸炎沙門氏菌核酸適配體序列參考Joshi 等[25],序列:5'-TAT GGC GGC GTC ACC CGA CGG GGA CTT GAC ATT ATG ACA G-3';引物1和引物2 分別為5'-GGT GAC GCC ATA-3'和5'-CTG TCA TAA TGT C-3'由生工生物工程(上海)股份有限公司合成。
1.2 儀器與設備
85-2ws 加熱型磁力攪拌器:上海滬析實業有限公司;UV1810S 型紫外分光光度計:青島聚創環保有限公司;LDZX-40AI 立式自動電熱壓力蒸汽滅菌器:上海申安醫療器械廠;DH5000AB 型電熱恒溫培養箱:天津泰斯特儀器有限公司;SW-CJ-1F 超凈工作臺:蘇州安泰空氣技術有限公司。
1.3 方法
1.3.1 納米金溶液制備
錐形瓶中加入95.8 mL 超純水和4.2 mL 氯金酸溶液,磁力加熱攪拌器混勻后,加入10 mL 檸檬酸三鈉溶液和5 mL PVP,持續攪拌加熱至溶液變紅,靜置冷卻至室溫。
1.3.2 檢測條件優化
1.3.2.1 菌種活化及菌懸液制備
3 種試驗菌株接種于腦心浸液肉湯并涂布LB 平板劃線,挑取單菌落于10 mL 營養肉湯中,37 ℃振蕩培養(150 r/min)至達到對數生長期。4 ℃、2 850 r/min離心20 min,利用預冷的PBS 緩沖液(pH7.5)清洗2次,無菌水重懸,調整菌液濃度為1×109CFU/mL,此時OD550nm為6.30。
1.3.2.2 適配體濃度篩選
在96 孔板中加入1×109CFU/mL 的菌液50 μL,再分別加入等體積濃度為0、10、20、50、100、150、200、400、600、800、1 000 nmol/L 的適配體,混勻孵育5 min。加入納米金溶液50 μL,平衡5 min,加入10 μL 5 mol/L NaCl 溶液,平衡5 min 后比色拍照,篩選最佳適配體濃度。
1.3.2.3 適配體-納米金溶液腸炎沙門氏菌檢測限測試
梯度稀釋菌懸液,使菌懸液濃度分別為101~109CFU/mL。96 孔板中分別加入1.3.2.2 中篩選出的最佳適配體濃度的適配體50 μL,再依次加入101~109CFU/mL 菌懸液50 μL,混勻孵育5 min,加入50 μL納米金溶液,平衡5 min,加入10 μL 5 mol/L NaCl 溶液,平衡5 min 后比色拍照,確定腸炎沙門氏菌的檢測限。
1.3.2.4 適配體-納米金溶液特異性檢測
分別加入3 種試驗菌株1×109CFU/mL 菌懸液50 μL,加入最佳適配體濃度適配體50 μL,混勻孵育5 min,加入納米金溶液50 μL,平衡5 min,加入10 μL 5 mol/L NaCl 溶液,平衡5 min 后比色拍照,檢測腸炎沙門氏菌適配體-納米金溶液的特異性。
1.3.2.5 適配體-納米金溶液的適用溫度測定
96 孔板中加入50 μL 1×109CFU/mL 的菌液、最佳適配體濃度適配體50 μL,混勻孵育5 min 后,加入納米金溶液50 μL,平衡5 min。加入10 μL 5 mol/L NaCl溶液后,置于15、25、35 ℃的水浴中,測定該體系的適用溫度。
1.3.3 人工污染樣品檢測
冷鮮雞肉切塊,生理鹽水沖洗,超凈臺紫外照射30 min,經GB 4789.4—2016《食品安全國家標準食品微生物學檢驗沙門氏菌檢驗》[26]方法檢測,無腸炎沙門氏菌檢出。稱取50 g 雞肉塊為1 份,分別浸入102~109CFU/mL 的菌液中,放置1 h。取出后,利用生理鹽水充分浸泡振蕩30 min。沖洗溶液取50 μL 進行平板計數,另取50 μL 進行納米金-適配體檢驗,以開始出現顏色變化所對應的平板計數濃度為納米金-適配體的加標回收率。
1.4 數據處理
數據處理采用SPSS 18.0 軟件進行分析,顯著性分析為ANOVA(One-way analysis of variance,the Duncan test),多重比較采用LSD 檢驗。
2 結果與分析
2.1 適配體-納米金溶液檢測腸炎沙門氏菌
基于納米金溶液在高鹽環境下所產生的凝聚顏色變化原理[21,27-28],適配體-納米金法檢測腸炎沙門氏菌的顏色變化如圖1 所示。若溶液中僅存在納米金,則在高鹽溶液環境下,會發生凝聚現象,使溶液變為藍色;而當溶液中存在納米金和適配體時,由于納米金表面吸附了適配體,不會在高鹽環境中發生凝聚,因此溶液仍為紅色;當溶液中存在靶標菌(腸炎沙門氏菌)時,適配體與靶標細菌特異性結合,而未結合適配體的納米金即在高鹽環境下發生聚集,使溶液呈現深藍色。

圖1 適配體-納米金腸炎沙門氏菌檢測體系Fig.1 Aptamer nano gold detection system for Salmonella enteritidis
由圖1 及納米金溶液在高鹽環境下的凝聚顏色變化原理可知,管1 中包含靶標細菌(腸炎沙門氏菌)、適配體和納米金,靶標菌與適配體結合呈現的藍色與未結合適配體的納米金在高鹽環境下發生凝集,使藍色加深,呈現深藍色;管2 中只有靶標菌及適配體,兩者結合呈現藍色;管3 中僅有適配體和納米金,納米金在高鹽環境下呈現紅色。結果表明,當測試溶液中包含靶標菌時,該體系應呈現深藍色。
2.2 最佳適配體濃度篩選
最佳適配體濃度篩選結果如圖2 所示。

圖2 最佳適配體濃度篩選Fig.2 Optimal aptamer concentration screening
由圖2 可知,當腸炎沙門氏菌濃度為109CFU/mL時,分別測試添加0、10、20、50、100、150、200、400、600、800、1 000 nmol/L 的適配體50 μL,隨著適配體濃度不斷升高,混合溶液的顏色逐漸加深,在200 nmol/L 時顏色最深(管7),其后增加適配體濃度,適配體數量多于菌數,多余的適配體與納米金結合,在高鹽溶液下呈紅色,至1 000 nmol/L 時適配體數量遠多于菌數,溶液呈現紅色。因此選擇適配體200 nmol/L 為最佳適配體添加濃度。
2.3 適配體-納米金溶液腸炎沙門氏菌的檢測限
通過在523 nm 處吸光度與腸炎沙門氏菌濃度的線性分析結果見圖3。
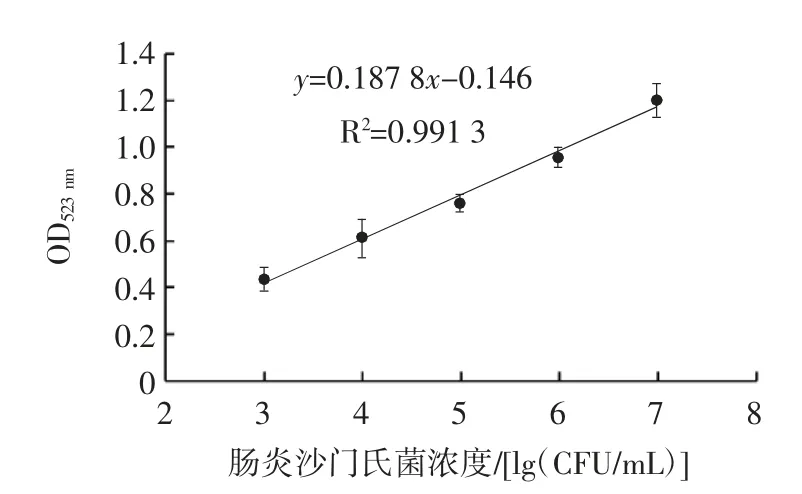
圖3 腸炎沙門氏菌濃度與吸光度的線性關系Fig.3 Linear relationship between Salmonella enteritidis concentration and absorbance value
由圖3 可知,在103~107CFU/mL 菌液濃度下,兩者有較好的線性關系,線性方程:y=0.187 8x-0.146(R2=0.991 3),檢測限為9.3×101CFU/mL。
3f 1H NMR(CDCl3) δ:7.91-7.79(m,2 H),7.77-7.75(m,1 H),7.56-7.53(m,1 H),7.37-7.33(m,2 H),7.27-7.16(m,1 H),2.43(s,6 H).
在體系中分別添加101~109CFU/mL 的腸炎沙門氏菌,其顏色變化在圖4 中顯示。
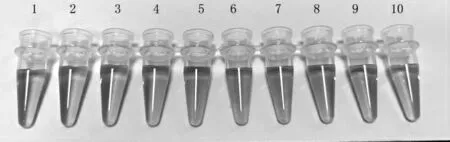
圖4 適配體-納米金溶液在腸炎沙門氏菌濃度不同時的顏色變化Fig.4 Color changes of aptamer nano gold solution at different concentrations of Salmonella enteritidis
由圖4 可知,當沒有腸炎沙門氏菌存在時,混合溶液為紅色;當溶液中有靶標菌存在時,適配體與靶標菌結合,部分納米金被未與靶標菌結合的適配體保護,保持紅色,而未與適配體結合的納米金顆粒在鹽溶液環境下呈現藍色,最終使溶液呈現紫紅色;隨著靶標菌數不斷增加,適配體完全與靶標菌結合,納米金顆粒暴露在鹽溶液環境下凝集,最終使混合溶液呈現藍色。
2.4 適配體-納米金溶液腸炎沙門氏菌的特異性
利用適配體-納米金溶液檢測大腸埃希氏菌、金黃色葡萄球菌及腸炎沙門氏菌,檢測反應體系的特異性,試驗結果如圖5 所示。

圖5 適配體-納米金溶液腸炎沙門氏菌的特異性Fig.5 Specificity of aptamer nano gold solution for Salmonella enteritidis
由圖5 可知,腸炎沙門氏菌混合溶液出現顏色變化,其他兩種菌的混合溶液則依然為紅色。當反應體系中存在靶標菌時,由于適配體與靶標菌結合呈現藍色,納米金溶液在高鹽環境下呈現紅色,最終呈現出深藍色(管3);而其他細菌與適配體無法特異性結合,納米金與適配體結合,從而在高鹽溶液下保護納米金顆粒,使混合溶液依舊為紅色(管1、管2)。
2.5 適配體-納米金溶液腸炎沙門氏菌的適用溫度
適配體-納米金溶液腸炎沙門氏菌體系在不同溫度下的反應見圖6。

圖6 適配體-納米金溶液腸炎沙門氏菌體系在不同溫度下的反應Fig.6 Reaction of aptamer nano gold solution Salmonlla enteritidis system at different temperatures
如圖6 所示,在相同的添加量下,改變反應體系的環境溫度,結果無明顯差異。表明該反應體系在日常室溫條件下(15~35 ℃)可以使用,環境溫度變化對該反應體系的檢測效果無明顯影響。
2.6 人工污染樣品檢測結果分析
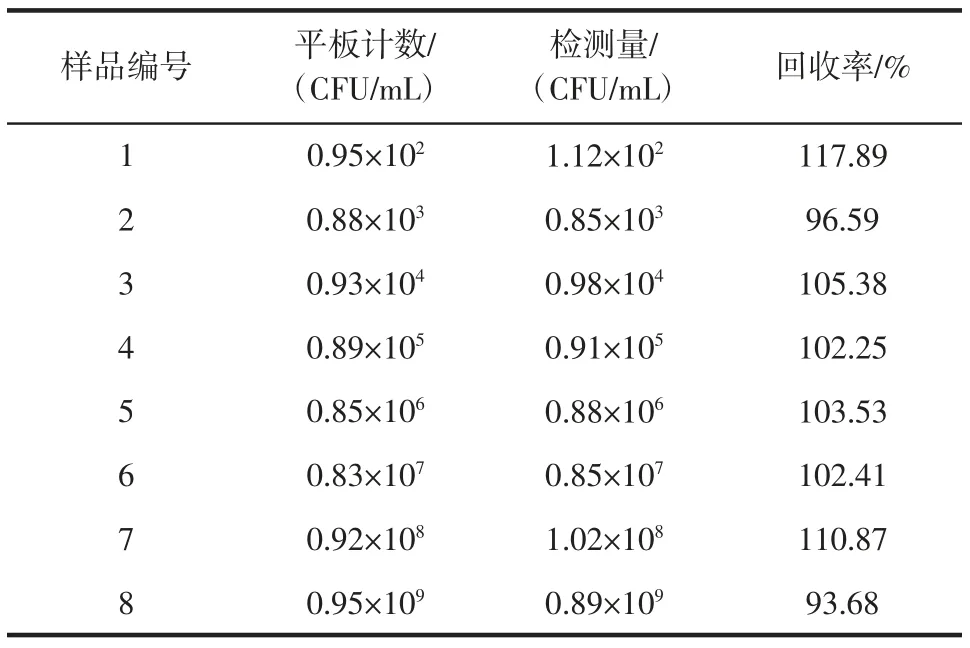
表1 適配體-納米金溶液檢測腸炎沙門氏菌與平板計數法的對比Table 1 Comparison of Salmonella enteritis detection with plate counting method
由表1 可知,基于核酸適配體的納米金比色法檢測腸炎沙門氏菌的方法加標回收率為93.68%~117.89%。與平板計數方法檢測腸炎沙門氏菌的結果沒有明顯差異,表明適配體-納米金溶液可以靈敏地檢測出食品中的腸炎沙門氏菌污染。
3 結論
本研究建立了一種基于核酸適配體的納米金比色法檢測腸炎沙門氏菌,本方法可以特異性檢測腸炎沙門氏菌,對其他食源性致病菌無特異反應。通過條件優化,在適配體濃度200 nmol/L 下,腸炎沙門氏菌的最低檢測限為9.3×101CFU/mL,其線性范圍為103~107CFU/mL,線性方程為y=0.187 8x-0.146(R2=0.991 3)。檢測人工污染樣品的加標回收率為93.68%~117.89%。
本研究建立的快捷、可視的進行腸炎沙門氏菌檢測的方法,利用納米金為顯色信號,無需連接信號轉換器,操作簡便,可應用于現場分析檢測;對比平板計數方法,其結果無明顯差異,該方法可以特異、準確地檢測食品中腸炎沙門氏菌污染情況,且無需進行樣品采集、處理、培養等過程,操作時間大大縮短,技術要求降低,提升檢測效率;同時該方法通過選擇特異性識別菌種的核酸適配體,配合納米金在高鹽環境下的顏色變化,實現可視化檢測。此外,篩選識別不同食源性致病菌的適配體時,僅需調整改變檢測體系內適配體,其他成分無需改變(成分濃度根據檢測靶標菌特性調整),即可實現不同致病微生物的檢測,具有良好的通用性。

