2型糖尿病大鼠發(fā)病前后腸道菌群的分析
易 波 蘇 可 蔡玉立 李俊峰 陳小琳 包 艷 文重遠
糖尿病是遺傳和環(huán)境因素共同引起的慢性代謝性疾病,嚴重影響我國居民健康水平。我國成人糖尿病患病率已增加至12.8%,預(yù)計2030年患病人數(shù)將達到1.4億,其中90%以上為2型糖尿病(type 2diabetes, T2DM)[1]。腸道菌群通過調(diào)控短鏈脂肪酸和炎性細胞因子表達、改變腸道滲透性、影響宿主免疫系統(tǒng)的成熟和調(diào)控功能等多種機制參與T2DM的發(fā)生、發(fā)展[2, 3]。但上述研究主要針對糖尿病發(fā)病后的人群和動物進行比較分析,很少在動物模型中探討T2DM發(fā)病前后腸道微生物的結(jié)構(gòu)、組成、豐度等變化情況,不能完整地解釋腸道菌群在T2DM發(fā)病早期的作用。
高脂飲食聯(lián)合低劑量鏈脲佐菌素(streptozotocin,STZ)誘導的T2DM大鼠模型能夠模擬大多數(shù)T2DM患者早期的病理生理過程[4]。因此,本研究擬在該模型中,采用16S rDNA高通量測序技術(shù)分析高脂喂養(yǎng)后和STZ注射后腸道菌群結(jié)構(gòu)、組成、豐度的變化,既是為了從腸道菌群的角度評價該模型的實用性,也是為探索腸道菌群在T2DM發(fā)病早期中的作用提供參考。
材料與方法
1.實驗動物:武漢大學人民醫(yī)院實驗動物中心提供8周齡SPF級雄性SD大鼠,體質(zhì)量為200~250g,本研究通過武漢大學人民醫(yī)院實驗動物倫理審查委員會的批準[倫理學審批號:WDRM(福)第20180407號]。
2.主要試劑與儀器:STZ購自北京索萊寶科技有限公司,溶解于0.1mmol/L枸櫞酸鈉緩沖液中。高脂飼料D12492由鼠來寶(武漢)生物科技有限公司提供。大鼠血清胰島素酶聯(lián)免疫吸附試驗(enzyme-linked immunoadsordent assay, ELISA)試劑盒購自瑞士MERCODIA公司,血糖檢測儀(MS*GR102B)購自日本泰爾茂公司。QIAmap糞便DNA試劑盒購自德國QIAGEN公司,擴增聚合酶為Q5?High-Fidelity DNA Polymerase(美國New England Biolabs公司),凝膠回收試劑盒購自美國AXYGEN公司。DNA純度測定使用Nanodrop One紫外分光光度計(美國賽默飛世爾科技公司)。文庫構(gòu)建試劑盒為TruSeq Nano DNA LT Library Prep Kit(美國Illumina公司)。Illumina MiSeq測序儀購自上海派森諾生物科技有限公司。
3.動物模型建立[5]:適應(yīng)性喂養(yǎng)1周的大鼠按隨機數(shù)字表法分為正常對照組(C組,n=5)和T2DM組(D組,n=5)。隨后,C組大鼠給予常規(guī)飼料喂養(yǎng),D組大鼠給予高脂飼料喂養(yǎng)。4周后,于禁食12h后測量大鼠體質(zhì)量,收集大鼠24h尿量,血糖儀檢測尾部毛細血管葡萄糖濃度,記為T0。接著單次腹腔注射35mg/kg STZ(D組)和0.1mmol/L枸櫞酸鈉緩沖液(C組),72h和1周后2次測量尾部毛細血管空腹血糖(fasting plasma glucose, FPG),以FPG≥13.9mmol/L為糖尿病模型成立,此時記為T1。采集大鼠尾靜脈血清用于檢測胰島素水平,計算胰島素抵抗指數(shù)[HOMA-IR=空腹血糖(mmol/L)×空腹胰島素(μIU/ml)/22.5],其中胰島素單位換算關(guān)系為1ng/ml=24.7968μIU/ml。
4.糞便采集:在T0和T1期,從C組和D組大鼠中收集新鮮直腸糞便樣本(>0.2g)并放入-80℃冰箱內(nèi)保存。
5.糞便DNA提取和檢測:提取大鼠糞便DNA,以0.8%瓊脂糖凝膠電泳檢測DNA質(zhì)量,以Nanodrop紫外分光光度計檢測DNA純度后,用無菌水將標本調(diào)整至20ng/μl。
6.16S rDNA-V3V4區(qū)PCR擴增:以稀釋后的DNA樣本為模板進行PCR擴增,其中上游引物序列為5′-ACTCCTACGGGAGGCAGCA-3′,下游引物序列為5′-GGACTACHVGGGTWTCTAAT-3′。PCR反應(yīng)條件為98℃預(yù)變性2min,98℃變性15s,55℃退火30s,72℃延伸30s,共25~30個循環(huán),最后72℃擴展延伸5min。對聚合酶鏈反應(yīng)(polymerase chain reaction, PCR)產(chǎn)物進行凝膠回收純化和熒光定量。
7.文庫構(gòu)建與高通量測序:首先在DNA序列3′端添加A堿基,在序列5′端添加Index序列的測序接頭,以磁珠篩選法去除自連片段。隨后將純化的DNA片段再次進行PCR擴增得到合格的測序文庫,按比例混合后經(jīng)NaOH變性為單鏈,使用Illumina MiSeq測序儀進行2×300bp的雙端測序。
8.生物信息學分析:對測序的原始數(shù)據(jù)按照引物和Barcode信息識別樣本,去除嵌合體等疑問序列。接著進行操作分類單元(operational taxonomic units, OUTs)歸并和劃分,評估樣本的α多樣性水平,以Metastats法和基于線性判別分析法(linear discriminant analysis, LDA)的LEfSe進行差異分析,Mothur軟件和Cytoscape軟件進行優(yōu)勢菌群互作Spearman關(guān)聯(lián)網(wǎng)絡(luò)分析,以PICRUSt預(yù)測優(yōu)勢菌群對第2級水平物質(zhì)代謝功能的影響。
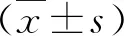
結(jié) 果
1. T2DM大鼠模型的評價:在T0期,與C組比較,D組大鼠平均FPG升高,但未達到糖尿病的標準。在STZ干預(yù)后(T1),D組大鼠體質(zhì)量下降,尿量增多,FPG均超過13.9mmol/L,空腹胰島素水平降低,HOMA-IR指數(shù)增高(P均<0.05,表1)。
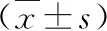
表1 高脂飲食和STZ干預(yù)對大鼠生理指標的影響
2.腸道菌群多樣性分析:兩個時間點20個樣本共得到684835個高質(zhì)量序列。與數(shù)據(jù)庫Greengenes比對后鑒定出87047個OTUs,其中,T0期C組獨有OTUs 1414個,T0期D組獨有2199個,T1期C組有2123個,T1期D組有1731個。α多樣性分析主要關(guān)注生態(tài)系統(tǒng)的物種多樣性程度,對某個樣品或多個樣品進行物種豐富度和群落中個體分配的均勻度兩個方面的研究。本研究選擇Chao1、Ace、Shannon、Simpson指數(shù)對菌群進行豐富度和均勻度的研究。與菌落豐富度有關(guān)的指數(shù)Chao1指數(shù)和ACE指數(shù)在T1期D組中下降,但反映菌落多樣性的指數(shù)Shannon指數(shù)和Simpson指數(shù)比較,差異無統(tǒng)計學意義(圖1)。

圖1 兩組大鼠腸道菌群多樣性比較
3.群落結(jié)構(gòu)分析:圖2A發(fā)現(xiàn)與相應(yīng)時點的C組比較,D組菌落數(shù)量增多。在門水平,T0期D組大鼠厚壁菌門、放線菌門和變形菌門增多,擬桿菌門減少;T1期D組大鼠菌落呈類似變化,但變形菌門相對更豐富(圖2B)。在屬水平,T0期D組大鼠乳桿菌屬和普雷沃菌屬豐度減少,柯林斯菌屬、布勞特菌屬、Allobaculum菌和擬桿菌屬含量相對更豐富;T1期D組大鼠棒狀桿菌屬、顫螺菌屬和多爾菌屬的相對豐度進一步增多(圖2中C、D)。
4.差異菌種篩選:與C組比較,T0期D組大鼠在屬水平變化的菌群按增高倍數(shù)由高到低依次為克里斯滕森菌屬、柯林斯菌屬、Allobaculum菌、布勞特菌屬、擬桿菌屬、螺桿菌屬、顫螺菌屬、厭氧芽胞梭菌屬、優(yōu)桿菌屬和Mucispirillum菌;而豐度下降的菌種依次為羅伊乳桿菌屬、普雷沃菌屬和Turcibacter菌(圖3)。T1期D組大鼠在屬水平增高的菌群依次為布勞特菌屬、顫螺菌屬、多爾菌屬、副擬桿菌屬、厭氧棍狀菌屬、優(yōu)桿菌屬和葡萄球菌屬;豐度下降的菌種為普雷沃菌屬、Lachnosipra菌和羅伊乳桿菌屬(圖4)。

圖4 T1期大鼠差異最顯著的前17個菌落分布圖
5.優(yōu)勢菌群關(guān)聯(lián)網(wǎng)絡(luò)分析:在T0期形成以乳桿菌和普雷沃菌屬為核心的負相關(guān)優(yōu)勢屬,即彼此排斥(co-exclusion)的相互作用模式;以顫螺菌屬、克里斯滕森菌屬和優(yōu)桿菌屬為核心的正相關(guān)優(yōu)勢屬,即共同出現(xiàn)(co-occurrence)模式。在T1期形成以普雷沃菌屬為核心的負相關(guān)網(wǎng)絡(luò),以葡萄球菌屬、副擬桿菌屬、多爾菌屬和優(yōu)桿菌屬為核心的正相關(guān)網(wǎng)絡(luò)。
6.差異菌群代謝功能富集分析:KEGG預(yù)測發(fā)現(xiàn)無論是T0還是T1期,D組均表現(xiàn)為碳水化合物代謝相關(guān)的菌落富集,而C組則富集核酸代謝和多糖合成與代謝相關(guān)的腸道菌群(圖5)。

圖5 腸道菌群第2級水平物質(zhì)代謝功能預(yù)測分析A和B分別為T0期和T1期兩組大鼠體內(nèi)腸道菌群代謝功能預(yù)測圖
討 論
T2DM是一種慢性進展性疾病,早期表現(xiàn)是血糖從正常逐步升高到糖尿病前期狀態(tài),再到出現(xiàn)顯性糖尿病,直至后期出現(xiàn)各種并發(fā)癥。其核心機制是胰島素抵抗伴有胰島素的分泌能力逐漸降低。飲食和腸道菌群失衡是啟動上述過程的重要原因[6]。
嚙齒類動物是糖尿病領(lǐng)域最常用的模式動物。早期研究表明,在大鼠和小鼠中,單獨使用高脂飲食或STZ均不能有效誘導T2DM模型,而高脂飲食聯(lián)合小劑量STZ(30~45mg/kg)注射4周后T2DM成模率超過85%[4]。本研究在8周齡SD大鼠中利用高脂飲食喂養(yǎng)4周聯(lián)合35mg/kg STZ單次腹腔注射成功誘導出T2DM模型。該模型在高脂喂養(yǎng)4周后出現(xiàn)血糖升高但未達到糖尿病標準(T0),而STZ干預(yù)2周后(T1)大鼠表現(xiàn)為多尿、消瘦、血糖升高、胰島素水平降低、HOMA-IR升高的特征,證明本研究已經(jīng)模擬出大多數(shù)T2DM患者早期的病理生理過程。
本研究利用16S rDNA高通量測序技術(shù)發(fā)現(xiàn),在T2DM發(fā)病早期,Shannon和Simpson在各組之間比較差異均無統(tǒng)計學意義,而Chao1和ACE在T1期D組中下降,說明T2DM早期雖然菌落多樣無明顯改變,但菌群的豐度下降。在相對豐度分析中,T2DM組大鼠厚壁菌門、放線菌門和變形菌門的相對豐度增多,擬桿菌門豐度減少(圖3)。然而,與本研究不一致的是,STZ單獨誘導的糖尿病大鼠成模后4周和12周,糖尿病組菌落多樣性和豐度均較對照組降低,尤其是變形菌門和放線菌門豐度降低;在T2DM男性成人患者中,變形菌門豐度增加,但擬桿菌門與厚壁菌門比值升高[7,8]。類似地,在肥胖人群中也存在腸道菌群變化趨勢完全相反的結(jié)果[9]。這種菌落豐度變化的不一致性既是年齡增加的結(jié)果,也有可能是糖尿病不同階段的特征性改變,更有可能是不同T2DM模型所帶來的差異[7]。
本研究發(fā)現(xiàn),高脂飲食喂養(yǎng)(T0)的大鼠以乳桿菌和普雷沃菌屬為核心的優(yōu)勢屬表現(xiàn)為菌落豐度下降,而以顫螺菌屬、克里斯滕森菌屬和優(yōu)桿菌屬為核心的優(yōu)勢屬表現(xiàn)為菌落豐度增加。該結(jié)果與既往高脂喂養(yǎng)的動物模型的結(jié)論基本一致[10,11]。在STZ誘導T2DM的T1期,形成以普雷沃菌屬為核心的負相關(guān)網(wǎng)絡(luò),以葡萄球菌屬、副擬桿菌屬、多爾菌屬和優(yōu)桿菌屬為核心的正相關(guān)網(wǎng)絡(luò)。實際上,動物試驗研究證實,普雷沃菌屬豐度可以顯著改善糖代謝狀況,其機制可能是增加支鏈氨基酸代謝,誘導腸道分泌腸促胰素,減少饑餓感等[12~14]。在T2DM患者中優(yōu)桿菌屬相對豐度下降,且與HOMA-IR呈負相關(guān),而增加優(yōu)桿菌屬的豐度可改善db/db小鼠胰島素抵抗[14~16]。
雖然腸道菌群可以通過調(diào)控短鏈脂肪酸代謝、膽汁酸代謝、磷酸轉(zhuǎn)移酶系統(tǒng)、蛋白水解產(chǎn)物等參與糖尿病的病理生理過程,但本研究發(fā)現(xiàn),減弱的核酸代謝和多糖合成與代謝相關(guān)聯(lián)同增加碳水化合物代謝也可能是T2DM的主要表現(xiàn)[14,15,17,18]。實際上,高脂飲食后腸道菌群結(jié)構(gòu)的改變,導致其對食物中多糖的消化作用減弱,進而減少短鏈脂肪酸的合成,參與糖尿病的發(fā)生[15,19]。此外,厚壁菌門的增加可以通過三磷酸腺苷結(jié)合盒轉(zhuǎn)運體(ATP binding cassette transporter, ABC transporter)將碳水化合物運送至微生物體內(nèi)以提升碳水化合物的代謝水平,進而影響宿主的血糖平衡[19, 20]。
本研究在高脂飲食聯(lián)合小劑量STZ誘導的T2DM大鼠模型中,發(fā)現(xiàn)T2DM發(fā)病前后存在顯著的腸道菌群結(jié)構(gòu)、豐度和代謝功能的改變,尤其是擬桿菌門普雷沃菌屬的下降和厚壁菌門優(yōu)桿菌屬的豐度升高。這提示擬桿菌門普雷沃菌屬和厚壁菌門優(yōu)桿菌屬在高脂聯(lián)合STZ誘導T2DM的早期病理生理過程中發(fā)揮重要作用。盡管本結(jié)論僅來源于動物研究,缺乏大樣本量人群的數(shù)據(jù)支持,但仍為深入研究腸道菌群在T2DM中的作用提供了參考依據(jù)。

