地舒單抗與唑來膦酸治療絕經后骨質疏松癥的療效對比研究
李小霜 孫 娟 何苗苗 張珍華 于洪恩
骨質疏松癥(ostegtporosis, OP)是一種骨量減低和骨微結構惡化導致骨折風險增加的全身代謝性疾病,在絕經后中老年女性中最為常見,即絕經后骨質疏松癥(postmenopausal ostegtporosis, PMO)[1]。PMO多發生在女性絕經后5~10年,且早期癥狀隱匿,骨折是其嚴重的并發癥,可導致患者疼痛、殘疾甚至死亡,因此,科學有效防治PMO至關重要[2]。PMO患者由于卵巢功能衰退,導致雌激素水平下降,破骨細胞活性增強,骨吸收大于骨形成,導致大量骨質流失,破骨細胞活性增強是PMO發生的關鍵因素,研究并開發以骨吸收抑制劑為主的治療藥物是防治PMO的重要方向[3]。
地舒單抗(denosumab, DEN)屬于核因子κB受體活化體配體(receptor activator for nuclear factor-κB ligand inhibitor, RANKL)抑制劑,RANKL是破骨細胞分化、激活和存活的主要介質,DEN通過干擾RANKL與RANK的結合,從而抑制破骨細胞的形成和存活,使骨吸收與骨形成趨向平衡[4]。唑來膦酸(zoledronic acid, ZOL)通過抑制法尼基焦磷酸鹽合成酶(famesyl pyrophosphate synthase, FPPS)發揮其抗骨再吸收作用,是目前藥理活性最強的雙磷酸鹽類藥物[5]。DEN與ZOL都是抗骨吸收藥物,但給藥途徑以及藥物作用特點有所不同。本研究回顧性對比分析DEN和ZOL治療PMO為期1年的治療效果,以骨密度(bone mineral density, BMD)、骨代謝標志物(bone metabolic markers, BTM)以及骨痛視覺模擬評分(visual analogue scale, VAS)作為評價指標,以期對DEN與ZOL在臨床治療PMO時的選擇提供理論基礎。
資料與方法
1.一般資料:本研究為回顧性對比分析研究,查閱2020年10月~2021年6月于徐州醫科大學附屬醫院住院的PMO患者資料,篩選出接受DEN和ZOL治療≥1年的女性患者作為研究對象,根據使用藥物的不同將其分為兩組:DEN組(n=40)和ZOL組(n=46)。納入標準:①符合《原發性骨質疏松癥診療指南》中OP的診斷標準[6];②年齡為50~60歲且自然絕經時間≥2年的女性患者。排除標準:①代謝性骨病、維生素D缺乏性疾病患者;②類風濕關節炎、系統性紅斑狼瘡等免疫系統疾病患者;③患有甲狀腺疾病、甲狀旁腺疾病等內分泌系統疾病患者;④伴嚴重的心臟、腦、肝臟、腎臟等功能障礙疾病患者;⑤兩年內使用過影響骨代謝藥物的患者;⑥使用過雌激素治療的患者。本研究經徐州醫科大學附屬醫院醫學倫理學委員會批準(倫理學審批號:XYFY2022-KL014-01)。
2.方法:DEN組患者給予皮下注射DEN 60mg,2次/年;ZOL組患者給予靜脈滴注ZOL 5mg,1次/年。治療期間所有患者每日補充維生素D3125IU和碳酸鈣600mg,治療為期1年。
3.觀察指標:收集兩組患者的基礎指標:年齡、身高、體重、計算體重指數(body mass index, BMI) [BMI=體重/身高2(kg/m2)]。采集患者治療前和治療1年后靜脈血,于院內檢驗科檢測BTM,主要包括骨源性堿性磷酸酶(bone alkaline phosphatase, BAP)、Ⅰ型前膠原氨基端延長肽(total procollagen type Ⅰ amino-terminal propeptide, TP1NP)、β-膠原特殊序列(β-cross laps,β-CTX)、骨鈣素(bone gla protein, BGP)、甲狀旁腺激素(parathyroid hormone, PTH)、25羥基維生素D(25OHD)等;以及血清堿性磷酸酶(alkaline phosphatase, ALP)、血鈣(Ca)、血磷(P)、血肌酐(Serum creatinine, Scr)、血尿素氮(blood urea nitrogen, BUN)等相關指標。采用雙能X線骨密度測量儀測定所有患者治療前及治療1年后腰椎(L1~4)和髖部(股骨頸、Wards三角、大粗隆、股骨干、全髖)的骨密度值。采用骨痛視覺模擬量表(visual analogue scale, VAS)對治療前后骨關節疼痛癥狀評分,總分為10分,評分越高表示疼痛越劇烈。臨床療效根據《原發性骨質疏松癥診療指南》擬定評價標準進行分級[6]。療效共分3級:①顯效:患者臨床癥狀基本消失,BMD水平顯著升高;②有效:患者臨床癥狀有所改善,BMD水平升高但不顯著;③無效:患者臨床癥狀未改善甚至加重,BMD未升高或降低。并計算DEN與ZOL 兩種藥物治療PMO的總有效率。治療總有效率(%)=(顯效+有效)例數/總例數×100%。
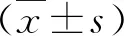
結 果
1.兩組患者的一般資料比較:兩組患者的年齡、BMI、Ca、P、BUN、Scr水平比較,差異均無統計學意義(P均>0.05),具有可比性,詳見表1。
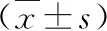
表1 兩組患者的一般資料比較
2.兩組患者的骨代謝指標比較:治療前兩組患者BAP、TP1NP、β-CTX、BGP、25OHD、PTH及ALP水平比較,差異均無統計學意義(P>0.05)。治療1年后,兩組患者BAP、TP1NP、BGP、β-CTX及ALP水平較治療前均顯著下降(P<0.05);25OHD水平較治療前顯著升高(P<0.05);PTH水平較治療前無明顯變化(P>0.05)。DEN組β-CTX水平較ZOL組下降更顯著(P<0.05),兩組患者治療后BAP、TP1NP、BGP、25OHD、PTH及ALP水平比較,差異均無統計學意義(P均>0.05),詳見表2。

表2 兩組患者的骨代謝指標比較
3.兩組患者的骨密度值比較:兩組患者治療前腰椎(L1、L2、L3、L4、L1~4)和髖部(股骨頸、Wards三角、大粗隆、股骨干、全髖)骨密度值比較,差異均無統計學意義(P均>0.05)。治療1年后,兩組患者各部位骨密度值較前均顯著升高(P<0.05)。DEN組患者治療后L1~4、股骨頸、全髖等部位骨密度值較ZOL組升高更顯著(P<0.05);兩組患者治療后L1、L2、L3、L4、Wards三角、大粗隆、股骨干等部位骨密度值比較,差異均無統計學意義(P均>0.05),詳見表3、表4。

表3 兩組患者的腰椎骨密度值比較

表4 兩組患者髖部骨密度值比較
4.兩組患者的VAS評分比較:兩組患者治療前VAS評分比較,差異無統計學意義(P>0.05)。治療1年后,兩組患者VAS評分較治療前均顯著下降(P均<0.05),DEN組VAS評分明顯低于ZOL組,差異有統計學意義(P<0.05),詳見表5。

表5 兩組患者的VAS評分比較(分,
5.兩組患者的臨床療效比較:治療前ZOL組患者的骨折發生率為15.22%,DEN組為12.50%;治療后ZOL組患者的骨折發生率為6.52%,DEN組為5.00%,兩組患者骨折發生率較治療前均顯著降低(P均<0.05)。DEN組患者的臨床療效優于ZOL組,差異有統計學意義(P<0.05);兩組患者的總有效率比較,差異無統計學意義(P>0.05),詳見表6。

表6 兩組患者的臨床療效比較[n(%)]
6.兩組患者的不良反應比較:治療期間,ZOL組患者出現發熱4例,DEN組患者出現發熱1例、乏力1例,對癥處理后癥狀均得到緩解,所有患者治療期間肝腎功能均未出現異常。
結 果
隨著我國人口老齡化加劇,PMO臨床病例呈逐年增高趨勢,研究顯示,我國≥50歲女性OP發生率為32.5%,是同年齡組男性的4~5倍[7]。絕經后女性由于體內雌激素缺乏,導致骨吸收大于骨形成的高轉換型的OP[8]。雙膦酸鹽類藥物是臨床上治療PMO的首選藥物,研究證明,ZOL可顯著提高骨密度值,降低骨轉換指標,降低骨折風險[9]。DEN于2020年被我國批準用于治療有高骨折風險的PMO患者,其成分主要為全人源單克隆抗體,可降低骨吸收,改善骨強度[10]。國外一項前瞻性研究顯示,使用DEN治療1年后,腰椎、全髖、股骨頸BMD與治療前比較的百分比變化分別7.3%±23.6%、3.6±31.4%和3.2%±10.7%,有效性高且耐受性良好[11]。
BTM可以對骨轉化進行特異地評估。TP1NP、BGP、BAP由成骨細胞產生并分泌,反映骨形成的指標,β-CTX是Ⅰ型膠原的代謝產物,反映骨吸收的指標。ALP有50%來源于骨,PMO患者會伴隨ALP活性升高。阿根廷的一項研究顯示,在DEN治療12個月期間,BGP、β-CTX及ALP水平均呈下降趨勢[12]。在相關研究中,與雙膦酸鹽和安慰劑比較,DEN組患者的β-CTX水平下降幅度最大,TP1NP、β-CTX及BAP水平也較治療前下降[13]。本研究中治療后兩組患者的BAP、TP1NP、BGP、β-CTX及ALP水平均明顯下降,表明DEN和ZOL能夠顯著抑制骨吸收,也能抑制骨形成,全面降低骨代謝指標。治療期間兩組患者均補充了維生素D和碳酸鈣,因此治療后兩組患者血清25OHD水平均較前升高,且組間比較差異無統計學意義(P>0.05)。
本研究中DEN組患者治療后β-CTX水平顯著低于ZOL組,與Kang等[14]報道一致。這可能與兩者作用機制不同有關。在雌激素缺乏導致的PMO中,RANKL的表達水平升高,可誘導破骨細胞前體細胞分化、增殖,導致破骨細胞活化和骨吸收增加,因此減少前體細胞的分化是高吸收性骨病的治療方式之一。DEN與RANKL結合,阻止其與RANK相互作用,抑制破骨細胞形成和功能,進而減少骨吸收;ZOL抑制骨代謝通路中FPPS的活性,誘導破骨細胞凋亡來減少骨吸收,但不影響破骨細胞的形成[15]。與ZOL比較,可能DEN對破骨細胞的抑制作用更加突出。
本研究結果顯示,兩組PMO患者接受治療1年后,腰椎、髖部骨密度值較治療前均明顯升高,其中DEN組腰椎(L1~4)、股骨頸、全髖等部位骨密度值較ZOL組升高更顯著,其他部位兩組間比較,差異無統計學意義(P>0.05)。韓國一項研究表明,DEN對PMO患者的腰椎、全髖的骨密度值改善效果優于ZOL,與本研究結果一致[14]。研究認為,ZOL對破骨細胞的抑制需要與骨礦物質結合,而對羥基磷灰石的強親和力可能限制ZOL在骨骼中的均勻分布;而DEN則通過與RANKL結合,直接抑制破骨細胞形成、功能與存活,DEN是一種循環抗體,可到達骨骼的各個部位,尤其是在骨深部[14]。DEN對骨重塑的抑制作用可能強于ZOL。
緩解患者疼痛是治療的重要目的之一。本研究結果顯示,治療1年后,兩組患者的VAS評分較治療前均顯著降低,DEN組較ZOL組降低更顯著,緩解疼痛效果更明顯,但二者在總有效率方面比較差異無統計學意義(P>0.05)。治療期間兩組患者的不良反應情況比較,差異無統計學意義(P>0.05)。同時兩組患者治療后骨折發生率較治療前均顯著下降,組間比較,差異無統計學意義(P>0.05)。骨密度的增加能夠降低脆性骨折發生的風險。一項Meta分析表明,DEN與ZOL比較,在降低骨折風險上無顯著差異,但停用DEN后發生骨折的風險會增加,這可能與停藥后BTM的持續升高有關[16]。因此,對于已經開始DEN治療的患者,應囑其不要自行停藥,以免增加骨折風險[17]。同時研究表明,使用DEN治療的患者在1年內發生復合性心血管疾病的風險低于ZOL,DEN更適合患有心血管疾病的患者使用,ZOL可能更適合60歲以上或免疫系統紊亂的患者[17]。具體選擇使用哪種藥物需要根據患者的情況來決定。
DEN和ZOL治療PMO均有較好的療效,能夠有效提高骨密度值,改善骨代謝指標。本研究結果初步證實DEN較ZOL在增加腰椎(L1~4)、股骨頸、全髖等部位骨密度值及減輕患者疼痛方面更有優勢。本研究仍存在一定的局限性:①由于是回顧性研究,BMD和BTM只能從數量有限的患者中收集,可能導致患者選擇偏倚;②各組樣本量偏小、隨訪時間短也可能對研究結果產生一定的影響,為了進一步評估DEN和ZOL對PMO的療效,后期需要開展更大樣本量的隨機對照試驗予以進一步證實。

