血小板源性微粒在口腔鱗癌中的表達及臨床意義
劉英苗 胡騰龍 李保蓉 于 洋
口腔癌是導致死亡最常見的的癌癥之一,其中超過90%的口腔惡性腫瘤是口腔鱗狀細胞癌(oral squamous cell carcinomas, OSCC),盡管診斷和治療有所提高,但是5年生存率仍為50%左右[1,2]。眾所周知,癌癥和血栓是相互影響的,幾乎所有類型的癌癥與凝血的激活有關,但原因不詳。據文獻記載,腫瘤患者比沒有腫瘤的患者靜脈血栓(venous thromboembolism, VTE)的發生率高,為其4~7倍,然而在晚期癌癥患者中VTE的發生率更高[3,4]。微粒(microparticles, MPs)是細胞激活后釋放出來的直徑為0.1~1.0μm的膜泡[5]。MPs在血栓與止血、炎性反應、免疫反應、細胞增殖及腫瘤進展等過程中發揮重要作用[6]。近年來有研究表明,循環MPs數量的變化和OSCC進展以及炎癥程度相關。也有研究表明,OSCC患者血漿中血小板源性微粒(platelet-derived MPs, PMPs)升高,然而關于其與腫瘤最大徑、腫瘤TNM分期、腫瘤分化程度、頸部轉移的淋巴結是否相關還不是很清楚[7]。本研究主要探討OSCC患者血漿中PMPs的水平與腫瘤最大徑、腫瘤TNM分期、腫瘤分化程度、頸部轉移的淋巴結是否有關,并進一步探討與凝血的關系,以期對OSCC患者的治療提供新思路。
材料與方法
1.材料:(1)臨床材料:選取2016年10月~2018年10月在哈爾濱醫科大學附屬口腔醫院住院的OSCC患者63例(OSCC組),其中男性36例,女性27例,患者中位年齡為54 (40,75)歲。筆者醫院體檢的健康人26例(正常對照組),其中男性14例,女性12例,中位年齡為51 (19,61)歲。納入標準:手術后病理確診、未經過放化療的患者。排除標準:①近3個月內接受過抗凝和抗血小板治療的患者;②高血壓、糖尿病、妊娠、患急性和慢性疾病、其他腫瘤患者和全身性疾病患者。本研究通過哈爾濱醫科大學附屬第一醫院醫學倫理學委員會批準(倫理學審批號:HMUIRB20160026),所有研究對象均知情同意,并簽署知情同意書。(2)主要儀器和材料:流式細胞儀(FACSArial,美國BD公司),Eppendorf移液槍(德國Eppendorf公司),megamix標準微球試劑盒(法國BioCytex公司),含beads的Truecount的絕對計數管(美國BD公司),凝血酶定標品(thrombin Calibrator,荷蘭BV公司),Fluck試劑盒、熒光讀數儀、低速離心機(美國BD公司),MPs反應劑(荷蘭BV公司),乳黏素(Alexa Fluor 488)、Alexa Fluor 488-CD41a(美國BD公司)。
2.方法:(1)MPs懸液制備:取各組(正常對照組、OSCC組)靜脈血5ml。上述標本200×g離心13min,獲得富血小板血漿,繼續1500×g離心20min,取上2/3即獲得乏血小板血漿,13000×g離心2min,取上層2/3獲得無血小板血漿;取無血小板血漿250μl,20000×g離心45min,棄掉上層225μl(動作緩慢),余25μl即MPs,用Tyrode′s buffer洗1次,加225μl Tyrode′s buffer,即得到MPs懸液。(2)掃描電鏡實驗:在玻璃蓋玻片上準備血小板。標本置于2%戊二醛磷酸緩沖液(pH值約為7.2)中,將其固定并置于4℃冰箱中過夜。第2天沖洗用0.15%的同一緩沖溶液,再用不同濃度的乙醇分別進行脫水,每次約15min。將上述制備的樣品置于臨界點干燥器中,使之進行干燥,樣品表面噴涂10nm厚的鉑層。所有圖片用S-3400N掃描電鏡觀察。(3)流式細胞儀檢測PMPs:用Alexa Fluor 488乳黏素檢測MPs,乳黏素顯示陽性時為MPs[8]。用CD41a-Alexa Fluor 488+標記為PMPs。(4)凝血酶生成試驗(thrombin generation test, TGT):測定不同分組的OSCC患者血漿凝血酶生成。操作步驟:①采用96孔板進行實驗;②將患者血漿加入到相應的96孔板中;③再分別將凝血標準品和MPs反應劑加入到相應的孔中;④將孔板放到熒光讀數儀中,再于37℃下培養10min;⑤按要求進行搖晃并在機器下檢測凝血酶的生成。
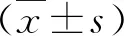
結 果
1.掃描電鏡觀察OSCC患者血漿中PMPs:掃描電鏡下觀察結果顯示,OSCC患者中血小板激活,血小板釋放PMPs為密度低的圓球形,邊界清楚,直徑為100~1000nm,而正常對照組中未見血小板激活及PMPs釋放,詳見圖1。

圖1 兩組血漿中血小板激活及PMPs釋放(×200)A.正常對照組;B.OSCC組。箭頭所示為PMPs,呈密度低的圓球形,邊界清楚,直徑為100~1000nm
2.OSCC組和正常對照組PMPs的水平:腫瘤最大徑≥4cm的OSCC患者血漿中PMPs水平(1748.97±464.53/μl)高于腫瘤最大徑<4cm的OSCC患者(1249.36±482.52/μl)和正常對照組(1040.15±272.26/μl,F=16.87,P<0.05)。TNM分期Ⅲ/Ⅳ期的OSCC患者血漿中PMPs水平(1894.44±401.42/μl)明顯高于Ⅰ/Ⅱ期的OSCC患者(1092.41±261.03/μl)和正常對照組(1040.15±272.26/μl ,F=25.33,P<0.05),而有淋巴結轉移的OSCC患者血漿中PMPs水平(1945.66±375.58/μl)高于無淋巴結轉移的OSCC患者(1211.29±386.51/μl)和正常對照組(F=22.93,P<0.05)。高、中、低分化的OSCC患者血漿中PMPs水平分別為1491.94±488.40/μl、1572.31±578.97/μl、1567.33±484.94/μl,均高于正常對照組(F=7.221,P<0.05),然而,3組之間血漿中PMPs水平比較,差異無統計學意義(P>0.05,圖2)。

圖2 不同分組中PMPs水平的比較A.腫瘤最大徑組PMPs水平;B.腫瘤TNM分期組PMPs水平;C.有無淋巴結轉移組PMPs水平;D.腫瘤分化程度組PMPs水平。*P<0.05
3.PMPs增加OSCC患者促凝活性:檢測凝血酶的生成主要包括延遲時間、凝血酶生成峰值、達峰時間和凝血酶生成潛力(endogenous thrombin potential,ETP)。不同OSCC組與正常對照組中凝血酶的生成詳見表1。腫瘤最大徑≥4cm的OSCC患者凝血酶生成峰值顯著高于正常對照組,差異有統計學意義(t=3.421,P<0.05),而兩組間其余凝血酶的生成參數比較,差異無統計學意義(P>0.05)。TNM分期Ⅲ/Ⅳ期的OSCC患者凝血酶生成峰值顯著高于正常對照組,差異有統計學意義(t=6.714,P<0.05),而兩組間其余凝血酶的生成參數比較,差異無統計學意義(P>0.05)。與正常對照組比較,有淋巴結轉移的OSCC患者凝血酶生成峰值水平顯著升高(t=4.852,P<0.05),而兩組間其余凝血酶的生成參數比較,差異無統計學意義(P>0.05)。高、中、低分化的OSCC患者與正常對照組各參數比較,差異均無統計學意義(P>0.05),且高、中、低分化OSCC患者3組間各參數比較,差異均無統計學意義(P>0.05)。患者外周血PMPs與活化部分凝血活酶時間(activated partial thromboplastin time,APTT)、凝血酶原時間(prothrombin time,PT)、纖維蛋白原(fibrinogen,FIB)進行Spearman相關性分析,結果表明,FIB與PMPs水平呈正相關(P<0.05,圖3)。
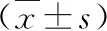
表1 不同OSCC組患者與正常對照組凝血酶生成檢測結果

圖3 測定OSCC患者PMPs水平與不同凝血指標的相關性A.PMPs水平與APTT的相關性;B.PMPs水平與PT的相關性;C.PMPs水平與FIB的相關性
討 論
OSCC是一種炎癥相關的疾病,而MPs是炎性反應的產物,但同時也能促進炎性反應[9]。PMPs水平在OSCC患者血漿中是升高的,并且在TNM分期Ⅲ/Ⅳ期生成最多,表明PMPs可能參與OSCC的疾病進展。越來越多的學者研究PMPs在癌癥中的作用。既往研究表明,晚期乳腺癌患者的PMPs水平升高,同時還有研究表明,皮膚的惡性黑色素瘤在Ⅱ/Ⅲ/Ⅳ期PMPs水平升高,與本研究結果一致[10,11]。PMPs的釋放與炎性疾病、腫瘤及免疫性疾病有關,許多炎性細胞因子可導致PMPs的釋放,而單核細胞又可分泌多種促炎性細胞因子(如腫瘤壞死因子-α、白細胞介素-6、白細胞介素-8、細胞黏附分子等)[12]。有研究表明,PMPs能誘導體內其他的細胞如成纖維細胞分泌各種促炎性細胞因子如白細胞介素-6、白細胞介素-8[13]。且血小板可通過其體內的選擇素與促凝物質結合生成血小板-纖維蛋白原復合物,從而加劇疾病的炎癥程度并促進疾病進展。
PMPs參與許多過程,包括炎癥、衰亡、細胞增殖、腫瘤進展、凝血激活等。目前PMPs研究最多的是關于其凝血激活作用,而PMPs具有促凝作用,其促凝活性通常與兩種物質有關[14]。帶負電荷的磷脂酰絲氨酸(phosphatidylserine,PS)發揮較大作用。它在促凝過程中,與其中的陽性基團結合,繼而參與整個凝血過程。磷脂酰絲氨酸在PMPs中的研究已有很多,然而在OSCC患者中研究很少,需要進一步闡明。第2種物質是組織因子。它是啟動凝血的外源性途徑的主要物質,它主要與Ⅶa形成復合物,從而激活整個外源性途徑。目前關于組織因子來源的PMPs在癌癥患者中已有很多研究。而在本研究中發現TNM分期Ⅲ/Ⅳ期的OSCC患者凝血酶生成峰值明顯高于正常對照組,差異有統計學意義,表明PMPs在TNM分期晚期的OSCC患者血漿中升高,并參與腫瘤的促凝血過程。腫瘤最大徑≥4cm的OSCC患者比正常對照組凝血酶生成峰值水平高,與正常對照組比較,有淋巴結轉移的OSCC患者凝血酶生成峰值水平顯著升高,表明OSCC促凝活性可能參與腫瘤進展,對腫瘤生長具有促進作用,而OSCC的高凝機制還有待于進一步研究。
MPs同時可以調節血管的再生[15]。已有研究證明,OSCC患者血漿中循環MPs可以促進血管內皮生成[16]。而PMPs是腫瘤患者外周血中檢測的最多的MPs,因此PMPs在促進腫瘤內皮再生中發揮巨大作用。Gaetani等[17]研究表明,PMPs可以通過多種機制共同刺激體外培養的人臍靜脈內皮細胞增殖、凋亡和遷移等。
研究表明,腫瘤瘤體的直徑可以影響患者的預后,并且隨著腫瘤的增大,其頸部淋巴結的轉移升高,與本研究結果一致[18]。有報道認為,腫瘤患者淋巴結轉移應被視為重要的預后指標,然而本研究中淋巴結轉移對于患者預后的影響至關重要[19]。本研究結果OSCC患者血漿中PMPs水平在有淋巴結轉移組中高,并且與正常對照組比較,有淋巴結轉移組的凝血酶生成峰值水平更高。此外,在腫瘤最大徑≥4cm組比腫瘤最大徑<4cm組和正常對照組血漿中PMPs水平和凝血酶生成峰值水平高,將患者外周血PMPs與凝血相關指標進行相關性分析表明FIB與PMPs水平相關,表明PMPs增加OSCC患者促凝活性,參與OSCC患者的進展,促進腫瘤細胞異常增殖,引起腫瘤生長。臨床上常用TNM分期來判斷頸部淋巴結轉移,而本研究結果表明,TNM分期Ⅲ/Ⅳ期OSCC患者血漿中的PMPs水平明顯高于Ⅰ/Ⅱ期,表明Ⅲ/Ⅳ期OSCC患者頸淋巴結轉移較多見。而在本研究中高、中、低分化的OSCC患者之間PMPs水平差異無統計學意義。表明腫瘤的惡性程度不能依據病理分期,因為病理分級目前尚無統一標準。然而之前也有研究表明,分化程度低的患者中頸部淋巴結轉移者較常見[20]。既往研究與本研究結果一致。因此,腫瘤分化程度與腫瘤進展及轉移的關系有待于進一步研究。
綜上所述,本研究驗證了PMPs在OSCC患者血漿中的水平升高,并增加了OSCC的促凝活性,并隨著腫瘤最大徑及腫瘤TNM分期的增加而升高,在淋巴結轉移患者中更高。提示PMPs參與OSCC的發生、發展,并且有可能為OSCC的早期診斷以及早期治療提供依據,然而關于PMPs促進OSCC發生、發展的機制仍有待于進一步研究。

