植物bHLH轉錄因子調控鐵穩態的研究進展
李宇 李素貞 陳茹梅 盧海強
(1.河北農業大學食品科技學院,保定 071000;2.中國農業科學院生物技術研究所,北京 100081)
鐵是植物生長發育所必需的微量營養元素,其作為重要的輔因子在植物體的各種重要的代謝過程中發揮作用,如光合作用、呼吸作用、荷爾蒙的合成及固氮作用等[1]。植物缺鐵會帶來產量和品質下降等問題,嚴重缺乏時甚至會導致作物絕產[2]。植物中鐵過量也會對植物生長造成危害,鐵在植物體內過量積累會引起鐵中毒,表現為生理代謝失調、生長發育受阻。因此,植物中鐵的攝取與平衡必須受到嚴格的控制,來滿足其生長供應與需求。
鐵在土壤中的含量豐富,植物可以從土壤中獲得鐵,但是植物從土壤中攝取鐵的能力是有限的,主要原因是鐵以三價鐵及磷酸鹽形式存在,在堿性土壤中尤為明顯。植物應答缺鐵條件形成了兩種鐵的吸收機制:機制I和機制Ⅱ[3-4]。機制I和機制Ⅱ的主要區別是機制I吸收Fe2+,而機制Ⅱ是以螯合的策略吸收Fe3+。雙子葉植物及非禾本科單子葉植物利用機制I吸收鐵,禾本科植物利用機制Ⅱ吸收鐵[5]。機制I植物吸收鐵的主要過程:植物先向根際分泌酚類物質或氫離子來酸化土壤增加鐵的溶解性[6],隨后鐵還原酶FRO(Fe3+-chelate reductase)基因將Fe3+還原為Fe2+,最后通過Fe2+轉運蛋白IRT1/IRT2(iron-regulated transporter)[7]將其轉運至植物體內細胞以滿足植物生長發育需要[8]。機制Ⅱ是基于螯合策略,首先在植物根細胞中經過一系列反應合成麥根酸類物質PS(phytosiderophores),麥根酸轉運蛋白TOM1(transporter of mugineic acid family phytosiderophores 1)將PS轉運至根際,與土壤中的Fe3+螯合形成Fe3+-PS復合物,黃色條紋蛋白YSL(yellow stripe)將Fe3+-PS螯合物轉運至細胞內[9]。兩種機制均由復雜的轉錄調控網絡精準調控,這些調控網絡由多種轉錄因子組成,其中堿性螺旋-環-螺旋bHLH(basic halix-loop-halix)家族的成員發揮著至關重要的作用[10]。
本文以依賴兩種不同鐵吸收策略調控體內鐵穩態的擬南芥和水稻為例,對二者中的相關bHLH轉錄因子在調控鐵穩態作用中的最新研究進展進行總結、討論,以期能夠提高我們對植物控制鐵元素動態平衡這一復雜機制的理解。
1 bHLH轉錄因子的結構特征
bHLH家族是植物中較大的轉錄因子家族之一,亞族豐富[11],擬南芥、水稻中的所有bHLH家族成員可分為32個亞族,其中擬南芥中包含的bHLH家族成員有162個,水稻中包含167個[12]。
bHLH蛋白是一個真核轉錄因子家族,調節與細胞分化和發育有關的一系列基因的表達[13]。bHLH家族以其高度保守的堿性/螺旋-環-螺旋結構域命名,bHLH結構域由大約60個氨基酸殘基組成,分為兩個區域,一個是堿性區,通常由13-17個氨基酸組成,位于氨基酸序列的N端,負責二聚化和參與DNA與E-box序列的結合[14];另一個是由近40個氨基酸組成的HLH區域,位于氨基酸序列的C端,由兩個含有疏水殘基的α螺旋組成(圖1),需要二聚化來調控參與各種信號通路的靶基因的表達[15-16]。對bHLH轉錄因子結構特征的了解能幫助我們更好地理解bHLH轉錄因子調控鐵缺乏基因的表達機理。
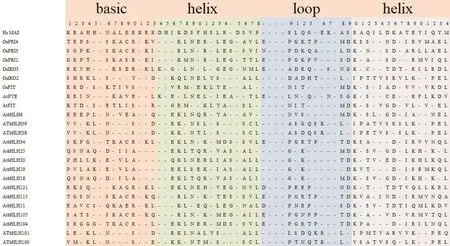
圖1 鐵調控網絡主要蛋白bHLH結構域Fig.1 Alignment of the bHLH domain of iron-regulated network main proteins
2 植物中調節鐵穩態的相關bHLH轉錄因子研究現狀
2.1 擬南芥中調節鐵穩態的bHLH家族
2.1.1 機制I的BTS感受器通路 擬南芥是典型的模式植物之一,利用機制I吸收鐵,并且bHLH家族成員在擬南芥中研究得比較多,尤其是參與缺鐵脅迫應答的bHLH轉錄因子。到目前為止,在擬南芥中已發現有屬于6個亞族的17個bHLH轉錄因子參與鐵的平衡調節[17-18],在應對缺鐵脅迫時,同一亞族的轉錄因子往往發揮著相似的功能。
擬南芥缺鐵反應調控網絡的上游是E3連接酶基因BTS(brutus),BTS受缺鐵強烈誘導,是一種潛在的鐵傳感器,對鐵離子高度敏感,其能與鐵結合并且具有泛素化轉錄因子的功能[19]。在擬南芥以及其他一些雙子葉植物中,還存在著兩個與BTS部分功能冗余的E3泛素連接酶,BTSL1(Brutus-like 1)和BTSL2,C末端結構域具有E3連接酶活性,在擬南芥體內能促進類缺鐵所誘導轉錄因子AtbHLH29/FIT(fer-like Fe deficiency-induced transcription factor)的降解。BTSL1和BTSL2之間也存在相互協同調節,但不與BTS之間關聯[20]。BTS缺鐵響應轉錄調控,與參與鐵信號傳導的bHLH轉錄因子家族IVc亞族的4個轉錄因子bHLH34、bHLH104、bHLH105/ILR3(iaa leucine resistant 3)和bHLH115直接相互作用,靶向IVc亞族轉錄因子在富鐵植物中降解,負向調節鐵的吸收,這對于防止過量鐵攝取至關重要[21]。
在對IVc亞族轉錄因子的功能進行研究時發現,在根中缺鐵時,除了ILR3,AtbHLH115、AtbHLH104和AtbHLH34也都被證明是鐵吸收的正調控因子,而ILR3和bHLH104是最關鍵的IVc轉錄因子亞族,相比較來說,bHLH115起到的作用較小,bHLH34似乎不參與地上部缺鐵反應[22]。bhlh115表現出對缺鐵的敏感性,而bHLH115的過表達促進了鐵的積累,這表明bHLH115正向調控鐵缺乏反應基因的表達[23]。bHLH104/105或bHLH34/105的同源或異源二聚體發揮著非冗余調節鐵穩態的作用,直接參與bHLH47/PYE(popeye)的調控[24]。bHLH34和bHLH104功能缺失的突變體中發生鐵缺乏反應的中斷和植物體內鐵含量減少的情況,而過表達植物則促進了鐵缺乏反應相關基因的表達以及增加了植株鐵的積累量[23]。Li等[12]進一步分析表明,每一個IVc亞族bHLH轉錄因子成員都可以直接激活下游Ib亞族基因bHLH38/39/100/101和PYE的轉錄,它們擁有相似的功能。亞細胞定位結果表明bHLH IVc亞族轉錄因子與bHLH121/URI(upstream regulator of IRT1)相互作用,并能夠促進其在細胞核的積累,共同激活Ib亞族基因轉錄[25-26]。
研究發現bHLH121功能缺失突變會導致擬南芥嚴重的鐵缺乏癥狀,減少擬南芥體內鐵的積累量,并擾亂與鐵穩態相關基因的表達。過表達FIT有助于提高bhlh121的存活率。而且bHLH121具有DNA結合活性,可以與FIT和bHLH Ib基因的啟動子結合,但未發現它對這些基因具有直接的轉錄激活或抑制活性。bHLH121在bHLH IVc轉錄因子下游發揮作用,是bHLH IVc轉錄因子的直接靶點,其表達受缺鐵誘導,且依賴于bHLH IVc[17]。這些結果均表明,bHLH121與bHLH IVc轉錄因子一起正向調節FIT的表達,在維持擬南芥中鐵的動態平衡中發揮關鍵作用。
遺傳分析表明,FIT是bHLH121的下游靶基因,屬于IIIa亞族,是擬南芥缺鐵調控網絡的中心轉錄因子[27]。FIT在根表皮受缺鐵誘導表達,fit表現出黃化表型,缺鐵時fit幼苗無法存活,約一半的缺鐵誘導基因在其根中表達下調,而鐵吸收關鍵基因FRO2和鐵調節轉運蛋白IRT1(iron-regulated transporter 1)的表達量顯著降低[28],這說明FIT對于擬南芥缺鐵應答的調節是必需的。
在酵母細胞中表達FIT與Ib亞族的bHLH38/39/100/101中的任何一個可激活FRO2和IRT1啟動子驅動的GUS表達[29],這表明FIT能與bHLH38/39/100/101中的任何一個形成異源二聚體直接調控FRO2和IRT1的表達來促進二價鐵的吸收。而進一步的分析表明,FRO2和IRT1在轉錄水平上不受調控,因為在缺鐵條件下FIT過表達植株中都檢測到了IRT1蛋白的積累和較高的FRO2的活性。與野生型相比過表達FIT和AtbHLH38/AtbHLH39的植株在地上部積累了更多的鐵[30]。以上這些結果表明FIT與Ib亞族的bHLH38/39/100/101互作形成異源二聚體來正調控下游的FRO2和IRT1,以促進擬南芥等機制I植物吸收鐵。在擬南芥中的突變研究表明,Ib bHLH轉錄因子亞族的成員bHLH100和bHLH101在功能上是冗余的,但它們可能通過激活不同的下游基因來調節鐵缺乏的反應[15],bHLH38和bHLH39也是這樣[16],bHLH38/39與bHLH100/101之間盡管非常相似,但是它們之間仍存在著非冗余的功能。
PYE是根中柱鞘細胞中發揮重要作用的缺鐵響應負調控因子。Long等[31]對PYE的功能分析表明,在缺鐵條件下,PYE對植物生長發育具有正向調節作用。染色質免疫共沉淀實驗發現PYE能夠通過直接結合到煙酰胺合成酶NAS4(nicotianamine synthase 4)、FRO3、鋅誘導的促進因子ZIF1(zincinduced facilitator 1)的啟動子上,并下調其表達。PYE與bHLH104/105/115互作,下調鐵穩態相關基因。通過CHIP-PCR實驗驗證,bHLH115直接激活bHLH38/39/100/101和PYE的轉錄,這表明bHLH34、AtbHLH104、bHLH105和bHLH115均參與了PYE調控網絡,在擬南芥鐵穩態的維持中起著關鍵作用。
bHLH11也是調節鐵穩態的負調控因子,定位于細胞質和細胞核,隨著鐵缺乏的增加而表達量降低。共表達分析表明,IVc亞族bHLH轉錄因子促進了bHLH11的核積累。進一步分析表明,bHLH11抑制了IVc亞族bHLH轉錄因子對Ib亞族基因(bHLH38、bHLH39、bHLH100和bHLH101)的調控。bHLH11還作為FIT的負調控因子,抑制FIT在擬南芥中的表達[32]。這些結論表明bHLH11可以使植物避免鐵攝取過量而導致的鐵中毒問題。
2.1.2 機制I的植物激素信號通路 FIT作為擬南芥中響應缺鐵脅迫網絡中最為關鍵的轉錄因子,參與多種響應缺鐵信號通路的調節,是這些信號的調節中心。在調控鐵吸收過程中,大部分的FIT是以非活性的形式存在,只有小部分FIT被磷酸化,感知環境中鐵的增加[33]。在缺鐵條件下,植物體內的Ca2+濃度增加,作為第二信使被類鈣調神經磷酸酶b亞基蛋白CBL1(calcineurin-B-like Ca2+sensor protein 11)或CBL9檢測到,激活Ca2+誘導的絲氨酸蛋白激酶CIPK11(cbl-interacting protein kinase 11)將FIT-C端的Ser272處磷酸化,激活大量的FIT,并且這一位點的磷酸化會促進FIT和Ib異源二聚體的形成,激活下游缺鐵響應基因。FIT還存在另一種磷酸化,就是在Tyr237和Tyr238的磷酸化,會對FIT活性產生負面影響,導致FIT向細胞核的遷移率降低,與bHLH39的相互作用減少,這也是一個調節FIT活性的方式[34]。
在擬南芥中,存在茉莉酸JA(jasmonic acid)對缺鐵脅迫的多重抑制。JA信號通路已知的主要調控因子是IIIe亞族的bHLH轉錄因子的bHLH6/MYC2(myelocytomatosis proteins)。在JA存在的情況下,MYC2導致IVa亞族bHLH轉錄因子(bHLH18、bHLH19、bHLH20和bHLH25)的表達上調[35]。這4個功能相似的轉錄因子主要在根中表達,并且都與FIT相互作用,調節FIT蛋白的積累。目前的相關研究還未提出FIT與IVa亞族的這4個轉錄因子形成的異源二聚體在植物鐵缺乏調控網絡中的下游靶基因是哪些,僅指出了FIT與IVa亞族的bHLH轉錄因子相互作用會導致FIT的26s蛋白酶體降解,而FIT與Ib亞族的bHLH轉錄因子的相互作用則會促進FIT的穩定性,這就使得IVa亞族bHLH轉錄因子和Ib亞族的轉錄因子在與FIT的結合之間存在著一種競爭關系,前者促進FIT降解,而后者促進FIT的穩定性。
赤霉素GA(gibberellin)是另外一類植物生長激素,已被證實在鐵缺乏反應中發揮作用[36]。研究發現,在缺鐵條件下,使用GA4處理后的赤霉素缺失突變體,其IRT1、FRO2、bHLH038和bHLH39(后兩者控制IRT1和FRO2表達)的表達量顯著提高,但是FIT的表達不受GA4誘導。這表明GA在缺鐵條件下對鐵吸收相關基因的誘導是依賴FIT的。GA信號通過DELLA蛋白參與缺鐵反應,酵母雙雜交、熒光共振能量轉移成像(FRET-FLIM)和免疫共沉淀(Co-IP)分析表明,GA信號的DELLA阻遏蛋白可以與FIT、bHLH38和bHLH39蛋白形成異二聚體。FRET-FLIM和EMSA結果顯示,DELLA-FIT異源二聚體并不阻止FIT和Ib亞族 bHLH轉錄因子形成異源二聚體,而是通過阻止FIT和Ib亞族 bHLH轉錄因子的異源二聚體與其靶基因啟動子的結合來抑制FIT的轉錄活性。對綠色熒光蛋白幼苗的芯片分析表明,在缺鐵條件下,在DELLA蛋白存在的情況下,FIT與其目標基因啟動子的相互作用減少[37]。在缺鐵條件下,DELLA蛋白在根分生組織中積累,最終使FIT與Ib亞族bHLH轉錄因子異源二聚體的形成以及激活鐵攝取基因。
EIN3(ethylene insensitive 3)和EIL1(EIN3-like 1)是兩個通過乙烯信號通路激活的轉錄因子[38]。二者均可以和FIT相互作用,促進FIT的穩定性,從而增加鐵攝取基因的表達。乙烯信號通路的EIN3或是EIL1并不影響FIT和Ib亞族bHLH轉錄因子形成二聚體對下游基因進行調控,二者均可以抑制FIT被蛋白酶體降解,通過促進FIT的穩定性來增強鐵的獲取[39]。MED16(mediator subunit 16)是中介體復合物的一個亞單位,連接異源二聚體的RNA聚合酶II(Pol II)復合體, 提高FIT/ Ib bHLH二聚體與FRO2和IRT1啟動子結合的穩定性,向RNA聚合酶2傳輸信號,激活FRO2和 IRT1表達[40]。MED16與另一個亞基MED25(mediator subunit 25)相互作用,MED25通過與EIN3和EIL1的相互作用,在鐵穩態調控中發揮重要作用[41]。
關于機制I植物中的bHLH轉錄因子網絡研究得相對比較清楚,不論是缺鐵情況下還是生長在富鐵的肥沃土壤中,植物中都有相應功能的轉錄因子來發揮作用,這些bHLH轉錄因子形成一張復雜的網絡(圖2),精準地調控鐵的吸收和運輸,使植物體內的鐵積累量始終維持在一個較為穩定的狀態,為植物的正常生長發育保駕護航。
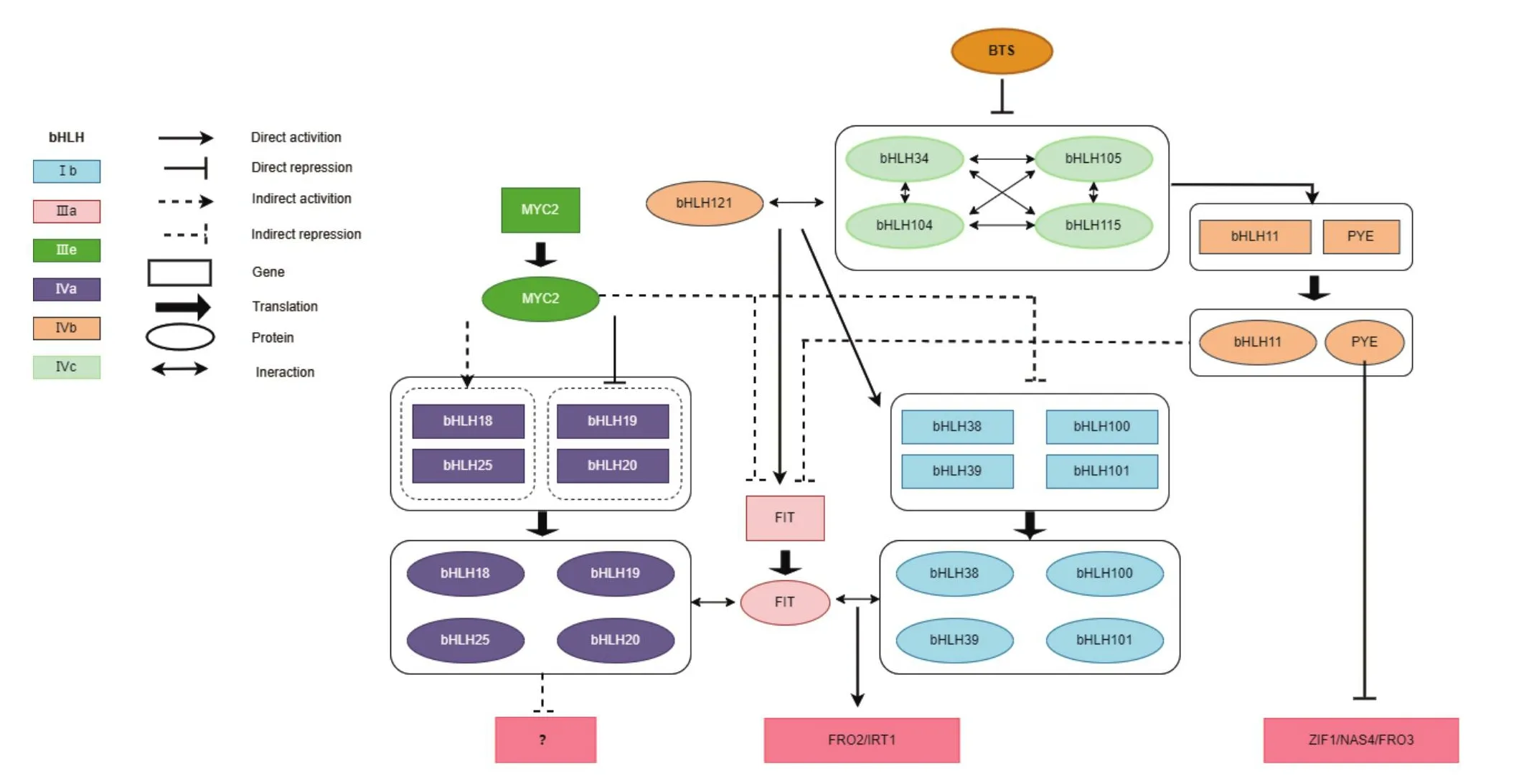
圖2 擬南芥中鐵穩態調控Fig.2 Fe homeostasis regulation in Arabidopsis
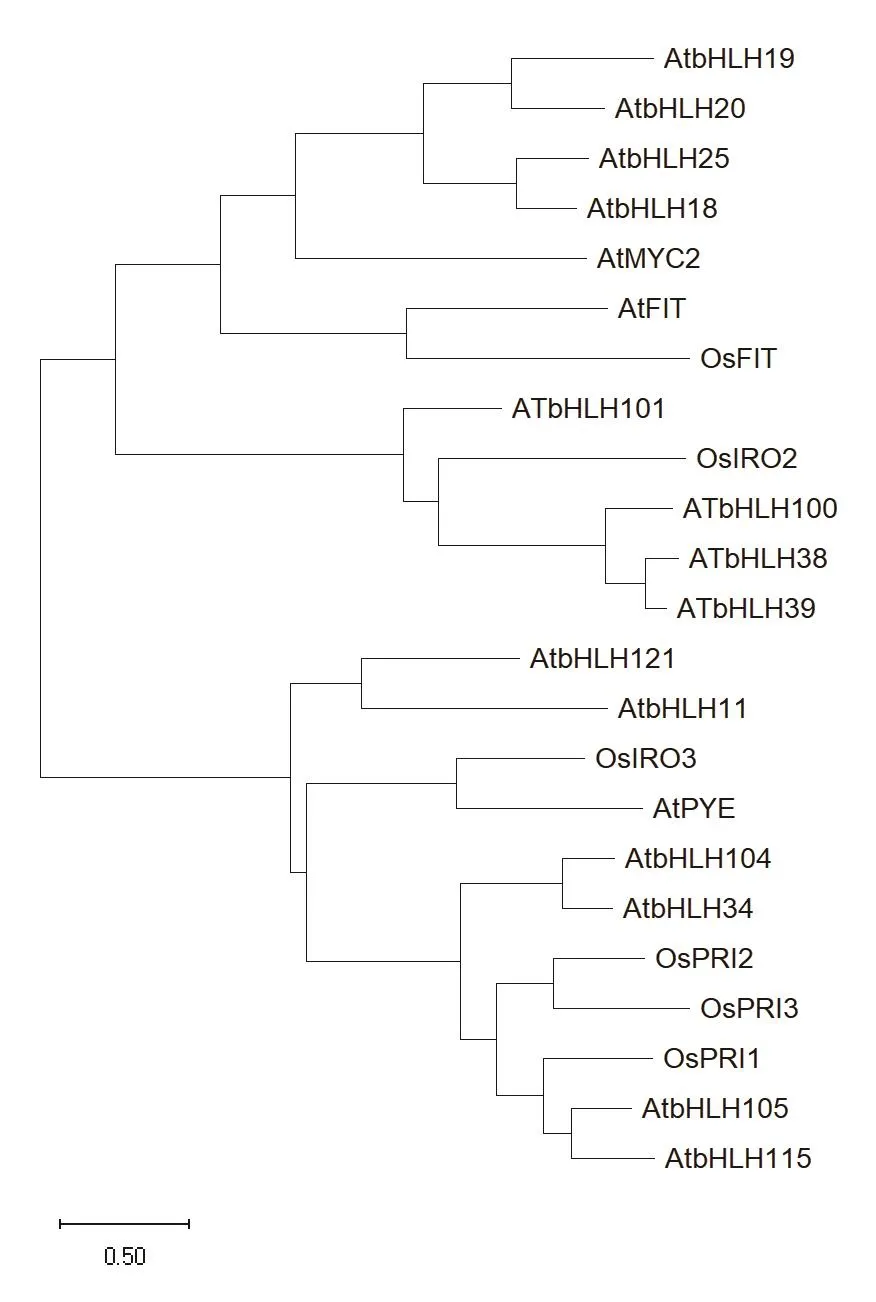
圖3 擬南芥和水稻中調控鐵穩態的bHLH轉錄因子進化樹Fig.3 Phylogenetic tree of bHLH TFs regulating Fe homeostasis in Arabidopsis and rice(Oryza sativa)
2.2 水稻中調節鐵穩態的bHLH家族轉錄因子
水稻由于其生長條件可以是淹水,也可以土培,所以是鐵吸收完整的機制Ⅱ與部分機制I同時存在[42],bHLH轉錄因子網絡調控水稻機制Ⅱ鐵的吸收及機制I與機制Ⅱ鐵的運輸。與擬南芥相比,水稻中現已被研究的鐵運輸調控相關bHLH家族的轉錄因子較少,但水稻中的bHLH家族轉錄因子大多與擬南芥中的為同源基因,處在同樣的亞族位置(圖3),在水稻中發揮著與擬南芥中相似的功能。
OsHRZ1(hemerythrin motif-containing really interesting new gene and zinc-finger protein 1)與擬南芥中的BTS同源,類似地,OsHRZ1通過26S蛋白酶途徑靶向OsPRI1(positive regulator of iron homeostasis 1)[43]。hrz1相比野生型對照對鐵缺乏的耐受性更強,Western Blot免疫印跡結果顯示,隨著OsHRZ1-GFP含量的增加,OsPRI1蛋白豐度降低,這些結果表明了OsHRZ1在鐵充足的條件下通過泛素化OsPRI1負向調節鐵的穩態[44]。比較分析表明,OsPRI1的氨基酸序列與IVc亞族的AtbHLH34/104/105/115相似,與AtbHLH34/104/105/115正調控AtbHLH38/39/100/101一樣,OsPRI1直接上調OsIRO2的表達進而激活鐵吸收相關基因的表達[45]。OsPRI2和OsPRI3是OsPRI1的兩個同源基因,已被鑒定與OsPRI1功能類似,這兩個轉錄因子也與OsHRZ1直接相互作用,且OsHRZ1促進了OsPRI2和OsPRI3的降解[20]。CHIP-qPCR實驗與EMSA實驗結果分析表明OsPRI2和OsPRI3也可以與OsIRO2(iron-related transcription factor 2)和OsIRO3的啟動子結合。因此,OsPRI1/2/3相似且具有相同的功能。
OsIRO3是屬于bHLH IVb亞族的轉錄因子,與AtPYE同源,受OsPRI1/2/3正調控。OsIRO3在根、葉和基節中表達,營養生長期葉片中表達水平較高。OsIRO3基因敲除導致植株對缺鐵敏感,幼葉嚴重壞死,根發育不良,這些證據表明OsIRO3在響應水稻缺鐵上是必不可少的[46]。在缺鐵條件下,iro3在地上部積累了較高水平的鐵,這與上調OsNAS3的表達有關,從而導致尼克酰胺NA(nicotianamine)在根中的積累增加。雙熒光素酶實驗表明,OsIRO3可以直接與OsNAS3啟動子中的E-box結合。此外,在鐵充足的條件下,鐵相關運輸基因的表達顯著上調。因此,OsIRO3在響應缺鐵的過程中起著關鍵作用,并且直接負向調節OsNAS3的表達[46]。同屬于IVb亞族的bHLH轉錄因子OsbHLH061,與兩個已知的鐵調節因子有很高的序列相似性:與水稻中的OsIRO3有43%的相似性和擬南芥中的AtPYE有49%的相似性。在缺鐵條件下,OsbHLH061基因敲除導致地上部鐵的過度積累和對鐵毒害的敏感,而酵母雙雜交實驗證明OsPRI1和OsbHLH061互作[47],表明OsbHLH061是在鐵充足時與OsPRI1互作共同下調OsIRO3的表達,負向控制鐵向地上部的運轉和在水稻中的積累,維持鐵穩態。
OsIRO2是屬于bHLH家族Ib亞族的轉錄因子,負責調節水稻中鐵穩態相關基因,是OsPRI1的另一個靶基因。OsIRO2在根和葉中表達,在缺鐵條件下,OsIRO2在營養組織中的表達僅限于根和葉。OsIRO2過表達植株地上部的鐵積累量是普通水稻的2-4倍,這表明OsIRO2是調節鐵穩態的相關基因[48]。基因芯片分析表明,OsIRO2在根中調控59個缺鐵誘導基因,如OsNAS1、OsNAS2,煙酰胺氨基轉移酶OsNAAT1(nicotianamine aminotransferase 1),脫氧麥根酸OsDMAS1(rice synthesizes the Fe chelator 2'-deoxymugineic acid 1),OsYSL15和TOM1都受到OsIRO2的正調控[49]。而OsIRO3直接調控OsIRO2的表達。酵母雙雜交試驗表明,OsIRO3與OsPRI1和OsPRI2相互作用,已經證實OsPRI1/2/3通過直接與OsIRO2啟動子結合并激活其啟動子來正向調節OsIRO2的表達[35],而OsIRO3與OsPRI1和OsPRI2相互作用抑制了OsPRI1/2對OsIRO2的轉錄激活。因此,OsIRO3通過抑制OsIRO2的表達負調節鐵的動態平衡[50]。
通過RNA-seq分析鑒定出的OsbHLH156與擬南芥中的FIT同源,是bHLH家族IIIa亞族的轉錄因子,主要在根部表達且受缺鐵誘導。轉錄激活實驗證明OsbHLH156具有轉錄激活能力。GUS染色結果顯示OsbHLH156的表達模式與OsIRO2相似,主要在根成熟區的上皮、外皮層、皮層、內皮層及中柱表達。OsIRO2定位在細胞質,OsbHLH156定位在細胞核,當OsIRO2與OsbHLH156共表達時,兩蛋白均定位于細胞核。BIFC和免疫共沉淀實驗結果顯示OsbHLH156與OsIRO2相互作用。在提供三價鐵條件下,OsbHLH156基因敲除突變體在缺鐵條件下生長時葉綠素含量比野生型植株降低了55%,降低了地上部的鐵積累量[51],這一結果證明在缺鐵條件下OsbHLH156和OsIRO2對于激活機制Ⅱ中鐵的吸收及運輸是必不可少的,二者共同正向調控水稻中三價鐵的吸收與運輸。
雖然水稻和擬南芥采用不同的鐵吸收策略,但是關鍵的轉錄因子,無論是水稻中的OsbHLH156還是擬南芥中的FIT,都通過與bHLH 家族Ib亞族轉錄因子形成異源二聚體來調節缺鐵反應。OsbHLH156是促進OsIRO2核定位所必需的,這一現象最近也被證明在擬南芥中發生,其中AtbHLH39的核定位需要FIT[52]。這說明,這兩種鐵的吸收策略本質上并沒有太大的不同(圖4)。
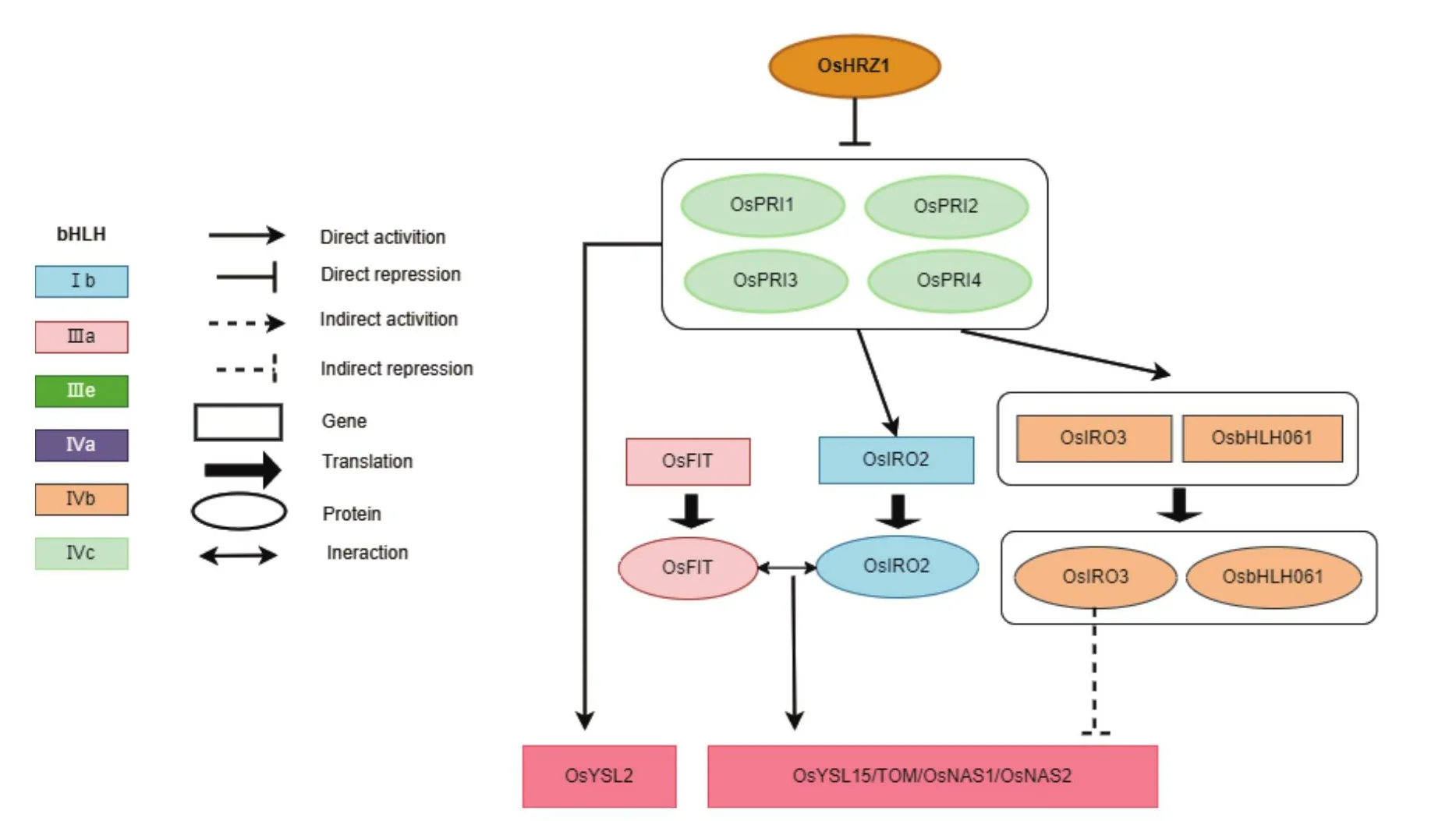
圖4 水稻中鐵穩態機制Fig.4 Fe homeostasis mechanism in rice
2.3 其他植物鐵穩態bHLH家族
番茄是機制I植物,鐵吸收及運輸模式與擬南芥相似。FER就是最先從番茄中分離得到的參與高等植物鐵穩態的轉錄因子,和擬南芥的FIT同源,在根表皮和外層皮層細胞層中都有表達[53]。FER激活鐵轉運蛋白LeIRT1的表達,調控鐵穩態[54]。SlbHLH068是策略I機制中另一個bHLH家族的成員,表達模式與FER的表達模式具有一定的相似性,在缺鐵條件下表達量顯著上調,但不受其他營養水平的影響。這表明,SlbHLH068在番茄體內的鐵穩態中起特異性作用。通過系統發育分析,SlbHLH066/067/068與擬南芥中AtbHLH38/AtbHLH39/AtbHLH100高度同源,功能也相近。酵母雙雜交和轉錄激活實驗結果顯示,SlbHLH068與FER形成異源二聚體激活了酵母細胞中由LeFRO1啟動子驅動的GUS表達[55]。這些結果表明FER/SlbHLH068異二聚體可以直接結合并激活LeFRO1的表達以促進鐵的吸收。
木本植物蘋果也是采取策略I吸收鐵,MdbHLH104被鑒定為蘋果中應對缺鐵反應的關鍵轉錄因子,序列與OsPRI1相似。MdbHLH104基因的過表達顯著提高了轉基因蘋果植株和愈傷組織在缺鐵條件下的H+-ATPase活性和對鐵缺乏的耐受性[56]。Wang等[47]的研究表明,MdHLH104蛋白直接與MdAHA8基因的啟動子結合正向激活其表達,以及質膜H+ATPase活性和鐵的吸收。類似地,MdbHLH104直接調控了3個鐵敏感的bHLH基因的表達,即MdbHLH38、MdbHLH39和MdPYE。此外,酵母雙雜交實驗和pull-down實驗結果表明MdBHLH104還與MdbHLH105、MdbHLH115、MdPYE、MdbHLH11和MdbHLH121相互作用,共同調節MdAHA8基因的表達、質膜H+-ATPase活性和蘋果愈傷組織中鐵的含量。因此,MdbHLH104是蘋果中鐵動態平衡的正調控因子,與其他蘋果bHLH家族一起通過調控MdAHA8基因的表達和質膜H+-ATPase的活性來調節蘋果對鐵的吸收。
從木本植物小金海棠中分離到3個bHLH基因:MxbHLH01、MxIRO2和MxFIT,并對其進行了鑒定,MxbHLH01的表達僅限于根,在缺鐵條件下表達上調,MxbHLH01可能與其他蛋白質相互作用來調節基因對缺鐵的響應[57]。在缺鐵條件下,MxIRO2在小金海棠的根和葉中均被誘導[58]。它可能與其他轉錄因子形成異二聚體或多聚體,以控制與鐵吸收相關的基因的表達。目前有關果樹應對缺鐵脅迫的研究較少,還需要進一步挖掘果樹鐵吸收及運輸調控機制。
3 總結與展望
目前bHLH轉錄因子是已知的在高等生物的代謝、生理和生長發育過程中發揮著重要作用的最大的轉錄因子家族[59]。從在番茄中分離出并鑒定FER[60]開始,人們就從未停止過對bHLH轉錄因子家族的探索與研究,尤其是bHLH轉錄因子家族應對缺鐵脅迫的調控機制方面。隨著各種生物技術手段越來越完善、相關研究越來越多,我們對bHLH家族成員是如何調控鐵吸收及運輸的機理也越發清晰明了。通過對bHLH在植物各組織基因表達的檢測、目的基因在細胞中的定位情況以及其他一些體外蛋白質實驗的研究,在缺鐵條件下利用兩種機制調控鐵平衡的相關過程已經相對清晰地展現在了我們的眼前,然而我們現在仍然不知道這個網絡最上游的轉錄因子的表達是如何調節的,以及同亞族相似但非冗余的bHLH轉錄因子各自具體的功能也還未被研究,這表明我們仍然沒有把這個鐵調控網絡完全地探索清楚。我們離完全了解bHLH轉錄因子調控鐵穩態機理還有很長一段距離,還需要在探究真相的道路上繼續前行。