Na+/H+交換體家族第三個亞型在感染性腹瀉中的作用及活性調控機制
王思盈,鄒 宏,宋振輝
(西南大學動物醫學院,重慶 402460)
哺乳動物轉運蛋白的溶質載體9A家族(solute carrier 9A,SLC9A),即Na+/H+交換蛋白(Na+/H+exchangers,NHEs),是真核和原核單價的一個亞組陽離子質子反轉運蛋白超家族。該蛋白家族主要通過將胞外Na+轉運到胞內、將胞內H+轉運到胞外來發揮其pH穩態調節功能[1-2]。目前已發現有9種鈉氫交換蛋白,各亞型間具有結構相似性和組織分布特異性。其中,Na+/H+交換體家族第三個亞型(Na+/H+exchanger isoform 3,NHE3)高度表達于腎和胃腸上皮,通過Na+濃度梯度驅動來負責細胞內水和Na+的吸收。它的運輸功能對于維持身體的鹽和水穩態以及酸堿平衡至關重要,大多數發現表明,NHE3轉運功能在高血壓發作前被激活,此后受到抑制;在糖尿病、腎病和心力衰竭中也上調[3]。當胃腸上皮細胞頂膜的NHE3活性受到抑制時,Na+轉運就會出現障礙,從而腸道內的水電解質潴留、營養物質吸收停滯,最終導致腹瀉的發生[4]。近年來,有關NHE3在腹瀉中的作用研究日益增多,涉及NHE3活動的機理研究也不斷被揭示,全面闡述NHE3生理功能及在感染性腹瀉中的調控機制,對有效預防和靶向治療感染性腹瀉具有重要借鑒。
1 NHEs基因家族簡介
1989年Sardet等克隆了第一個NHE基因。迄今為止,人們已在哺乳動物中發現了9種具有不同的組織分布和功能特性的亞型,共同構成膜交換蛋白的一個基因家族[5]。鈉氫交換蛋白家族包含有11個成員,分別命名為NHE1~NHE11,共同構成一個膜交換蛋白家族[6]。9種NHE亞型均由600~900個氨基酸組成,約有40%的氨基酸相似性,相互之間的差異主要在于從跨膜(transmembrane,TM)段到胞質部分的堿基序列不同。NHE各亞型具有不同的組織分布及亞細胞定位,細胞學功能也不相同(表1)[7]。這些亞型根據其分布大致可以分為兩組:主要在質膜中存在和起作用的NHEs(NHE1~5)和主要或僅在內膜細胞器中的NHE6、7、9、10[8]。其中,NHE1亞型表達最廣泛,其在所有組織的細胞中普遍表達,也被稱為管家基因亞型,主要定位于質膜,是pH穩態和細胞體積調節的主要調節因子[9]。NHE2之前被認為在Na+的吸收中起作用,但是小鼠缺失NHE2對腸道Na+的吸收沒有產生影響,后發現其缺失會引起胃壁細胞活動異常[10-11]。NHE3在小腸、結腸和腎近端小管的頂端膜中高度表達,是機體上皮細胞頂膜電中性Na+吸收的主要轉運載體[12]。NHE4在胃上皮細胞中豐富存在,表達主要局限于胃中,功能與NHE2類似[13]。NHE5主要在大腦中表達,但也在脾、睪丸和肌肉等組織中存在,被認為是樹突棘生長的負調控因子[14]。NHE6、7和9具有較高的同源性,主要存在于腦、心等線粒體豐富的組織,能幫助建立細胞器的特異性和維持pH穩態。NHE8主要高表達于胃中,在Na+吸收早期和保護胃腸道黏膜方面發揮作用[15-16]。NHE9定位于晚期回收小泡,其過表達會促使腫瘤生長的癌信號持續存在[17]。作為破骨細胞特異性成員NHE10,可調節破骨細胞分化和存活[18]。NHE11為最新發現的亞型,其生理功能報道甚少,還有待進一步研究。

表1 鈉氫交換蛋白基因家族和組織分布
2 NHE3分子結構及生理功能
NHEs各亞型之間的結構也很相似,包括12個跨膜螺旋的N端域和1個相同C端胞質域,其中N端膜結構域(50%~60%)的保守性明顯大于C末端序列的相似性(20%~23%),C端區域決定了不同Na+/H+交換體之間激酶調節的差異[12]。NHE3分子二級拓撲結構和其他亞型相似,由831個氨基酸殘基組成,其中1~454位氨基酸組成N-terminal疏水膜,而455~831位氨基酸組成C-terminal親水膜(圖1)。其N端有13個跨膜的α螺旋,主要在離子交換中共同發揮作用,也是NHE最固定的序列;C端則通過連接細胞骨架和調節因子實現對NHE3活性的調節[19]。其中,豬的NHE3基因全長約78.5 kb,mRNA約6.1 kb,cDNA能編碼836個氨基酸殘基,蛋白大小約為93 ku[20]。作為胃腸道中鈉氫交換劑,NHE3不以單體的形式存在而是以動態大分子復合物存在,所以存在著多個蛋白結合位點。例如,NHE3 COOH末端在氨基酸585和689之間結合鈉氫交換調節因子(Na+/H+exchanger regulatory factor,NHERF),NHERFs同時結合NHE3,并通過與Ezrin結合將其與肌動蛋白細胞骨架連接,同時通過兩個PDZ結構域(PDZ domain containing,PDZ)和COOH末端ERM(ezrin/radixin/moesin)結合結構域組裝多蛋白信號傳導復合物[21]。
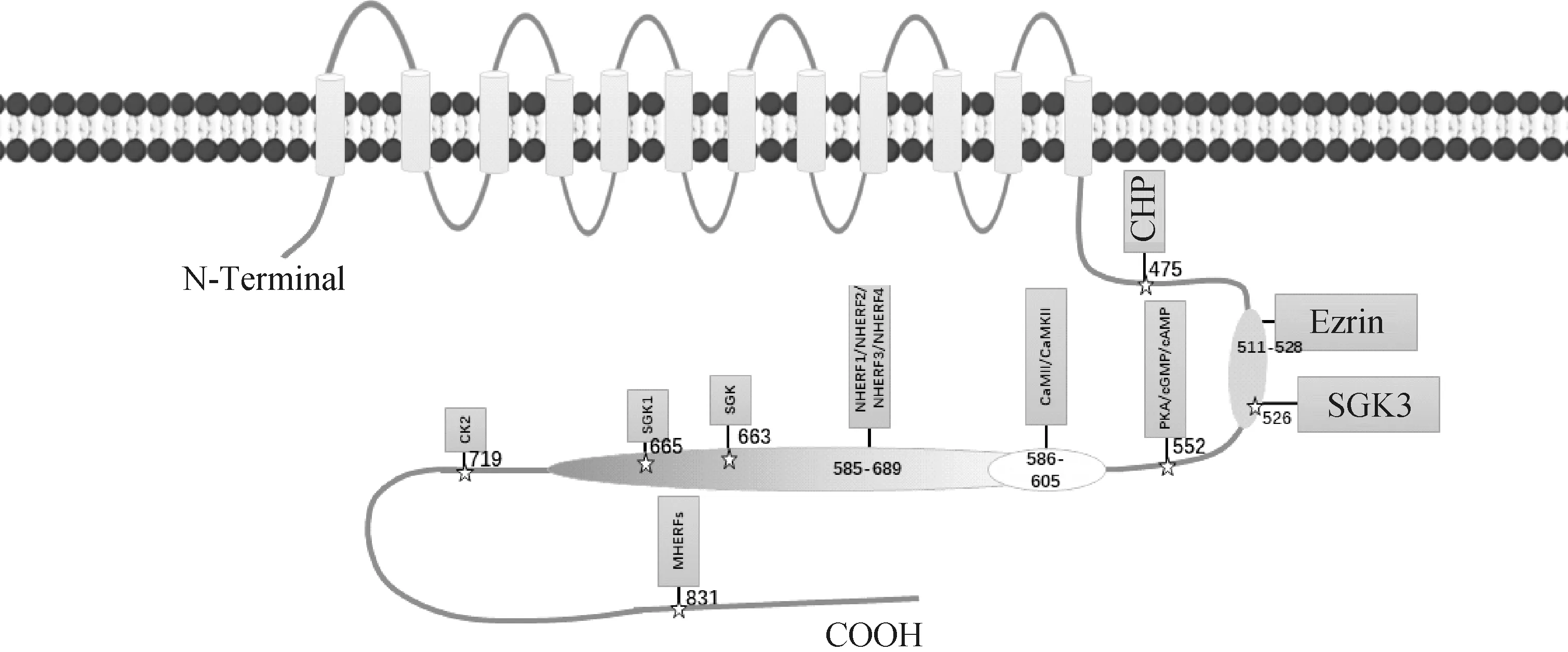
圖1 NHE3分子結構圖
NHE3在結腸、腎、小腸、膽囊與胃中表達較高,在胸腺、卵巢、前列腺以及腹外側髓質的一些呼吸系統也有發現,且不同物種的表達位置存在差異性,其特殊的組織分布也決定著特殊的生理作用[22]。經過多年研究發現,NHE3在血壓調節、腎臟容量和腹瀉等方面起著重要的生理調節作用。McDonough等[23]通過NHE3敲除小鼠出現低血容量、低壓、輕度代謝性酸中毒和腹瀉現象,證明了NHE3是腎和腸道的主要Na+轉運體。其中,腎近端小管中的NHE3負責大量Na+和水的重吸收,并且僅在近端小管中存在或喪失NHE3功能就足以改變基礎血壓穩態[24]。在分化的腸上皮細胞的頂端膜中表達的NHE3,是腸道中主要的營養依賴性Na+和水的吸收機制。NHE3還通過H+梯度調節其他營養素的吸收,例如二肽和氨基酸等[25]。由于NHE3對Na+的吸收作用,所以其對體液和血壓穩態以及酸堿調節有顯著貢獻[26-27]。
3 NHE3在腹瀉中的作用
目前研究認為,腸上皮細胞吸收Na+可分為3型:電中性、生電性和與有機物質偶聯的NaCl吸收,有研究表明腸腔側Na+/H+交換子介導的電中性是NaCl被吸收的主要途徑,而腸道中的NHE3是腸道電中性鈉吸收的重要運載體[28]。細胞順化學梯度進行Na+轉運時,也為H+向胞外轉運提供能量,促進H+分泌到胞外造成細胞內pH升高,這一過程將促使HCO3-向細胞外轉運,進而通過其偶聯的Cl-/HCO3-交換體使Cl-被轉運進入細胞內,精密調控腸道分泌和吸收平衡。1985年,Ganapathy和Leibach提出腸道肽的吸收依賴于刷狀邊界膜上的質子梯度,并且頂膜中的Na+/H+交換機制與基底外側膜中的Na+/K+-ATP酶結合將產生并維持該質子梯度。在后來的細胞內pH值可在功能上耦合Na+和二肽的吸收試驗中也確實證實了Ganapathy和Leibach的假設。2001年,Ledoussal等[29]發現了NHE3基因敲除小鼠的腹瀉情況在NHE3/NHE2雙敲除小鼠中不會進一步惡化,再次證實了NHE3是Na+和體液吸收的主要參與者。2017年Karasov等[30]探究了NHE3的活性變化是腸道Na+吸收的主要原因,同時還伴隨旁細胞的水分吸收。由此可見 NHE3 介導的 Na+交換在腹瀉中具有十分重要的作用[31],當細菌、病毒和毒素等病原進入腸道后,會引起腸上皮細胞上相應的NHE3活性發生受到抑制、Na+轉運出現障礙時,腸道內就會出現營養物質吸收停滯、水電解質潴留,最終導致腹瀉的發生。
4 NHE3在感染性腹瀉中的活性調控研究
4.1 病毒感染對腸道NHE3的活性影響
許多病毒均可感染腸上皮細胞,且一般以小腸作為入侵靶點,引起各種炎癥因子的表達水平提高,從而發生炎癥損傷反應,同時也會引起腸上皮細胞的離子通道活性和表達降低,如當NHE3活性受到抑制、Na+轉運出現障礙時,則會引發腹瀉。
目前,Niu等[32]已證實豬傳染性胃腸炎病毒(transmissible gastroenteritis virus,TGEV)感染豬小腸上皮細胞后Na+/H+交換蛋白3的表達顯著降低。2018年,Yang等[33]初步驗證了TGEV與豬小腸上皮細胞(intestinal porcine enterocyte J2,IPEC-J2)的特異性結合受體表皮生長因子受體(epidermal growth factor receptor,EGFR)結合后,會進一步激活EGFR和磷酸化細胞外信號調節激酶(extracellular signal-regulated kinase,ERK),調控Na+/H+交換蛋白NHE3的表達和活性。Yang等[34]則驗證了在TGEV感染情況下抑制鈉-葡萄糖共轉運蛋白1(sodium-glucose cotransporter 1,SGLT1)的表達會使得絲裂原活化蛋白激酶活化蛋白激酶-2(mitogen-activated protein kinase-activating protein kinase-2,MAPKAPK-2)和 Ezrin 磷酸化水平上調,且細胞質膜上 NHE3 的表達量也顯著上調。余秋寒等[35]則在此基礎上探究了TGEV感染能上調磷酸化Ezrin表達水平,且隨著感染時間增加網格蛋白轉錄水平與表達水平呈下調趨勢。Niu等[36]則進一步通過熒光共定位與Co-IP技術,證實了TGEV N蛋白與NHE3間存在互作關系,并且利用分子對接與計算機輔助篩選技術篩選出針對N蛋白與NHE3結合域的小分子抑制劑伊立替康,在通過動物試驗后發現其具有一定的治療作。同一時期,晏濤等[37]則驗證了EGFR/ERK 信號通路參與了與TGEV同屬的豬流行性腹瀉病毒(porcine epidemic diarrhea virus,PEDV)感染對NHE3的調控,發現PEDV感染情況下EGFR能負反饋調節NHE3 的活性。
近年來,關于輪狀病毒(rotavirus,RV)引起腹瀉對NHE3蛋白水平及其生物活性的影響也取得了部分研究進展。王昕等[38]在2018年將構建好的表達NHE3的人小腸上皮細胞(the human epithelial cell line,Caco-2)模型分成CT組和RV組,通過BCECF-AM法和細胞表面NHE3生物素化法測定Na+/H+交換活性和細胞表面NHE3蛋白水平,發現RV感染Caco-2細胞60 min后,細胞NHE3 轉運活性下降近60%,在感染后期能顯著降低細胞表面 NHE3/總NHE3 的比值。牛美蘭等[39]則在此基礎上,進一步探究了網格蛋白內吞途徑介導的NHE3調控作用,發現網格蛋白拮抗劑CPZ可在一定程度上有效拮抗RV感染對細胞表面NHE3水平和生物活性的抑制作用,但此抑制作用不能被拮抗劑CPZ完全抵消。王鵬等[40]則通過脂筏破壞劑甲基β-環糊精(methyl-beta-cyclodextrin,MβCD)破壞細胞膜脂筏檢測NHE3細胞表面蛋白含量和Na+/H+交換活性,此時脂筏介導的細胞NHE3內吞和胞吐作用將被抑制,結果發現MβCD可有效拮抗 RV感染對細胞表面NHE3蛋白的量及活性的抑制,甚至使感染后的細胞表面NHE3恢復至正常水平,這一現象提示RV可通過脂筏依賴性轉運途徑抑制細胞表面NHE3蛋白的量及活性。在其另一項研究中發現,在脂筏依賴性內吞途徑中,細胞分裂周期蛋白42(cell division cycle 42,Cdc42)發揮著不可或缺的作用[41]。
新型冠狀病毒肺炎(corona virus disease 2019,COVID-19)引起的腹瀉發生率為2%~50%,Donowitz等[42]通過將嚴重急性呼吸綜合征冠狀病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)與受試者接觸,發現病毒培養2 d后,血管緊張素轉換酶Ⅱ、NHE3和溶質載體家族26成員3[SLC26A3,又稱DRA(downregulated in adenoma)]的mRNA水平降低,NHE3蛋白也減少,最后推斷COVID-19引起的腹瀉似乎是鈣依賴性炎癥性腹瀉,并可能抑制中性NaCl的吸收(減少NHE3蛋白和mRNA,減少DRA mRNA)。Pearce等[43]研究了SARS-CoV-2感染時多種轉運蛋白的變化,發現與耳鼻喉科、腸道內杯狀細胞和潘氏細胞相比,腸道干細胞的NHE3會顯著降低。M C Cure和E Cure[44-45]發現COVID-19中NHE活化時間延長可能導致細胞外H+離子積累和隨后的氧化還原反應而導致細胞內pH降低,長時間的 NHE 激活可能是 COVID-19 中細胞因子釋放綜合征的原因;進一步發現SARS-CoV-2可以通過破壞腸道微生物群,通過NHE3抑制觸發心腎綜合征。
4.2 細菌感染對腸道NHE3的活性調控
多種細菌均可感染胃腸道抑制NHE3的活性并引起腹瀉,包括霍亂弧菌、腸病性大腸桿菌(enteropathogenicEscherichiacoli,EPEC)和艱難梭菌[46]。霍亂弧菌感染會增加Cl-分泌,并降低Na+的吸收,因為該細菌會分泌一種典型的AB毒素即霍亂毒素(cholera-toxin encoding phage,CTX),CTX可以誘導宿主質膜釋放腺苷酸環化酶(adenylate cyclase,AC),增加3′,5′-環磷酸腺苷(cyclic adenosine monophosphate,cAMP)的濃度,激活蛋白激酶A(protein kinase A,PKA)[47-48]。PKA通過刺激刷狀邊界的囊性纖維化跨膜傳導調節因子以介導Na+/H+反轉運蛋白NHE3的內吞作用磷酸化,并降低質膜中的NHE3蛋白豐度,同時還阻止NHE3遞送到表面膜[48]。
EPEC是人和動物腹瀉的重要病原之一,關于EPEC感染引發腹瀉目前已發現了包括鈉/氫交換、氯化物/碳酸氫鹽交換、鈉葡萄糖共轉運和丁酸鹽攝取等多種離子轉運過程。EPEC產生兩種不同的腸毒素,通過兩種不同的受體和第二信使系統誘導液體和電解質分泌:不耐熱腸毒素與頂膜受體結合后內化,激活基底外側腺苷酸環化酶(AC),促使細胞質中的環磷酸腺苷(cAMP)含量持續增高;耐熱腸毒素與神經節苷酯GM1受體結合后刺激腸上皮細胞中鳥苷酸環化酶(GC)的分泌,可使細胞漿中環磷酸鳥苷酸(cGMP)的分泌上升并激活cGMP效應蛋白激酶G[3]。研究報道EPEC感染會導致腸上皮細胞中NHE3活性的下降,但具體抑制NHE3的信號級聯反應尚未闡明。Hecht等[49]2004年研究發現鈉氫交換劑活性在EPEC感染時受到差異調節,在伴隨NHE3活性降低的同時存在NHE2代償性的大幅攝取Na+。Hodges等[50]則確定NHE3活性的變化是效應蛋白EspF特有的,EspF可能通過與分揀微管連接蛋白9相互作用改變囊泡販運進一步調節NHE3活性。Jekin等[51]則通過IEC系和人源化小鼠驗證了Nedd4-2依賴性的泛素化增強了霍亂毒素和腸致病性大腸桿菌對人類NHE3的抑制作用。
艱難梭菌是導致艱難梭菌相關性腹瀉,假膜性結腸炎的主要病原體,其可以抑制上皮細胞的 NHEs活性。目前已經發現艱難梭菌B可以通過兩種方式抑制上皮細胞NHE3的作用:其一是Hayashi等[52]和Lee等[53]已經證明的艱難梭菌毒素B誘導了Ezrin的去磷酸化,其通過使Rho GTP酶(rho GTP-binding proteins)的失活來破壞 NHE3 與微絨毛肌動蛋白間的相互作用,以促進NHE3發生內化和活性受損;其二是可以破壞rho鳥嘌呤核苷酸交換因子7與SH3同源結構域2(Src homology domains 3,SH3)和多個錨蛋白形成的重復結構域,該結構域具有維持頂端膜 NHE3表達的功能[54]。
4.3 其他病原生物侵染對腹瀉時NHE3的影響
在Enns等[55]2019年的研究中,發現豬密螺旋體(B.hyodysenteriae)和漢普森細螺旋體(B.hampsonii)引起的腹瀉與NHE3活性有關,且發現NHE3 mRNA和蛋白質水平的降低與之前認為的是由于宿主細胞因子引起的有所不同。近年來的研究發現細胞因子IL-1α沒有減少Caco-2細胞中NHE3 mRNA的表達,而全細胞漢普森細螺旋體裂解物能顯著下調NHE3的mRNA表達并顯著增加Caco-2細胞中p38磷酸化,這些數據表明存在一種潛在的信號傳導機制使得兩種短螺旋體能直接抑制NHE3的轉錄和翻譯,從而導致腹瀉的發生[56-57]。隱孢子蟲感染這種在世界范圍內發生的人畜共患腹瀉疾病,在感染仔豬時會引起嚴重的腸道菌群失調和腹瀉[58]。在Kumar等[59]的研究中,發現溶質載體家族26成員3(solute carrier family 26 member 3,SLC26A3)在腸道上皮細胞中的表達和功能因細小隱孢子蟲感染而減少。SLC26A3與NHE亞型一起參與腸道的電中性吸收,但細小隱孢子蟲感染所引起的腹瀉中,NHE3發揮的具體作用還待進一步研究[60]。
5 NHE3活性調控
生理情況下,NHE3經轉錄、翻譯后由內涵體在細胞質和細胞膜間轉運,但只有存在于細胞膜上的NHE3才能發揮離子交換作用[61]。細胞膜上的NHE3又可分為可移動型和不移動型,其中不可移動型約占70%[62]。可移動型被內化后胞吞,經胞內循環后被調控至細胞表面發揮作用,不可移動型與細胞骨架蛋白結合形成復合物轉運Na+。通常NHE3在多蛋白復合物中的上皮刷狀緣和細胞內隔室之間循環,并且復合物的大小隨著結合蛋白的快速調節而變化,這種在隔室之間的交換運動是改變其在質膜上數量的一種手段,也是一種調節表面NHE3活性的方式。NHE3在上皮細胞頂端膜和細胞內的活性受到多種機制的調控,且較為復雜多樣,可區分為NHE3的長期(慢性)和短期(急性)調控,主要包括基因轉錄水平的長期調節,各種蛋白質磷酸化和激酶之間的動態相互作用以及質膜和不同胞內區室之間運輸的急性調節。
5.1 轉錄和翻譯水平的調節
糖皮質激素、醛固酮、代謝性酸中毒和丁酸鹽主要通過影響NHE3的轉錄來實現對NHE3的調控。丁酸鹽是一種短鏈脂肪酸,通過結腸中的微生物發酵膳食纖維所產生,它可以增強結腸對NaCl的吸收,并且丁酸鈉可以誘導Sp1的磷酸化和Sp3的乙酰化調節,從而調控NHE3基因的啟動子[63]。Musch等[64]對大鼠進行連續2 d的纖維補充后,檢測到大鼠體內NHE3 mRNA和蛋白質水平的升高繼發于結腸中Na+攝取量的增加。在Amin等[65]的瞬時轉染研究中,丁酸鈉在孵育細胞24 h后會給予NHE3啟動子10倍刺激活性。Muthusamy等[66]的研究則發現敲低肝細胞核因子4α可以顯著降低了NHE3 mRNA和NHE3蛋白水平,其可以直接調節NHE3啟動子的活性。很久前糖皮質激素就被驗證能在轉錄水平上增加腸道和腎中水和電解質的吸收,對NHE3活性和mRNA豐度也有增強作用。但近年來有研究表明糖皮質激素可以通過胞吐作用快速誘導細胞表面NHE3蛋白含量的增加[67],He等[68]和Wang等[69]還發現糖皮質激素可以通過NHERF2支架促進血清和糖皮質激素調節激酶1(serum and glucocorticoid-induced kinase 1,SGK1)對NHE3的磷酸化從而實現NHE3易位到細胞表面實現急性調控,這一發現在后來的Grahammer等[70]使用缺乏SGK1表達的小鼠中,糖皮質激素介導的NHE3活性和NHE3易位到小鼠腸的頂膜顯著減弱得到了驗證。
在翻譯水平上,Anbazhagan等[71]將miR-326和miR-330-5p模擬物轉染到人結直腸癌細胞中,顯著降低了NHE3蛋白表達,而NHE3信使核糖核酸水平沒有變化,探究了MicroRNA通過翻譯抑制對NHE3進行轉錄后調節的新機制。在大鼠腎和負鼠腎細胞中,Hu等[72]已證明多巴胺可以作用于NHE3 mRNA的5′-未端翻譯區域中的順式序列來降低NHE3翻譯,長期應用多巴胺會增加NHE3泛素化降解。然而,急性多巴胺效應會介導NHE3/磷酸化NHE3比值降低,導致NHE3被囊泡內吞[73]。所以,盡管多種激素常被認為在轉錄和翻譯水平上調節NHE3的活性,但隨著各項研究的逐步深入,多種激素可能在快速調控NHE3含量上也發揮著作用,并且存在著調節其他NHE亞型活性的作用。
5.2 NHE3的內吞作用
轉運蛋白NHE3與上皮細胞中的高爾基體、內體和溶酶體等細胞器一樣,參與細胞內區室之間的循環轉運[74]。細胞內NHE3是活化的,且可通過內腔Na+與胞質H+的交換促進內膜室的酸化,胞吐和胞吞之間的平衡決定了NHE3的膜表面表達水平,但是并非所有的質膜交換都同樣容易被內吞。事實上,70%的 NHE3亞群部分地通過微絨毛肌動蛋白細胞骨架介導的物理保留機制定位于膜表面導致運動受限,無法參與內吞作用,只有那些能在膜中擴散進入網格蛋白包裹的凹坑的蛋白才能被內化[75]。研究表明,循環的cAMP、cGMP、升高的Ca2+以及引起這些第二信使增加的神經體液物質和細菌毒素會抑制質膜表面NHE3的活性,增加NHE3多蛋白復合物的形成,并觸發NHE3以一種依賴于Rho GTP酶的持續活性的方式轉變為根尖膜上內化的、可移動的NHE3亞群[26]。
大多數NHE3內吞通過網格蛋白和白蛋白依賴性過程發生。網格蛋白(Clathrin-mediated endocytosis,CME)介導的內吞作用是最獨特的內吞作用機制,是上皮細胞吸收大分子的主要途徑,NHE3-Clathrin依賴復合物的內化途徑主要通過Ca2+結合蛋白Syt I與腸上皮NHE3結合后,依靠AP2和網格蛋白募集激活胞吞所需的網格蛋白的組裝,介導cAMP和Ca2+誘導的胞吞[76-77]。NHE3的白蛋白內吞作用需要形成包含許多跨膜蛋白和輔助蛋白的大型蛋白復合體,其復合體可能包括輔助蛋白,如支架蛋白NHERF1和NHERF2的PDZ基團。
5.3 激酶激活和細胞骨架的運輸
NHE3的C端細胞質結構域包含多個假定的磷酸化位點,蛋白激酶磷酸化可以調節NHE3的部分信號轉導;其C端也能夠與大量的細胞和結構蛋白相互作用,與肌動蛋白細胞骨架附著后有助于NHE3的頂端保留。NHE3通過細胞骨架的運輸主要包括cGMP和cAMP兩種酶的激活。其中,多巴胺(DA)、甲狀旁腺激素(PTH)、血管活性腸肽、分泌素和腸毒素(如霍亂毒素)激活腺苷酸環化酶,可迅速提高腸道cAMP水平,具體來說,位于F-actin中的Ezrin與NHERF1或NHERF2和cAMP依賴蛋白激酶II型(PKAII)結合,定位PKAII,使其能夠磷酸化NHE3,從而抑制其活性[78]。與cAMP作用機制不同的是,cGMP對NHE3的作用似乎完全通過激活刷狀緣中的cGMP依賴性蛋白激酶II型(cGMP-dependent protein kinase II,cGKII)來實現,cGKII的N端附著在質膜上,C端與NHERF2 的PDZ結構域2結合,使環GMP能有效抑制NHE3。Donowitz等[79]驗證了附著在PDZ2上的是細胞骨架連接蛋白(ezrin-radixin-moesin,ERM)結合結構域,通過該結構域,Ezrin一方面將NHERF1和NHERF2連接到肌動蛋白細胞骨架,另一方面分別結合PKAII和cGKII,PKAII與Ezrin結合后直接引起NHE3磷酸化,而cGKII必須與PDZ2-COOH末端結合和通過豆寇酰化直接固定在上皮刷狀緣上。NHE3以復合物和動態大分子的形式既直接又間接與Ezrin結合,Ezrin不僅與NHERF和PKA結合,也通過其C端結構域與肌動蛋白結合,且含有PDZ結構域的蛋白調節因子NHERF1和NHERF2作為連接NHE3和Ezrin的中間體,對于NHE3調節的許多方面都是必需的。
Han等[80]為了確定二甲雙胍介導的NHE3調節機制,通過5′-AMP活化蛋白激酶激活劑模擬二甲雙胍,發現二甲雙胍增加了NHE3的磷酸化和泛素化。Stephens等[81]的研究用毛喉素和3-異丁基-1-甲基黃嘌呤刺激細胞內cAMP導致野生型小鼠遠端回腸和盲腸中草酸鹽凈分泌增加,并抑制盲腸和遠端結腸中的鈉吸收,而試驗組小鼠cAMP對草酸鹽分泌的刺激被削弱,這表明NHE3可能在cAMP刺激草酸鹽過程中發揮作用。
5.4 相關活化信號激活NHE3易位
NHE3從內體轉移到質膜主要通過各種質膜活化信號激活細胞骨架蛋白后將微腔中的NHE3運輸到質膜上。當受到某些信號的刺激時,如SGLT1活性的增加、EGFR信號、Ca2+濃度的升高以及與PAK相關轉換因子β(PAK-interacting exchange factorβ,βPix)和錨蛋白重復域2(ankyrin repeat domains 2,Shank2)蛋白的結合,NHE3將從再回收內體轉運回質膜的頂端。其激活路徑分別如下:1)SGLT1/P38AMP/MAPMAPK2/PI3K/AKT2/Ezrin通路激活NHE3;2)EGFR/RhoA/RoCK/RSK2途徑調控NHE3;3)Ca2+/CaMK II依賴途徑介導ANG II對NHE3的激活; 4)βPix通過Shank2介導的蛋白-蛋白相互作用上調NHE3[82]。
5.5 脂筏和膜曲率調節NHE3活性
除了磷酸化、支架和運輸之外,還有另一個級別的急性NHE3調節:其活化動力學可以通過質膜的曲率來調節[84]。這種通過脂筏而不依賴與網格蛋白來調控NHE3活性的方法,是另一種在質膜內劃分NHE3的依據。脂筏主要在NHE3內吞過程中發揮作用,且可能近一半的表面NHE3位于脂筏中,并且Zachos等[84]證明了卡巴膽堿介導的NHE3內吞是通過脂筏和活化的Cdc42依賴性途徑發生,不涉及網格蛋白。NHE3的活性和轉運依賴的這些脂筏,可能對NHE3的膜信號轉導、轉運和轉運活性的時機非常重要。
綜上所述:NHE3的調控機制與路徑包括:1)在Ca2+、cGMP和cAMP依賴性信號通路的刺激時,NHE3結合物經歷一系列復雜的動態變化,將穩定的NHE3亞群轉化為可移動的亞群;2)隨后主要通過包合蛋白/白蛋白中介途徑轉移至高爾基體和內質網中再處理后轉移到再回收內體;3)當循環核小體中的NHE3受到質膜活化信號的刺激時,例如Ca2+/Ezrin/RSK2/Shank2,它會遷移到質膜上并重新固定在細胞骨架上,形成NHE3的穩定亞群,從而發揮氫和鈉交換的生理活性(圖2)。

圖2 NHE3信號通路圖(修改自文獻[82])
6 小結與展望
NHE3 是調節水鹽重吸收和酸堿平衡的主要亞型,在過去的幾十年中,關于NHE3 在腹瀉中的研究已經取得了顯著的進展。作為胃腸道中Na+/H+的重要交換器,當受到細菌、病毒和毒素等病原的感染后,其活性受到抑制,腸道中的Na+轉運出現障礙,同時水和電解質等將潴留導致腹瀉的發生[85]。在任何情況下,NHE3并不是以單體的形式存在,而是以復雜、動態變化的大分子復合物的形式存在。這種多蛋白復合物在上皮刷狀緣和細胞內隔室之間循環運動是調節NHE3活性的一種手段,并且NHE3的活性調控包括從上皮質膜頂端到細胞內體循環、轉錄和翻譯調控、蛋白質之間的動態相互作用、以及相關信號通路的調控等多種機制。這些在各個層面的復雜調節,具有巨大的治療開發潛力。從理論上講,每個調節步驟都可以作為治療靶點。腹瀉病動物可能受益于NHE3活化,而NHE3抑制有助于減輕便秘現象,且NHE3在急性腎損傷和高血壓等疾病中也有重要作用。但目前關于NHE3的研究依然較為局限,所以更加綜合地研究其相關功能、調控機制是必須的,這也將為諸多與腹瀉、高血壓和腎臟方面等相關的疾病提供新的治療途徑和思路,具有重要的理論意義和實踐意義。

