過表達UCP3基因對薩湖羊前體脂肪細胞分化的影響
劉林麗,彭雪蘭,李 博,程樂凡,次仁拉姆,張恩平*
(1.西北農林科技大學動物科技學院,楊凌 712100;2.西北農林科技大學生命科學學院,楊凌 712100)
肌內脂肪 (IMF) 的分布是羊肉肉質和口感的重要影響因素,與肉的多汁、嫩度和適口性呈正相關[1-2],適當提高肌內脂肪含量有助于改善羊肉品質[3-4]。肌內脂肪的含量主要由肌內脂肪細胞的數量和大小決定,其中肌內脂肪細胞的形成尤為重要,為IMF的沉積提供了場所[5]。脂肪細胞分化則是形成肌內脂肪細胞的重要過程,脂肪細胞來源于間充質干細胞(MSCs),MSCs分化為脂肪母細胞后繼續分化為前體脂肪細胞,前體脂肪細胞最終分化為成熟脂肪細胞[6]。脂肪細胞分化是一個復雜的多步驟過程,涉及PPARγ、C/EBPα等一系列轉錄因子和多種機制的相互作用,還涉及胰島素敏感性的誘導和細胞分泌能力的變化[7]。RAN-Seq技術的快速發展,為探究脂肪細胞分化的分子機制提供了技術支持[8-10]。謝光杰等[11]通過對簡州大耳羊肌內脂肪細胞成脂分化差異表達基因的篩選發現,UCP3基因可作為調控肌內脂肪細胞成脂分化的侯選因子。本實驗團隊前期通過對薩湖羊脂肪組織進行轉錄組測序,同樣篩選到與脂肪沉積相關的候選基因UCP3,在此基礎上本試驗旨在探究UCP3對薩湖羊前體脂肪細胞分化的影響。
解偶聯蛋白3(UCP3)屬于線粒體載體家族基因,主要分布于骨骼肌線粒體膜內邊界[12],具有抗氧化功能[13],作為線粒體產生活性氧的調節器和過氧化脂質的轉運體[14-15],對體重恒態、代謝率調節和體溫調節非常重要[16-17]。UCP3還具有保護心臟和線粒體的功能[18-20],在參與維持線粒體的生物發生和功能方面具有重要意義[21-22],其基因多態性與人類的肥胖和糖尿病密切相關[23-24]。研究表明,不同物種中,UCP3的基因功能不同,且同一物種不同組織中UCP3基因的表達量也不相同。羅成等[25]研究表明,UCP3基因在山羊骨骼肌、脂肪、心肌等各個組織中均有表達,且在背最長肌中表達量顯著高于其它組織。彭廣南[26]發現,廣西三黃雞胸肌中IMF含量與UCP3基因的表達量呈顯著正相關。這些研究表明,UCP3基因可能參與脂肪沉積的過程,但UCP3基因如何調控脂肪細胞分化并參與脂肪沉積的作用機制目前尚不清楚。
為進一步探究UCP3基因在薩湖羊脂肪細胞分化中的作用,本試驗通過無縫克隆技術構建了UCP3過表達載體(pcDNA3.1-flag-UCP3),并成功轉染至薩湖羊前體脂肪細胞,檢測其對脂肪生成相關基因的影響。旨在闡明UCP3基因對薩湖羊前體脂肪細胞分化的影響,為進一步揭示UCP3在綿羊脂肪沉積過程中發揮的功能及調控機理提供理論支持。
1 材料與方法
1.1 材料
1.1.1 試驗動物及樣品采集 本試驗動物為4月齡薩湖羊,選取出生日齡相近、體況和健康狀況一致的4月齡薩福克()×湖羊(♀)F1代羔羊3只,屠宰體重(37.45±0.44) kg,樣品于甘肅慶環肉羊制種有限公司進行采集。將薩湖羊頸部放血致死后,快速采集心、肝、脾、肺、腎、空腸、回腸、十二指腸、半腱肌、尾部脂肪、皮下脂肪、臀部脂肪、腎周脂肪和背最長肌等組織立即投入液氮,置于-80 ℃保存備用。將1月齡、體重10.8 kg的薩湖F1代羔羊,頸部放血致死,快速取背最長肌組織置于含500 U·mL-1雙抗的PBS中,用于薩湖羊前體脂肪細胞的分離培養。
1.1.2 主要試劑 RNAiso Plus 試劑盒、Trizol試劑盒、DEPC水等購自寶生物工程(大連)有限公司;E.Z.N.A Gel Extraction Kit 膠回收試劑盒、質粒小量提取試劑盒、去內毒素質粒提取試劑盒均購自Omega公司;DMEM高糖基礎培養基、DMEM/F12培養基、D-PBS緩沖液均購自 Invitrogen公司;OriCell?小鼠MC3T3-E1細胞成脂誘導分化試劑盒購自賽業生物科技有限公司;實時熒光定量試劑盒購自諾唯贊生物科技有限公司。
1.2 方法
1.2.1 薩湖羊UCP3基因克隆 通過Trizol法提取薩湖羊背最長肌組織總RNA,反轉錄得到cDNA。根據 GenBank 數據庫中薩湖羊的UCP3序列(NM_001 308 581.1),利用軟件Oligo 7設計薩湖羊UCP3基因克隆引物,引物序列為(F:ATGGTTGGACTGCAACCTTCAGA;R:AGATGCT-ACGAGACTCTCCATTTTGA),由中科羽瞳生物科技有限公司合成。
qPCR反應體系為25 μL:cDNA模板1 μL,正、反向引物各0.4 μL,10×PCR buffer for KOD-Plus-Neo 2.5 μL,2 mmol·L-1dNTPs 2.5 μL,25 mmol·L-1MgSO41.5 μL,KOD-Plus-Neo(1 U·μL-1)0.5 μL,ddH2O補至終體積20 μL。PCR反應條件:95 ℃預變性10 min;98 ℃變性10 s,68 ℃退火20 s,72 ℃延伸5 s,共35個循環。
1.2.2 薩湖羊UCP3基因序列同源性分析 采用NCBI中的BLAST程序(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)進行基因序列比對;運用DNAStar 7.1軟件中的MegAlign程序對綿羊(NP_001295510)與山羊(XP_005690021.3)、豬(NP_999214.1)、人(NP_003347.1)、牛(NP_776635.1)、羚羊(XP_040114806.1)、小鼠(AAB87084.1)、雞(NP_001384581.1)、馬(XP_014597360.1)等物種的相似性進行比對。
1.2.3 薩湖羊UCP3基因組織表達分析 提取薩湖羊的心、肝、脾、肺、腎、空腸、回腸、十二指腸、半腱肌、尾部脂肪、皮下脂肪、臀部脂肪、腎周脂肪和背最長肌等14個組織cDNA為模板進行實時定量PCR反應,以GAPDH為內參基因。qPCR反應體系為20 μL:cDNA模板1 μL,正、反向引物各0.4 μL,ChamQ Universal SYBR qPCR Master Mix 10 μL,ddH2O補至終體積20 μL。PCR反應條件:95 ℃預變性10 min;95 ℃變性10 s,退火20 s,72 ℃延伸15 s,共35個循環。采用相對定量法計算各基因表達水平,結果用2-ΔΔCt計算。
1.2.4 薩湖羊UCP3過表達載體的構建 將Pc-DNA3.1-flag進行線性化擴增(F:GTCGACGA-TATCGAATTCCTGC; R:AGATCTCTCGAGT-CTAGAACTAGTGGG),膠回收純化載體PCR產物,以背最長肌組織cDNA為模板,擴增含有UCP3基因的插入片段,(F:AGGAATTCGATATCGTC-GACATGGTTGGACTGCAACCTTCA;R:TTCT-AGACTCGAGAGATCTTCAAAATGGAGAGT-CTCGTAGCAT),膠回收純化插入片段。按照ClonExpress Ⅱ試劑盒說明書配制同源重組反應體系。將10 μL重組產物加入含100 μL的DH5α感受態細胞中,冰上靜置30 min,42 ℃水浴熱激90 s后,涂板,挑取單克隆擴繁,提取質粒進行測序,將測序結果正確的質粒命名為pcDNA3.1-flag-UCP3。
1.2.5 薩湖羊前體脂肪細胞分離培養 將薩湖羊脂肪組織剪碎,用1%的I型膠原酶于37 ℃消化1 h,待組織呈現云絮狀時終止消化,細胞濾液經離心后獲得細胞沉淀,加入紅細胞裂解液去除紅細胞,PBS清洗后接種于培養皿,待多數細胞貼壁后立即更換培養基,以獲得相對較純的薩湖羊前體脂肪細胞,此后每2 d更換一次培養基,大約培養7 d左右細胞即匯合至80%~90%,用0.25%胰酶消化細胞,按1∶3的接種密度進行傳代培養。
1.2.6 細胞轉染 將薩湖羊脂肪細胞接種于6孔板,當細胞達到70%~80% 融合時進行轉染。按照脂質體Lipofectamine 2000 (Invitrogen) 使用說明進行操作。將質粒pcDNA3.1-flag-UCP3轉染至薩湖羊前體脂肪細胞,以轉染空載質粒(pcDNA3.1-flag-NC)的細胞作為陰性對照,每組各3個重復,將5 μL脂質體Lipofectamine 2000 (Invitrogen) 和2.5 μg質粒pcDNA3.1-flag-UCP3或pcDNA3.1-flag-NC分別用125 μL Opti-MEM稀釋,室溫靜置5 min,緩慢混合,靜置20 min后轉入細胞。
1.2.7 脂肪生成相關基因表達量檢測 轉染48 h后收集細胞,用Trizol法提取總RNA,按照TaKaRa公司試劑盒Prime ScriptTMRT說明進行反轉錄。根據NCBI數據中綿羊UCP1、PPARγ、C/EBPα、ADIPOQ、LEP、FAS、CPT1B的基因序列,利用Oligo 7設計實時熒光定量PCR引物,引物序列見表1。

表1 引物信息
1.2.8 薩湖羊前體脂肪細胞誘導分化 傳代培養的細胞融合至70%~80%時,用含10%胎牛血清的高糖DMEM/F12再培養2 d以使細胞接觸抑制,退出細胞周期,此時換用MDI誘導培養基(含0.5 mmol·L-1IBMX、1 μmol·L-1DEX和2 μg·mL-1Ins),記為第0天;培養2 d后,換用胰島素培養基 (含2 μg·mL-1Ins) 維持分化2 d,記為第2 天;培養2 d后換為完全培養基(含10% FBS的DMEM/F12),此后一直用完全培養基培養至第8 天,期間每2 d換1次液。到第8 天為止,多數前體脂肪細胞分化為成熟脂肪細胞。
1.2.9 油紅O染色及細胞脂質測定 根據小鼠MC3T3-E1細胞成脂誘導分化培養基說明書,誘導分化轉染pcDNA3.1-flag-NC和pcDNA3.1-flag-UCP3后的薩湖羊前體脂肪細胞,每組3個重復,8 d后,用改良油紅O染色液對脂肪細胞進行染色,并在顯微鏡下觀察染色情況,以此鑒定提取的細胞是否為脂肪細胞。油紅O染色觀察成像結束后,在細胞中加入2 mL的100%異丙醇用以提取脂質,25 ℃孵育30 min后,收集上清,并在510 nm波長下,用酶標儀分析各組提取液的光密度(OD)值,每組提取液重復3次。
1.3 數據處理
使用Excel 2010對試驗數據進行整理,使用SPSS 26.0統計軟件中的單因素方差分析(One-way ANOVA),使用2-ΔΔCt法進行數據處理,通過GraphPad Prism軟件進行繪圖,P<0.05表示差異顯著。
2 結 果
2.1 薩湖羊UCP3基因克隆
將PCR擴增產物用1%的瓊脂糖凝膠電泳分析,如圖1所示,得到一條936 bp左右的條帶,與目的產物大小相符。將克隆序列CDS區送至中科羽瞳生物技術公司進行測序,將測序結果與NCBI數據庫中綿羊UCP3序列(NM_001 308 581.1)CDS區比對后發現一致性達到99.7%。

M.DNA相對分子質量標準;1、2.UCP3的擴增產物
2.2 薩湖羊UCP3基因序列同源性分析
利用 NCBI BLAST比對得到與綿羊同源性相近的物種的氨基酸序列,將薩湖羊UCP3氨基酸序列與其他物種進行同源性分析(圖2)。結果顯示,薩湖羊UCP3蛋白與山羊的同源性最高,為98.71%。其次是羚羊和牛,分別為97.75%、95.82%,與雞的同源性最低,為70.36%,說明該基因在不同物種間具有一定的特異性。
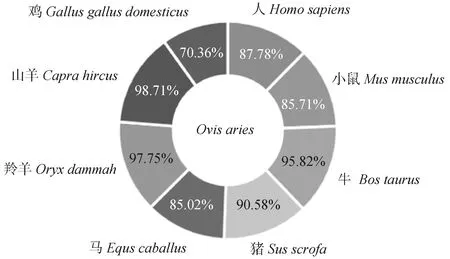
圖2 薩湖羊UCP3同源性分析
2.3 薩湖羊UCP3基因組織表達譜構建
為探究薩湖羊UCP3基因的組織表達特性,本研究對薩湖羊UCP3基因在心、肝、脾、肺、腎、空腸、回腸、十二指腸、背最長肌、皮下脂肪等14個組織中的mRNA表達水平進行檢測(圖3)。結果表明,薩湖羊UCP3基因在14個組織中均有表達,在心、脾、肺等內臟中表達量較高。
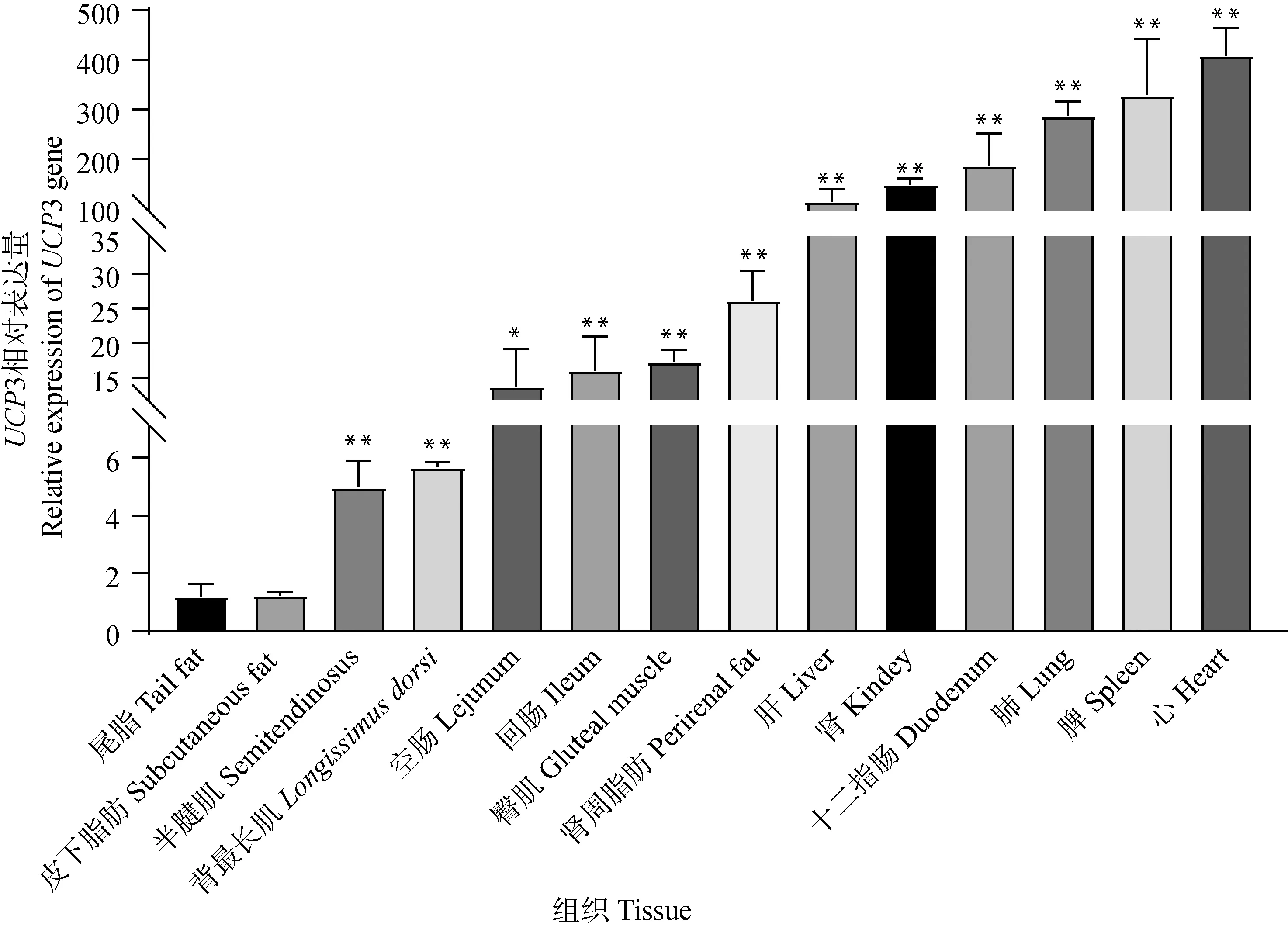
“*”表示差異顯著(P<0.05),“**” 表示差異極顯著(P<0.01);內參基因為GAPDH,n=3。下同
2.4 UCP3基因在薩湖羊前體脂肪細胞分化中的作用
2.4.1UCP3基因在薩湖羊前體脂肪細胞分化中的時序表達分析 圖4為薩湖羊前體脂肪細胞成脂分化過程中第0、4和8天UCP3 mRAN的表達水平。結果顯示,薩湖羊UCP3基因在薩湖羊前體脂肪細胞誘導分化時期的表達水平持續升高,誘導分化第4和8天的脂肪細胞中UCP3 mRNA含量分別顯著(P<0.05)和極顯著(P<0.01)高于第0天誘導分化的脂肪細胞,表明UCP3基因在薩湖羊前體脂肪細胞分化過程中有一定的作用。

圖4 UCP3基因在脂肪分化過程中的相對表達水平
2.4.2 薩湖羊UCP3過表達載體的構建 線性化pcDNA3.1-flag-NC瓊脂糖凝膠電泳結果如圖5A所示,圖5B為通過無縫克隆技術構建的重組質粒pcDNA3.1-flag-UCP3,以重組質粒pcDNA3.1-flag-UCP3為模板成功擴增出UCP3基因(圖5C),且測序結果與薩湖羊UCP3基因片段一致。表明pcDNA3.1-flag-UCP3重組質粒構建成功。

A.pcDNA3.1-flag-NC單酶切鑒定;B.pcDNA3.1-flag-UCP3重組質粒;C.重組質粒UCP3基因PCR擴增結果。M1、M2、M3.DNA 相對分子質量標準;1.線性化pcDNA3.1-flag-NC擴增產物;2.pcDNA3.1-flag-UCP3重組質粒;3.pcDNA3.1-flag-UCP3重組質粒UCP3擴增產物
2.4.3 pcDNA3.1-flag-UCP3的轉染效率 如圖6A所示,轉染pcDNA3.1-flag-UCP3組和pcDNA3.1-flag-NC組相比,UCP3基因mRNA的表達水平顯著上升(P<0.01),通過分光光度法測定細胞脂質含量結果顯示(圖6B),與轉染pcDNA3.1-flag-NC組相比,轉染pcDNA3.1-flag-UCP3組前體脂肪細胞中脂質含量顯著上升(P<0.01)。油紅O染色結果表明,過表達UCP3后脂肪細胞中脂滴含量明顯增加(圖6C)。

A.pcDNA3.1-flag-UCP3轉染后薩湖羊前體脂肪細胞中UCP3基因的表達量;B.通過分光光度法測定細胞脂質含量;C.pcDNA3.1-flag-UCP3轉染后薩湖羊前體脂肪細胞中脂滴積累的變化。白色箭頭所示為脂滴;圖中比例尺為200 μm
2.4.4 過表達UCP3基因對脂肪細胞相關基因表達的影響 為了進一步闡明綿羊UCP3基因對脂肪細胞分化的調控機制,本研究檢測了過表達UCP3對脂肪細胞相關基因表達水平的影響。結果如圖7所示,與pcDNA3.1-flag-NC組相比,pcDNA3.1-flag-UCP3組PPARγ、C/EBPα、LEP的表達均極顯著上升(P<0.01),FAS、UCP1的表達量顯著上升(P<0.05),CPT1B、ADIPOQ的表達量均有上升但不顯著(P>0.05)。

圖7 過表達UCP3對薩湖羊脂肪細胞相關基因表達的影響
3 討 論
UCP3是一種具有高度保守性的蛋白,廣泛表達于動物的各個組織。孫斌等[27]研究發現,UCP3基因在延邊牛脾臟中表達量最高,在肝臟和腎臟中表達水平較低。羅成等[25]研究表明,UCP3基因在山羊股三頭肌、臂三頭肌、背最長肌和肺中的表達豐度高于其它組織。譚義洲[28]研究發現,UCP3基因的多態性與盤羊×歐拉羊F1代體重和胸圍密切相關。本研究發現,UCP3基因在薩湖羊心、肝、脾、肺、腎、瘤胃、背最長肌、皮下脂肪等14個組織均有表達,UCP3在心臟和脾臟中表達量較高,表明UCP3基因具有組織特異性,同時發現UCP3基因在臀部脂肪和腎周脂肪中也有較高的表達,且目前關于UCP3基因是否參與薩湖羊脂肪沉積的調控尚無相關報道。因此,本試驗進一步探究了UCP3基因在薩湖羊脂肪沉積中的作用。
脂肪組織在營養動態平衡中起重要作用,大約三分之一的脂肪組織由脂肪細胞組成[29],脂肪細胞在調節能量和葡萄糖的動態平衡中起核心作用[30]。而前體脂肪細胞是研究脂肪組織發育的重要模型,因此本試驗以薩湖羊前體脂肪細胞為模型,探究UCP3基因在脂肪細胞分化過程中的作用。羅成等[25]研究表明,在山羊脂肪細胞中UCP3基因的表達量隨著誘導時間的增加呈持續升高的趨勢。這與本研究結果一致,因此表明UCP3基因在脂肪細胞分化過程中扮演著一定的作用。
為了進一步研究UCP3基因在脂肪細胞分化過程中扮演的角色,本研究將構建好的過表達UCP3基因載體轉染至薩湖羊前體脂肪細胞,經成脂誘導分化試劑誘導后,檢測與脂肪沉積相關的標志基因的表達情況,以此深入了解脂肪細胞中的脂質代謝。PPARγ是直接與脂肪形成有關的轉錄因子,通過增加脂肪細胞的數量促進脂肪的形成[30]。C/EBPα在脂肪細胞的終末分化中起重要作用,缺乏該因子會導致胰島素抵抗并阻礙體內白色脂肪組織的形成,而棕色脂肪組織的形成則不受其影響[31-32],C/EBPα促進脂肪細胞特定表型,包括胰島素敏感性和脂質堆積[33]。瘦素和脂聯素是脂肪組織合成的最豐富的脂肪因子,在能量平衡和食欲調節中起著關鍵作用[34]。CPT1B屬于CPTs家族一員,是脂肪酸β-氧化的關鍵限速酶,對脂肪的分解供能具有重要的調控作用[35]。當特異性敲除脂肪細胞中UCP1基因后,會導致脂肪細胞中甘油三脂的生成量顯著減少[36],本研究結果顯示,過表達UCP3后,脂肪細胞中的UCP1表達量上調了3 872倍,表明UCP3對UCP1的表達產生了極大的影響。Pan等[37]研究發現,UCP3的表達必須依賴于UCP1的存在,若UCP1被敲除則UCP3的豐度會降低,而本研究發現,過表達UCP3后脂肪細胞中UCP1的表達量大幅上升,表明兩者的表達相互影響,UCP1表達上調也可能與LEP表達量上升促進瘦素分泌從而上調UCP1的表達有關[38]。研究表明,LEP基因表達上調可通過瘦素抑制Hedgehog信號通路從而促進脂肪細胞分化[39],楊孝良等[40]研究表明,高濃度Leptin處理人前體脂肪細胞,可促進其增殖分化。但譚飛等[41]在瘦素對雞原代前體脂肪細胞增殖分化的研究中發現,瘦素對雞前體脂肪細胞增殖分化無顯著影響。這表明瘦素對脂肪細胞增殖分化的影響與細胞種類存在相關性。已有研究表明,過表達ADIPOQ可以加速脂肪細胞分化并促使脂肪組織中的脂質積累,其表達量上升可能通過延長轉錄因子PPARγ和C/EBPα的表達時間,從而促進脂肪細胞分化[42]。本研究結果顯示,過表達UCP3后薩湖羊前體脂肪細胞中脂肪分化標志基因PPARγ、C/EBPα、LEP的表達均極顯著上升,FAS、UCP1的表達量顯著上升,CPT1B、ADIPOQ的表達量均有上升但不顯著。推測UCP3基因對薩湖羊前體脂肪細胞分化起正調控作用,可能是通過促進與脂肪生成相關基因的表達量,進而促進薩湖羊前體脂肪細胞脂質的生成。這些結果可能為理解UCP3調控薩湖羊前體脂肪細胞脂質生成的網絡調節機制提供理論依據。
4 結 論
本研究成功繪制了薩湖羊UCP3基因在多組織的表達譜及成脂分化過程中的表達規律,發現UCP3基因的多組織廣泛表達特性,其在心臟和脾臟中相對表達量較高。在脂肪分化過程中UCP3基因表達呈現上升趨勢,在分化后期達到最高。過表達UCP3能夠促進脂肪細胞脂質生成。推測其在前體脂肪細胞分化過程中為正調控因子,可能通過調控脂肪分化標志基因PPARγ、C/EBPα、FAS等的表達促進前體脂肪細胞成脂分化。然而,關于進一步闡明UCP3在前體脂肪細胞成脂分化過程中的作用機制還需深入研究。

