黃瓜CsGDSL脂解酶基因的克隆與表達分析
高璐瑤,曹嘉健,王春華,武 濤,杜亞琳
(1.湖南農業大學 園藝學院,湖南 長沙 410128;2.園藝作物種質創作與新品種育種工程研究中心,湖南 長沙 410128;3.農業農村部園藝作物(蔬菜、茶葉等)基因資源評價利用重點實驗室,湖南 長沙 410128)
黃瓜(CucumissativusL.)是我國重要的蔬菜作物之一,其口味清爽、品種多樣,深受廣大消費者喜愛[1-3]。GDSL(GDSL lipase,Gly-Asp-Ser-Leu)基因參與表皮角質的聚合過程,影響脂質、次級代謝產物和細胞壁生物合成等主要過程[4-5]。明確黃瓜中CsGDSL的表達模式,有助于進一步探究CsGDSL影響黃瓜角質層發育的作用機制,為黃瓜表皮光澤的研究奠定基礎。表皮光澤是蔬菜作物重要的商品性狀之一,光澤性較強的蔬菜在市場上更具有競爭力[6-7]。表皮光澤作為外觀性狀,必然與植物表皮組分差異有著一定的聯系[8]。
植物表皮主要成分為角質層,是植物表皮外的一層疏水保護層,形成于陸生植物表皮細胞壁外表面的脂質保水層[9-10]。其通常由角質和蠟質組成,而蠟質則又分為內層蠟質與外層蠟質,外層蠟質通常稱為蠟粉;角質是角質層的主要結構成分,其主要組分是聚酯[11-14]。這三者均對植物表皮的形態特征有所影響[15-17]。GDSL脂肪酶屬于α/β水解酶折疊蛋白超家族,其二級結構一般由多個α-螺旋、β-折疊組成,在調節植物生長發育、抗逆性和組織器官的形態建成等眾多方面發揮著關鍵的作用[18-20]。目前,Uttam等[21]發現,在具有光澤的高粱突變體的葉和稈表面上表皮蠟積累發生變化,對其遺傳圖譜進行分析,發現注釋為GDSL的基因座最可能與表皮蠟沉積相關的基因。Girard等[22]研究表明,當對番茄SlGDSL1基因進行RNAi干擾時,部分轉基因植株番茄果實由于角質層沉積發生缺陷,角質層厚度變薄,番茄果皮光澤性變強。Petit等[23]發現在番茄果皮光澤性強的突變體中,其蠟質、角質的含量和構成物以及角質層厚度等方面都有一定變化,對其中的角質缺陷突變體進行遺傳作圖發現,存在一個具有剪接突變的GDSL2基因。以光澤性不同的2份辣椒為材料進行轉錄組測序分析,結果表明,GDSL基因在提高角質含量中起著重要作用[24]。
雖然前人已在番茄中初步研究了GDSL基因對于植物角質層及果實表皮光澤的影響,但在黃瓜中關于GDSL基因的克隆與表達模式分析的研究尚未報道。本研究參考葫蘆科基因組數據庫,對CsGDSL基因進行克隆。通過蛋白序列比對以及進化樹構建,分析黃瓜CsGDSL脂解酶基因的保守性,并通過qRT-PCR技術明確了該基因在黃瓜不同組織部位中的表達差異。
1 材料和方法
1.1 試驗材料
本試驗研究材料為黃瓜種質創新與遺傳改良團隊實驗室繁育的高代自交系華南型黃瓜649,于2021年6月種植于湖南農業大學耘園基地大棚中(長沙)。取莖、卷須、根、生長點、開花當天的雄花與雌花以及0,3 d的子房。所有材料取后立即置于液氮中,保存在-80 ℃的超低溫冰箱中備用。
本研究所有克隆引物由軟件 Primer Premier 5.0設計,北京擎科生物科技有限公司合成并測序(表1)。
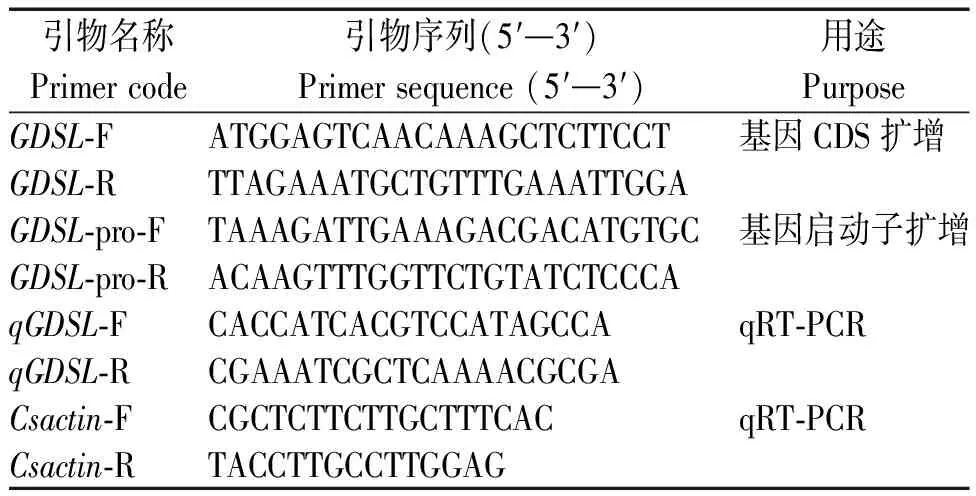
表1 引物信息
1.2 總RNA的提取與cDNA第一鏈的合成
TRIzol法(全式金,北京)提取莖、卷須、根、生長點、開花當天的雄花、雌花以及0,3 d的子房的總RNA,試驗步驟參照說明書。以總RNA為模板,反轉錄合成cDNA第1鏈(諾唯贊,南京),置于-20 ℃備用。反轉錄程序如下,第1步:Oligo(dT)23VN(50 μmol/L)1 μL,Total RNA 10 pg~5 μg,RNase-free ddH2O補至12 μL;將反應液于65 ℃加熱5 min,迅速置于冰上驟冷,并在冰上靜置2 min;第2步:取4×gDNA wiper Mix 4 μL加于上述反應液中,用移液器輕輕吹打混勻。42 ℃ 2 min;第3步:反應液中加入10 × RT Mix 2 μL,HiScript II Enzyme Mix 2 μL,50 ℃ 45 min,85 ℃ 2 min,-20 ℃保存。
1.3 黃瓜CsGDSL基因的克隆與序列分析
以反轉錄得到的cDNA為模板,參照黃瓜基因組數據庫(http://cucurbitgenomics.org/organism/20)檢索出的CsGDSL基因序列設計基因特異性引物,利用高保真酶進行PCR擴增(諾唯贊,南京),以克隆目的基因。反應體系如下:2 × Phanta Max Buffer 25 μL,dNTP Mix(10 mmol/L)1 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,GDSL-F 1 μL,GDSL-R 1 μL,cDNA 1 μL,ddH2O補至50 μL,反應程序:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 1 min,35次循環;75 ℃ 5 min;4 ℃保存。PCR產物經1%瓊脂糖凝膠電泳分析,并回收目的條帶,連接T載體(擎科,北京),轉化大腸桿菌,選取陽性克隆測序。
1.4 CsGDSL基因的生物信息學分析
利用 NCBI (https://www.ncbi.nlm.nih.gov/)分析CsGDSL基因結構。通過Expasy Protparam(http://web.expasy.org/trans-late/)分析CsGDSL理化性質,如相對分子質量、等電點等。使用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)預測該基因二級結構,PHYRE2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)預測該基因三級結構。根據CsGDSL的氨基酸序列,在NCBI數據庫中通過Blast程序搜索得到與CsGDSL蛋白同源性高的植物蛋白序列,使用MEGA 6軟件繪制系統發育樹。
1.5 黃瓜CsGDSL脂解酶基因在黃瓜不同部位中表達量的分析
取莖、卷須、根、生長點、開花當天的雄花、雌花以及0,3 d的子房的總RNA進行qRT-PCR,以明確CsGDSL在黃瓜不同組織部位中的表達情況。內參選用黃瓜actin基因,所用引物序列見表1。qRT-PCR反應體系如下:Hieff?miRNA Universal qPCR SYBR Master Mix 10 μL,Forward Primer(10 μmol/L)0.4 μL,Reverse Primer(10 μmol/L)0.4 μL,cDNA 2 μL,ddH2O補至20 μL(翌圣,上海)。利用iCycler iQTM 5 real-time PCR 檢測系統(Bio-Rad,Hercules,CA,美國)進行qRT-PCR,反應程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40次循環,每個反應3次生物學重復,3次技術重復。使用 2-ΔΔCt算法分析CsGDSL在不同組織部位中相對定量 mRNA水平。
1.6 CsGDSL啟動子功能分析
通過黃瓜基因組數據庫獲得CsGDSL啟動子序列,并利用啟動子分析網站PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)對黃瓜CsGDSL啟動子轉錄調控元件進行分析。
2 結果與分析
2.1 黃瓜CsGDSL基因的克隆與序列分析
以黃瓜cDNA為模板進行PCR擴增,獲得CsGDSL(Gene ID:XM_004143264.3)CDS長度為1 059 bp,且與葫蘆科數據庫中一致,表明該基因克隆成功(圖1)。CsGDSL編碼352個氨基酸,推測蛋白分子量為39.04 ku,理論等電點為8.55,親水性為-0.138(該值為負則代表親水性,為正則代表疏水性)。對其二級結構、三級結構進行預測,表明CsGDSL編碼蛋白序列中包含無規卷曲45.45%,α-螺旋33.24%,延伸連13.35%以及β-轉角7.95%(圖2)。
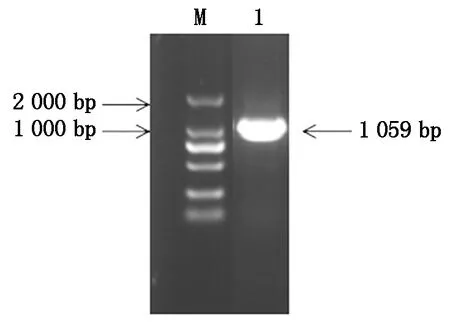
M.DM2000 DNA Marker;1.目的片段。
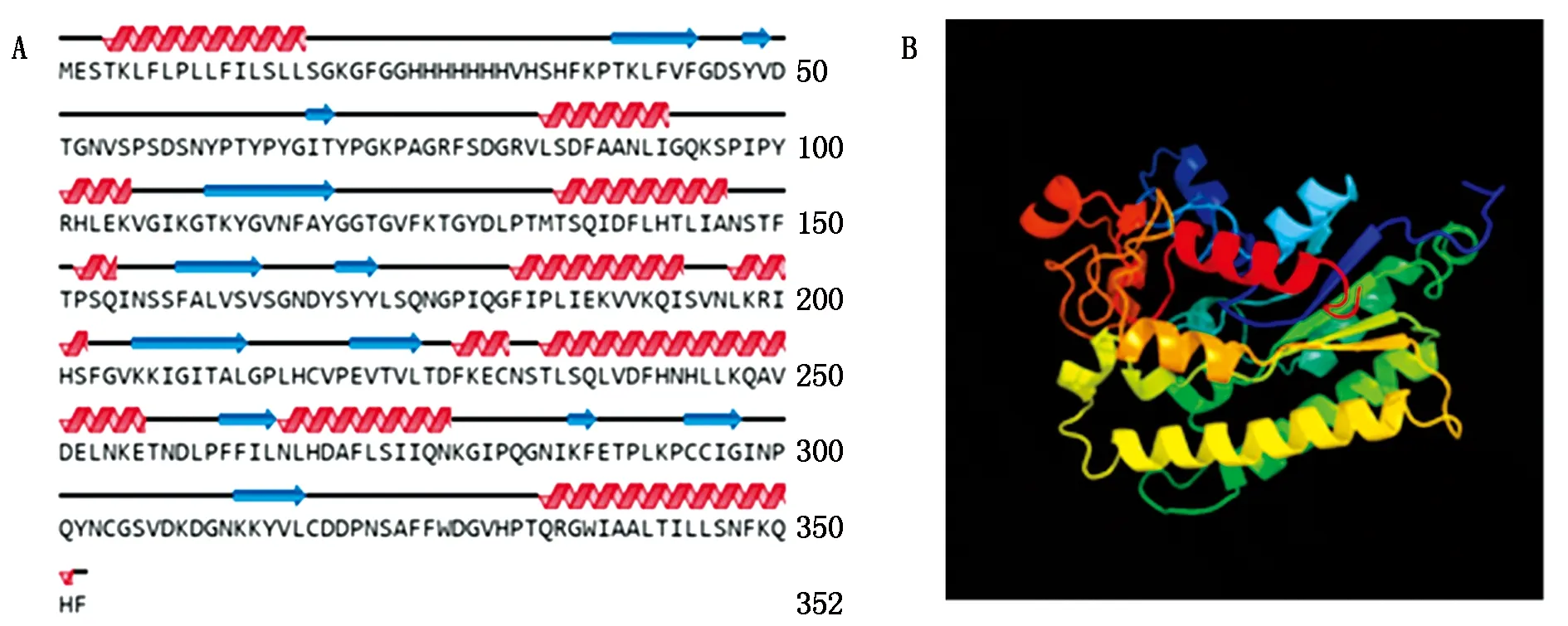
A.CsGDSL二級結構預測:卷曲;B.CsGDSL三級結構預測。
2.2 黃瓜CsGDSL基因的生物信息學分析
CsGDSL編碼的蛋白經protein Blast黃瓜中GDSL蛋白與甜瓜(XP 008462554.1)、冬瓜(XP 03883064.1)、南瓜(XP_023544735.1、KAG7034511.1、XP_022925945.1、XP_022979129.1)等變種同源性超過88%(圖3-A),表明該基因在進化過程中較為保守,均包含GDSL脂解酶保守結構。通過NCBI數據庫Blast檢索CsGDSL在不同作物中的同源蛋白,從檢索結果中選取不同作物中的10個同源性較高的蛋白序列:甜瓜(Cucumismelo)、冬瓜(Benincasahispida)、灰籽南瓜(Cucurbitaargyrosperma)、中國南瓜(Cucurbitamoschata)、美洲南瓜(Cucurbitapepo)、印度南瓜(Cucurbitamaxima)、美洲櫟(Quercuslobata)、葡萄(Vitisvinifera)。利用MEGA 6.0軟件構建系統發育樹。結果表明,黃瓜CsGDSL與甜瓜CmGDSL蛋白關系最為緊密(圖3-B)。
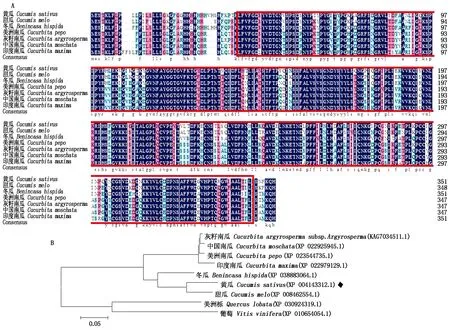
A.CsGDSL氨基酸序列同源比對;紅框中為保守結構域;B.CsGDSL進化發育樹分析。
2.3 黃瓜CsGDSL組織表達特異性分析
取莖、卷須、根、生長點開花當天的雄花、雌花以及0,3 d的子房的總RNA進行qRT-PCR分析,以明確CsGDSL在黃瓜不同組織部位中的表達情況。試驗結果表明,CsGDSL在黃瓜各組織部為中均有表達,CsGDSL在開花當天的雄花中表達量最高,雌花次之,0 d的子房中表達量最低。同時,CsGDSL在開花3 d后子房中的表達量顯著高于開花當天的子房,該結果表明CsGDSL在黃瓜生長發育過程中起著重要作用(圖4)。
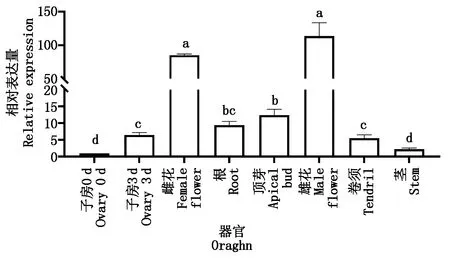
不同小寫字母表示處理時間之間在0.05水平存在顯著差異。
2.4 CsGDSL在不同黃瓜品種中保守性分析
選取6種光澤性不同的黃瓜,分別對CsGDSL基因CDS進行克隆,對其序列進行分析表明,在不同品種中,CsGDSL基因序列并未發生變化,表明在不同光澤性的品種中該基因功能高度保守(圖5)。
黃瓜表皮光澤并不受CsGDSL基因編碼區所影響,推測光澤性可能由CsGDSL基因啟動子調控。
2.5 CsGDSL啟動子元件分析
為進一步明確CsGDSL基因功能,以黃瓜649 DNA為模板進行PCR擴增,獲得CsGDSL啟動子長度為1 975 bp(圖6)。對其進行分析表明,該基因啟動子中鑒定出29個元件(表2)。其中包括,ARE、MBS及TC-rich repeats等與厭氧、干旱、防御和脅迫等逆境相關的響應元件;ABRE參與脫落酸反應的激素相關元件;Box4、CAG-motif、G-Box、GT1-motif、TCT-motif等與光反應相關的元件。基于此預測結果,推測CsGDSL與逆境脅迫、激素及光等具有響應。
圖 5 6個品種中CsGDSL核苷酸序列分析

M.DM 2000 DNA Marker;1.目的片段。

表2 CsGDSL啟動子調控元件分析
3 結論與討論
GDSL基因不僅能夠影響植物表皮角質層的結構,還有研究表明,GDSL對于植物育性也有著一定的影響[25-26]。玉米細胞核雄性不育基因ZmMs30(MALESTERILITY30)編碼GDSL脂解酶,當ZmMs30功能喪失,導致花藥角質層缺陷、花粉外壁的不規則甚至完全雄性不育[27];玉米ZmIPE2(IRREGULARPOLLENEXINE2)基因同樣編碼GDSL脂解酶,IPE2功能障礙導致絨氈層和中層延遲變性,導致花藥表皮和花粉外壁形成缺陷,完全雄性不育,同時脂肪代謝發生很大變化,脂質成分C16/C18脂肪酸及其衍生物的含量在ipe2發育的花藥中顯著降低[28]。因而,GDSL基因在花藥及花粉發育中具有一定功能。本研究中CsGDSL在黃瓜開花當天的雄花、雌花中的表達量顯著高于莖、子房、根、卷須、子房等其他部位,可能是由于在這一發育時期,基因主要作用于花器官的發育。并且,CsGDSL基因在花后3 d的子房表達含量高于開花當天,推測可能隨著黃瓜果實的發育成熟,CsGDSL基因表達量逐步上調,進而參與黃瓜果實角質層的形成過程。
角質層因作為植物的疏水屏障,在植物抗逆性上也起著一定的作用。本研究中,對黃瓜CsGDSL啟動子功能進行了初步預測,其具有與厭氧、干旱、防御和脅迫等逆境相關的響應元件。目前,已有研究表明,角質層發育對厭氧、干旱等脅迫起著顯著作用,在大豆中GDSL 型酯酶/脂肪酶蛋白GmGELP28(GDSL-type esterase/lipase proteins 28) 對干旱、鹽分和ABA處理的明顯,轉基因擬南芥和大豆植株表現出耐旱耐鹽表型[29];水楊酸、乙烯和茉莉酸甲酯處理誘導辣椒葉中GDSL型脂解酶CaGLIP1(GDSL-type lipase)基因表達,并且在種子萌發和植物生長過程中,CaGLIP1轉基因植物表現出耐旱性[30],但CsGDSL是否通過影響角質層的發育,進而影響黃瓜抗逆性還有待進一步研究。
綜上所述,本研究參考黃瓜基因組數據庫,通過基因克隆、生物信息學分析及qRT-PCR技術,獲得了CsGDSL基因,明確了CsGDSL在黃瓜各組織部位中表達模式,為研究CsGDSL對于黃瓜果皮角質層發育及光澤性的影響奠定了基礎。

