右美托咪定對全弓置換術患者腦缺血損傷的保護作用
吳樹彪,信文啟,袁峰
(1.鄭州大學第二附屬醫院 麻醉科,河南 鄭州 450014;2.河南大學淮河醫院 麻醉科,河南 開封 475099)
主動脈夾層是指由于各種原因導致的主動脈內膜、中膜撕裂、分離,血液不斷沖擊、流入致使主動脈腔被分割形成真假兩腔,血液在真假兩腔之間流動或形成血栓[1]。我國主動脈夾層患者平均年齡為51歲,其中Stanford A型主動脈夾層約占40%,男性占76%[2]。Stanford A型主動脈夾層主要采取主動脈全弓置換術加象鼻支架植入術的手術方式,此方式常需在全身麻醉深低溫停循環選擇性腦灌注技術輔助下實施,腦組織缺血缺氧容易導致神經系統并發癥的明顯升高。有研究依據腦損傷生化標志物指標,證實右美托咪定(dexmedetomidine,DEX)在全弓置換術中能夠降低腦攝氧率,抑制炎癥反應[3],本研究擬采用腦損傷生化標志物結合頭顱核磁共振的方法探討DEX定對全弓置換術患者腦缺血損傷有無保護作用。
1 對象與方法
1.1 研究對象
選擇2021年7月至2022年9月因急性主動脈夾層在鄭州大學第二附屬醫院實施全弓置換術患者38例,經醫院醫學倫理委員會備案并審核通過,所有患者或其家屬簽署知情同意書。按照隨機數字表法分為DEX組(D組)和對照組(C組),每組19例。患者ASA分級Ⅲ~Ⅳ級,年齡33~68歲,體重指數19~24 kg·m-2,心功能Ⅲ~Ⅳ級。未合并嚴重肝腎功能不全,無房室傳導阻滯及心動過緩,未服用單胺氧化酶藥物史,無糖尿病以及神經系統疾病(腦出血、腦缺血發作、腦梗死、腦腫瘤、腦外傷等)病史。
1.2 研究方法
1.2.1資料收集
所有患者入手術室前30 min肌內注射嗎啡0.1 mg·kg-1、東莨菪堿0.4 mg。入室后開放靜脈通路,持續低流量面罩吸氧,監測心電圖、血氧飽和度、心率。局麻下行雙上肢橈動脈、左足背動脈穿刺置管后連續監測有創血壓,局麻下行右頸內靜脈穿刺置入三腔靜脈導管連續監測中心靜脈壓并用于術中輸血輸液泵注血管活性藥。麻醉誘導前D組靜脈輸注DEX(江蘇恩華藥業股份有限公司,國藥準字H20110085)1 μg·kg-1,輸注時間15 min。C組患者輸注等量生理鹽水,輸注時間15 min。輸注完成后D組立即以0.5 μg·kg-1·h-1的速率輸注DEX至手術結束即刻,對照組患者接受等量和等速度的生理鹽水持續泵注。
兩組患者麻醉誘導期間用藥相同:枸櫞酸舒芬太尼(宜昌人福藥業有限責任公司,國藥準字H20054171)1 μg·kg-1,咪唑安定(江蘇恩華藥業股份有限公司,國藥準字H19990027)0.03 mg·kg-1,順苯磺酸阿曲庫銨(江蘇恒瑞醫藥股份有限公司,國藥準字H20183042)0.3 mg·kg-1,依托咪酯(江蘇恩華藥業股份有限公司,國藥準字H20020511)0.3 mg·kg-1,氣管插管成功后連接麻醉機,維持腦電雙頻指數(bispectral index,BIS)值40~50、PETCO235~45 mmHg。
麻醉維持:兩組患者術中以丙泊酚(江蘇盈科生物制藥有限公司,國藥準字H20203504)、七氟烷(江蘇恒瑞醫藥股份有限公司,國藥準字H20070172)、順苯磺酸阿曲庫銨維持,間斷靜脈推注枸櫞酸舒芬太尼。術中根據血流動力學波動給予不同的血管活性藥,依據動脈血氣分析中血糖的情況考慮是否應用胰島素。
兩組患者均在深低溫停循環下應用Bentall、全弓置換、象鼻支架術的手術方式。待手術完成、循環穩定后停止CPB。
1.2.2指標監測
分別記錄T0(入室后)、T1(誘導后)、T2(深低溫停循環后)、T3(停CPB后)、T4(手術結束即刻)時刻的局部腦氧飽和度(local cerebral oxygen saturation,rSO2);分別于T0、T1、T2、T3、T4、T5(術后24 h)和T6(術后72 h)抽取頸內靜脈血5 mL,ELISA法檢測腫瘤壞死因子α(tumor necrosis factor alpha,TNF-ɑ)、白介素-6(interleukin-6,IL-6)、金屬基質蛋白酶-9(metallomatrix proteinase-9,MMP-9)和膠質纖維酸性蛋白(glial fibrillary acid protein,GFAP)水平,黃嘌呤氧化酶法測定血清超氧化物歧化酶(superoxide dismutase,SOD)活性,硫代巴比妥酸法檢測丙二醛(malondialdehyde,MDA)含量。術后72 h內均行頭顱核磁共振(magnetic resonance imaging,MRI)成像,獲取T1W、T2W、磁共振彌散加權成像(diffusion-weighted imaging,DWI)圖像。對于每個DWI水平,從小腦、基底節區、枕葉和頂葉4個切片計算表觀擴散系數(apparent diffusion coefficient,ADC)值。
1.3 統計學處理
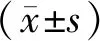
2 結果
2.1 一般資料
兩組性別、年齡、體重、ASA分級、心功能分級、體外循環時間及手術時間比較,差異無統計學意義(P>0.05)。見表1。

表1 兩組患者一般情況比較
2.2 rSO2
與T0時比較,兩組患者在T1和T4時雙側rSO2差異無統計學意義(P>0.05)。與T0時比較,兩組患者在T2和T3雙側rSO2均下降(P<0.05)。在T2和T3時,D組雙側rSO2均高于C組(P<0.05)。見表2。
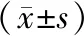
表2 兩組患者rSO2的比較
2.3 TNF-ɑ、IL-6、MMP-9、GFAP、SOD和MDA水平的比較
與T0時比較,兩組患者在T2、T3、T4和T5時的TNF-ɑ和IL-6水平升高(P<0.05)。在T2、T3、T4和T5時,D組TNF-ɑ和IL-6水平均低于C組(P<0.05)。與T0時比較,兩組患者在T2、T3、T4和T5時的MMP-9和GFAP水平升高(P<0.05)。在T2、T3、T4和T5時,D組MMP-水平均低于C組(P<0.05)。在T3、T4和T5時,D組GFAP水平低于C組(P<0.05)。與T0時比較,兩組患者在T2、T3和T4時的SOD水平下降,在T5和T6時SOD水平升高(P<0.05)。在T2、T3、T4、T5和T6時,D組SOD水平均高于C組(P<0.05)。與T0時比較,兩組患者在T2、T3和T4時的MDA水平升高,在T5和T6時MDA水平降低(P<0.05)。在T2、T3、T4、T5和T6時,D組MDA水平均低于C組(P<0.05)。見表3。
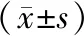
表3 兩組患者TNF-ɑ、IL-6、MMP-9、GFAP、SOD和MDA水平的比較
2.4 腦各平面DWI檢測及ADC水平
D組基底節區ADC值高于C組(P=0.005),其余4個部位ADC值差異無統計學意義(P>0.05)。見表4。

表4 兩組患者ADC值的比較
3 討論
Stanford A型主動脈夾層所實施的“Bentall+全弓置換術”常在深低溫停循環下進行,體溫過低或停循環時間過長均會導致腦組織缺血缺氧性損傷,術后復溫和恢復灌注的過程中會進一步加重這種腦損傷。DEX是安全有效的α2腎上腺素能受體激動劑,臨床可產生鎮靜、鎮痛、抗炎、抗焦慮、抗交感等作用,對于患者的腦保護作用具有積極的意義[4]。本研究擬采用TNF-α和IL-6、MMP-9、GFAP、SOD、MDA等指標結合DWI結果的方法探討DEX對全弓置換術患者腦缺血損傷是否有保護作用,以便為臨床應用提供參考。
近紅外光譜是近年來在麻醉圍手術期具有無創性、連續性監測的一種新技術,能夠快速、簡單地反映腦氧供需失衡,尤其在主動脈夾層等直接影響腦灌注的手術中有重要的價值和作用[5]。有研究證實,圍手術期rSO2監測可明顯降低體外循環下心臟外科手術術后神經系統的并發癥[6]。Fischer等[7]觀察了30例主動脈夾層手術患者的術中rSO2變化,發現當rSO2數值小于55%、60%、65%的時間越長,發生神經系統并發癥如腦梗死的概率越高,術后機械通氣時間、ICU停留時間、住院時間越長。本研究結果顯示,兩組患者雙側rSO2在T2、T3時低于T0時,雙側rSO2在低溫停循環期間至體外循環結束后逐漸趨向平穩,但較術前基礎值仍然偏低,可能與手術應激所致的炎癥反應、氧化應激反應及血紅蛋白濃度降低、紅細胞壓積水平偏低有關。T2、T3時,D組雙側rSO2均高于C組,可能與DEX能夠改善低溫停循環期間的腦供需失衡有關。
急性炎癥刺激導致的腦損傷的早期診斷非常困難,本研究通過腦損傷的生化標志物和頭顱MRI對腦損傷進行評估。在所有促炎細胞因子中,介導免疫反應的TNF-α被認為是全身炎癥反應的起始介質。TNF-α通過直接作用于長期增強和突觸可塑性,對神經退行性變也有主要作用。IL-6在發生缺血性腦損傷時可持續高水平表達,發揮神經保護與修復等生理功能[8]。因此,本研究探討了與腦損傷相關的促炎因子TNF-α和抗炎因子IL-6的變化,發現兩組患者T2、T3、T4及T5時TNF-ɑ和IL-6較T0時高,差異有統計學意義,可能是手術刺激及體外循環過程中的低灌注壓和低體溫等促進了機體促炎因子的釋放,機體發生了炎癥反應。而T2、T3、T4及T5時,D組TNF-ɑ和IL-6水平卻低于C組,說明應用DEX可以減少術后炎癥因子的釋放。其機制可能是DEX通過抑制NF-κB和Toll樣受體4信使,從而抑制相關炎癥細胞因子TNF-α、IL-6的合成[9]。
MMP-9是一種可誘導的基質金屬蛋白酶,在神經炎癥過程開始前處于非活性狀態。在各種類型的腦損傷后,MMP-9被觀察到增加[10]。此外,腦缺血后血漿MMP-9水平與自由基產生密切相關。GFAP是一種只存在于中樞神經系統膠質細胞中的腦特異性中間絲蛋白,在一些研究中,血清GFAP水平對腦損傷或腦卒中的診斷及預后有重要價值[11]。一些研究也證實,與其他生物標志物(如S100β和神經元特異性烯醇化酶)相比,GFAP對腦損傷具有高特異性。Xin等[12]報道:與對照組相比,DEX可緩解老年輕度認知障礙患者術后譫妄,降低TNF-α、MMP-9和GFAP水平。基于這些原因,本研究將這兩種生化指標作為腦損傷的主要指標。結果顯示,CPB開始后血清MMP-9和GFAP水平升高,提示大腦可能有一定程度的損傷,其原因可能是腦微栓塞、低灌注、全身炎癥反應等多種因素導致的腦循環紊亂。而在CPB停機后D組GFAP和MMP-9水平較C組低,因此,推斷D組在心臟手術中麻醉可減輕腦損傷,這也與之前的研究一致。可見DEX圍手術期可在一定程度上抑制神經炎癥反應,改善全弓置換術患者血腦屏障的通透性,減輕了腦損傷。
主動脈全弓置換術時因深低溫停循環導致心肌缺血再灌注,發生胞膜過氧化、蛋白質變性、線粒體功能障礙等一系列變化,從而產生大量自由基[13]。SOD和MDA是用于評估消除細胞中氧自由基能力的2個常用指標[14]。Han等[15]發現,DEX能夠抑制過量的氮氧化物衍生的ROS,調整MDA和SOD的失衡水平,減輕細胞的氧化應激反應,從而產生保護作用。本研究結果顯示,T2、T3、T4、T5及T6時,D組SOD較C組高,D組MDA較C組低,差異有統計學意義,與上述研究結果是一致的。
DWI是一種基于回波平面成像技術反映水分子擴散運動的新興神經成像技術[16]。DWI已多次被證明是識別急性缺血最敏感的技術,比常規磁共振檢測更早發現病變[17]。因為它能夠檢測到大腦中細胞外與細胞內水分含量之比的快速變化。當組織缺血缺氧時,急性期的腦細胞缺氧發生能量代謝紊亂。鈉/鉀ATP酶受到抑制,導致鉀離子大量流出,鈣離子、氯離子和鈉離子大量涌入,這些離子積聚在細胞內引起細胞毒性水腫,導致ADC值應降低。Wang等[18]表明,在檢測豬術后早期神經變化方面,DWI優于T1WI或T2WI。根據DWI圖計算ADC值,不同腦平面的ADC值不同,進一步評估顯示,全腦、小腦、枕葉、頂葉等4個部位ADC值差異無統計學意義,但D組基底節區ADC值高于C組,說明DEX在腦缺血性損傷方面起到了一定的抑制作用,這與上述研究結果相一致。
當然,本研究也有一定的局限性。首先,樣本量少,可能需要更大的樣本量來更準確地回答關于腦損傷預防的問題;其次,未使用經食管超聲來確認左心排氣,因此不能完全避免腦血管氣栓塞及其對腦損傷的影響;再次,在研究過程中,給予固定量的DEX,令所有患者很難獲得理想的BIS值,因此所有這些問題都需要在未來進一步研究。
4 結論
DEX可改善腦氧代謝失衡,降低炎癥反應,減輕氧化應激,對體外循環下全弓置換術患者腦缺血損傷有一定的保護作用。

