FAERS 數據庫建設與應用啟示*
吳文宇,唐碧雨,吳建茹,魏芬芳,李麗敏,肖 霄
(廣東省深圳市藥物警戒和風險管理研究院,廣東 深圳 518024)
藥物警戒活動貫穿藥品的全生命周期,包括研發、生產、銷售、使用、監管等階段,上市后監測到的電子健康數據已成為藥品監管新模式的一個關鍵要素[1]。國外的藥品不良反應(ADR)自發呈報數據庫有世界衛生組織(WHO)個案安全性病例報告數據庫(VigiBase)、美國食品和藥物管理局(FDA)不良事件報告系統(FAERS)、歐洲藥品管理局不良反應數據庫(EudraVigilance)等[2]。本研究中分析了FAERS 數據庫的數據來源、建設結構、應用及優缺點,為我國藥物警戒相關工作提供參考。現報道如下。
1 數據庫管理機構
FDA藥物審評與研究中心(CDER)下設的監測與流行病學辦公室(OSE)在藥物的整個生命周期內使用各種工具和規則來監測和評估美國消費者所用藥物的安全性,同時負責所有上市藥品和治療性生物制品上市后的安全性監測,每年評價FDA 安全性信息和不良事件報告系統(MedWatch)不良事件報告超過200 萬份。其中,藥物警戒和流行病學辦公室(OPE)的安全評估人員和衛生官員負責檢測藥物安全信號及評估所有上市藥品和治療性生物制品的安全問題,通過各種監測工具(不良事件報告數據庫、已發表的科學文獻及產品的臨床前、臨床的藥物知識)提供科學和臨床方面的評價,從而為上市后產品的安全使用提出多種監管和溝通措施;流行病學部使用“哨點”系統進行主動監測,開展流行病學研究,并審查因上市后要求(PMRs)和上市后承諾要求(PMCs)制造商提供的藥物安全相關流行病學研究方案和研究報告。
2 FAERS 數據庫的發展
2.1 特點與適用性
美國的不良事件數據庫根據監測模式分為2種,一種是根據企業強制報告(95%)和MedWatch(5%)生成的FAERS 數據庫,一種是基于主動監測模式的分布式數據庫。
FAERS 數據庫涵蓋了美國所有上市后的藥品和治療性生物制品,涉及老人、兒童、孕婦和有其他合并疾病的患者,數據量較大且來源廣泛,包括美國以外的數據,適合發生率極低的不良事件的研究挖掘,以及突發事件發生時輔助藥物安全的研究。呂強等[3]利用FAERS 數據庫分析磷酸氯喹的安全性,結果表明,臨床長期使用磷酸氯喹可致嚴重ADR,應謹慎用于有心臟和神經系統基礎疾病的患者,著重關注磷酸氯喹用法用量及其心臟毒性。朱正怡等[4]利用FAERS 數據庫分析托珠單抗的不良事件,結果表明,托珠單抗常見報告為藥物無效、藥物不耐受、疼痛、疲勞、皮疹等,臨床應用時應重點關注肺纖維化、間質性肺疾病、胰腺毒性、脫髓鞘病變等藥品說明書未提及的ADR。但FAERS 數據庫不適用于發生率較高的不良事件的挖掘研究,也不能排除原有疾病及其惡化對不良事件的影響。同時,由于其數據來源的特殊性,也無法計算發生率,無法進行同一類藥物間藥效及ADR嚴重程度的比較等。
2.2 發展歷程
FAERS 數據庫的發展歷經2 個階段。第一階段,稱作Adverse Event Reporting System(AERS),包括1968 年至2012 年第3 季度的數據。20 世紀60 年代“反應停”事件后,許多國家引入了藥物警戒(phamacovigilance)系統對上市后藥品進行監測。FDA 藥物不良事件報告系統(AERS)數據庫主要用于發現在臨床試驗階段由于出現頻次低而未被識別的罕見嚴重不良事件,或新的不良事件,即安全性信號[5]。第二階段,更名為FAERS,并于2012 年9 月10 日起開始運行。FAERS 是FDA 用于發現上市后產品相關的新安全問題等的工具,如發現產品潛在安全問題,則使用其他大型數據庫(如“哨點”系統數據庫)進行進一步評估。
3 FAERS 數據庫的應用
3.1 數據庫在線查詢方法
FAERS公眾數據面板(FAERS Public Dashboard)是一種基于網絡的高度交互式的工具,允許以用戶友好的方式查詢FAERS 的數據,并以可視化的形式呈現,亦可下載。該工具的目的是擴大公眾對FAERS 數據的訪問,以搜索與制藥行業、醫療保健提供者和消費者向FDA報告的人類不良事件相關的信息。公眾數據面板的檢索結果包括懷疑藥物、合并用藥、不良事件名稱、不良事件是否嚴重、患者年齡和性別、報告來源6個字段,但藥物用量、患者病史和不良事件描述字段無法獲取[6]。獲取的檢索結果可按報告類別、上報人、上報地區、報告是否嚴重、年齡分組和性別分別進行可視化展示。
此外,檢索頁面還可按產品名稱(通用名、商品名和品牌名)和不良事件名稱檢索,每種檢索方式最多可添加5 個檢索條件,可按FDA 報告接收年份、所選不良事件名稱、產品名稱(通用名、商品名和品牌名)、年齡分組、性別、上報人分類。在“Listing of Cases”中可根據左側字段對檢索結果進行篩選預覽或導出,但在線預覽檢索或導出數據量均不可超出100 000 條,否則不可預覽或導出。
公眾數據面板向社會開放FAERS 數據,在推動藥物警戒工作發展和相關概念普及公眾的同時,也對患者的依從性產生了影響。開放的不良事件數據可能會導致概率忽略現象發生,即一個人關注結果的嚴重性而不是結果的可能性,在看到嚴重不良事件和死亡報告后,患者可能會決定不服藥,或嘗試用非藥物治療或草藥和膳食補充劑來替代藥物[6],對醫護人員的患者教育工作提出了挑戰。
3.2 數據庫結構、使用和常用風險信號檢測方法
FAERS 數據庫為季度數據壓縮文件,其中包括季度數據和說明文件,數據格式分為純文本格式(XML)和美國信息交換標準代碼(ASCII)編碼的文本格式,每種格式均分成7 個.txt 文件,分別是患者的人口統計學信息及管理信息(DEMOyyQq,其中,“yy”為年份,“Q”為季度英文單詞的首字母Q,“q”為該年第幾個季度,如DEMO19Q3),藥品/ 生物制品信息(DRUGyyQq),不良事件/ 用藥錯誤信息[REACyyQq,國際醫學用語詞典(MedDRA)編碼],不良事件轉歸(OUTCyyQq),報告來源(RPSRyyQq),藥品/ 生物制品開始使用和結束使用時間(THERyyQq),藥品/生物制品的適應證(可理解為原患疾病,INDIyyQq/MedDRA 編碼)。
FAERS 季度數據的完整應用包括數據清洗和風險信號檢測兩部分。數據清洗需使用關系型數據庫和標準化工具,具體步驟:1)應用關系型數據庫(如MySQL)和藥品名稱標準化工具MedEx[7]對數據進行置重和標準化,將所有季度的人口統計學信息及管理信息(即所有季度的DEMO)文件合并后根據文件中字段CaseID和CaseVersion置重,即提取每個案例的最新信息作為待處理數據;2)根據字段PrimaryID和藥品/生物制品信息(即DRUG)文件映射,映射完畢后用MedEx進行藥品名稱標準化(因為有部分季度數據是公眾通過MedWatch上報的,藥品名稱不規范),用標準化后得到的數據和其他5 個文件通過PrimaryID 映射;3)應用關系型數據庫和MedDRA 對第一步獲得數據的原患疾病和不良事件/用藥錯誤信息進行漢化,根據MedDRA 最新中文版本和英文版本編碼將不良反應術語漢化,即可設定檢索條件,檢索研究目標有關數據,如需進一步提取更高級別的術語,可用MedDRA桌面瀏覽器選擇性導出數據。
FAERS 常用的風險信號檢測方法為多項伽馬-泊松分布縮減算法(MGPS)[8-9]。該算法基于比例失衡測量法四格表(表1),核心是對經驗貝葉斯幾何均數(EBGM)進行計算,計算公式為EBGM=a(a+b+c+d)/(a+b)(a+c)。MGPS 假設EBGM的期望值(E)中存在5 個服從伽嗎分布的超參數。故算出目標藥品-不良事件組合的EBGM值后,需進一步計算得到5 個超參數的極大似然估計,進而算出EBGM的先驗分布值。根據貝葉斯統計原理,綜合樣本中藥品-不良事件組合的信息與先驗分布信息,對EBGM進行進一步校正,獲得EBGM的最終值,當EB05(EBGM的95%置信區間下限)≥2時,提示ADR信號[8]。MGPS屬貝葉斯類算法,能在小數值的情況下進行ADR 信號挖掘,可對年齡、性別等人群特征混雜因素進行單一分層處理,但無法同時對多個人群特征因素進行分層管理,易產生“信號泄露”的現象[8]。
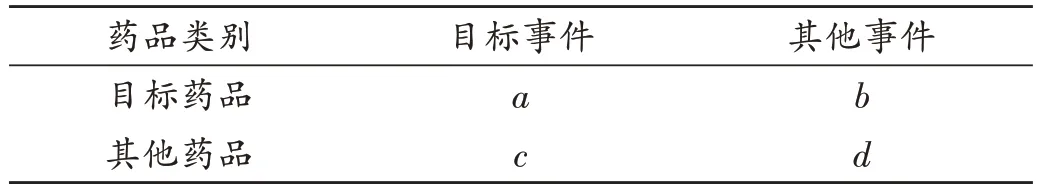
表1 藥品-事件比例失衡測量法四格表Tab.1 Drug-events fourfold table by proportional imbalance method
4 啟示
4.1 強化藥品上市許可持有人(MAH)藥物警戒主體責任
2019 年新修訂的《藥品管理法》制定了MAH 上報疑似ADR的法律責任,2021年發布的《藥物警戒質量管理規范》更詳細地規定了MAH 進行藥物警戒活動所需的人機料法環因素和相關風險評估控制措施。從數據來源看,FAERS 數據庫中不良事件報告的來源主要為藥品生產企業,極大地體現了藥品生產企業在藥品不良事件監測中的主體責任。由于我國大多數企業的藥物警戒體系建設還處于初級階段,所報告的ADR存在專業術語不規范、信息缺失、數據的可溯源性差等問題[10]。以2020 年FAERS 上報數據為例,共收到221.8 萬份報告,其中MAH上報數據占96.46%,醫療保健人員和消費者上報數據占3.54%。我國2020 年全國ADR 監測網絡收到ADR 報告167.6 萬份,其中醫療機構來源占85.4%,經營企業來源占10.6%,MAH 來源占3.9%,個人及其他來源占0.1%。與《國家藥品監督管理局關于藥品上市許可持有人直接報告不良反應事宜的公告(2018 年第66 號)》中MAH 不良反應報告主體責任不符。因此,我國藥品生產企業應盡快強化企業藥品安全的主體責任,提高企業不良事件報告數量和質量。
建議:1)可結合國家藥物警戒相關文件和法律責任,提高企業參與培訓的人數及培訓內容的深度,使藥物警戒不再是掌握在少數人手里的“冷知識”;2)增加對企業藥物警戒相關活動的飛行檢查頻率,以督促企業完善自身的基本藥物警戒體系,為藥物警戒工作的開展奠定基礎;3)根據國內外文獻研究和專家建議,結合企業自身的品種生產、銷售情況,科學、合理制訂不良事件上報指標及風險控制措施,每年定期組織專家進行評價,根據評價結果開展后續培訓。
4.2 強化藥店藥物警戒相關能力
隨著社會經濟的進步和人民群眾對健康要求的提高,連鎖藥店和單體藥店急劇增多。以深圳市為例,截至2021 年,連鎖/ 單體藥店已達6 798 家。隨著自我藥療的迅速發展,藥店從業人員成為居民自我藥療的引導者。李迎春等[11]的一項問卷調查分析結果顯示,93.67%的零售藥店配備了1~2 名執業藥師,藥店從業人員的學歷以大學專科為主(46.59%),專業知識相對薄弱,非常了解藥學專業知識的僅占30%。連鎖藥店作為營利性機構,其藥物警戒工作多僅涉及不良事件上報,據2020 年ADR 監測年度報告數據顯示,MAH 和經營企業不良事件上報僅占14.5%。
建議:1)提高藥店從業人員準入標準,將藥械不良事件上報作為考核標準,定期組織藥物警戒培訓;2)提高藥物警戒在執業藥師年度繼續教育工作內容中的占比;3)政府可給予藥店扶持,促進藥店開展社區宣傳工作,激勵藥店積極收集自我藥療人群不良事件。
4.3 開展公眾不良事件上報工作
我國每年的ADR 監測年度報告中個人上報僅占小部分,可能與公眾對藥物安全缺乏正確認知和我國目前尚未建立成熟的公眾上報平臺有關。魏芬芳等[12]對公眾藥品安全認知度和滿意度的現狀調查表明,被調查者對藥品安全知識的認知程度存在差異,青少年和老年人藥品安全認知不足,多數被調查者對藥品質量問題的投訴渠道和程序及對藥品監管和違法處罰方面的知識缺乏,對ADR缺乏正確認知,尚需加強相關宣傳和教育。目前,我國藥物不良事件系統權限僅對MAH、醫療機構和監管機構開放,暫未對消費者開放。作為藥品使用環節的主體,公眾報告的重要性不容忽視[13]。但開展公眾報告的前提是公眾對藥物安全和不良事件報告有一定的基礎認知,且有簡便操作的端口填寫、上傳報告。
建議:1)增設公眾直接報告端口,擴大不良事件報告收集來源,提高全民安全用藥意識。各級ADR 監測機構從戰略層面到實施層面、從概念到行為、從面到點地向公眾普及藥物安全、藥品不良事件上報知識等,提高全民安全用藥素養;將國家藥品不良事件數據去掉身份信息等敏感數據后逐步向公眾開放,以真實數據幫助公眾提高對藥物的認識能力。2)開發公眾上報端口。可直接與中國藥品電子監管碼相連,掃碼自動錄入藥品批號、批準文號、生產廠家等信息,只需上報人填寫藥品使用時間/劑量、不良事件發生時間、具體表現及就診信息,后臺自動生成結構化表格上傳對應醫療機構藥學部門或藥店,由專業人員將相關術語標準化后再上傳,并根據不良事件內容進行回訪,既可保障患者的健康,又可提高上報人的積極性,促進醫患溝通。

