原位固化抑制鋰硫電池中可溶性多硫化物的研究
李 浩
(商丘職業技術學院交通學院,河南商丘 476005)
隨著科技的快速發展,人們對高儲能技術的需求一直在穩步增長[1]。鋰硫(Li-S)電池以其突出的優越性,包括高理論比能量(2 600 Wh/kg)、低成本、高儲量和環境效益成為下一代儲能系統最有前途的候選電池之一[2-3]。然而,硫正極存在一些問題,包括硫單質(S8)及其最終放電產物硫化鋰(Li2S)導電性差,中間體多硫化物(LiPSs)在電解質中的溶解和擴散,以及硫正極在循環過程中高達70%的體積變化[4],導致容量快速衰減、庫侖效率和實際能量密度變低,阻礙Li-S 電池的商業化應用[5]。其中,多硫化物在電解質中的溶解一直是鋰硫電池進一步應用的一個難題[6]。一方面,可溶性多硫化物的形成被認為是容量衰減和庫侖效率低的主要原因。由于從正極到負極的濃度梯度力,使多硫化物聚集在鋰負極側,與鋰金屬直接反應并引起“穿梭效應”[7],導致充電效率下降和不可逆活性物質的損失。另一方面,多硫化物的溶解有利于實現高活性材料利用率[8]。由于硫是電子絕緣體,因此S 和Li2S 之間的直接固-固轉變在動力學上太慢了。硫的還原只能發生在電子傳導相可用的地方。多硫化物的溶解保證了電極中剩余的硫持續暴露在導電材料和電解液中,從而提高了硫的利用率。因此,必須合理控制多硫化物的溶解,以實現高硫利用率和良好的循環穩定性。
通過設計復合材料來封裝硫物質已成為解決可溶性多硫化物問題的主流策略[9]。設計的硫正極不僅要將遷移的多硫化物包裹在正極內并阻止它們向負極擴散,還應該提供豐富的電子和離子傳導路徑以增強氧化還原反應動力學。多硫化物的溶解和擴散可以通過多孔基質的物理限制效應或極性表面的化學吸附效應來緩解。碳材料具有高電導率和可調孔結構,已被廣泛用于促進硫氧化還原反應,從而改善硫正極的電化學行為[10]。上述情況中,硫需要預先封裝在不具有電化學活性的主體材料中,導致非活性成分含量增加,從而降低電池的能量密度。此外,由于硫正極在循環過程中體積變化大,主體材料經常會發生不可逆的結構坍塌,導致正極性能嚴重下降。電解質作為多硫化物溶解、遷移和電化學轉化的介質,對其改性被認為是解決多硫化物相關問題的另一種有效方法。該方法在大規模工業應用中顯示出良好的前景。事實證明,使用具有高鋰鹽濃度的“鹽包液”電解質可有效降低多硫化鋰在電解質中的溶解度。如電解質中添加滲透碳納米顆粒作為分散的納米電極,提高溶解的多硫化物電化學利用,減輕多硫化物穿梭進而提高鋰硫電池的性能。氮摻雜碳點已被用作電解質添加劑,用于構建電化學可恢復的多硫化物保護層,在電極-電解質界面形成凝結層,抑制硫損失。
本文使用對二氯苯(PDCB)引發親核取代反應來有效阻斷多硫化物的溶解和遷移。生成的多硫化物被PDCB 共價固定,同時形成固體多硫聚合物,該材料是隨著LiPSs 的生成而不斷變化的,因此不會導致正極結構失效。此外,LiPSs-PDCB 復合物具有更低的帶隙,在動力學上促進氧化還原過程,顯著提高Li-S 電池的容量、倍率性能和循環穩定性。
1 實驗
1.1 電解液的制備
普通的鋰硫電解液是用溶解在DOL/DME(體積比1∶1)溶劑中的1 mol/L 雙三氟甲磺酰亞胺鋰(LiTFSI)和1%硝酸鋰(LiNO3)制備的。然后,分別在三個10 mL 鋰硫電解液的瓶中加入147 mg(1 mmol)、294 mg(1 mmol)和441 mg(1 mmol)的PDCB 粉末,制備成含有0.1、0.2 和0.3 mol/L PDCB 的鋰硫電池電解液。
1.2 固體聚硫化物的制備
稱取294 mg(1 mmol)PDCB 粉末,將其溶解在10 mL DME 溶劑中,得到0.2 mol/L PDCB 溶液。將摩爾比為5∶1 的S 和Li2S 在10 mL DME 溶劑中混勻,60 ℃下攪拌12 h,得到0.2 mol/L 的Li2S6溶液。固體聚硫化物是通過混合5 mL 的0.2 mol Li2S6溶液和5 mL 的0.2 mol PDCB 溶液,將混合溶液搖勻,靜置5 h。然后,將形成的固體離心,并用DME 離心洗滌5 次,隨后在60 ℃下真空干燥12 h。上述這些操作是在充滿氬氣的手套箱中進行的。
1.3 碳納米纖維@S 正極材料的制備
碳納米纖維(CNF)@S 采用熔融擴散法制備。0.3 g CNF和0.7 g S 在研缽中研磨30 min 使其混合均勻,然后裝入聚四氟乙烯小瓶中,并用密封圈進一步封口,將混合物在155 ℃下加熱12 h 并冷卻至室溫,得到CNF@S 活性材料。
1.4 材料表征
用日本電子JNM-ECZS 的X 射線光電子能譜(XPS)技術測定材料的結構。使用Shimadzu UV 2550 紫外光譜儀進行紫外可見吸收光譜分析。
1.5 電化學表征
80%(質量分數)的活性材料(CNF@S)、10%的導電添加劑(Super-P)和10%的粘結劑(PVDF)在NMP 中混勻制備漿料,刮涂在涂碳鋁箔上,干燥并切成直徑為12 mm 的電極片。電極中硫的面積質量負載約為1.5 mg/cm2。所有電池組裝都在充滿氬氣的手套箱中進行。電池使用Celgard 2400 隔膜,鋰箔作為負極。電解液為上述配置的四種,將30 μL 電解質添加到CR2032 型紐扣電池的隔膜兩側。這些電池在NEWAREBTS-5 V/5 mA 型充放電測試系統上進行測試,溫度為25 ℃,恒電流充放電循環設置在1.7~2.8 V 之間。
2 結果與討論
圖1 為原位固化的可視化反應圖。選擇Li2S6作為LiPSs的代表。Li2S6溶液為棕紅色,PDCB 溶液為無色。在含有PDCB 的溶液中加入Li2S6溶液,通過搖晃混合均勻后,靜置,Li2S6溶液褪色并生成黃色沉淀,表明兩種溶液發生了反應。

圖1 可視化反應圖
圖2 展示了紫外可見光光譜的結果。取原始Li2S6和PDCB-Li2S6瓶中的上清液作實驗樣品,分別稀釋至2 mmol/L,然后進行紫外可見光分析。在Li2S6光譜數據中,260 nm 處表現出一個明顯的信號峰。在等摩爾量PDCB 引入后,信號峰未藍移也未紅移,表明其位置沒有變化,即說明PDCB 在引入后沉積,并未存在上清液中。同時,260 nm 處的信號峰強度大大降低,可以忽略不計,說明Li2S6也實現了沉積。這兩個結果說明Li2S6和PDCB 發生了某種反應,形成不溶性沉積。
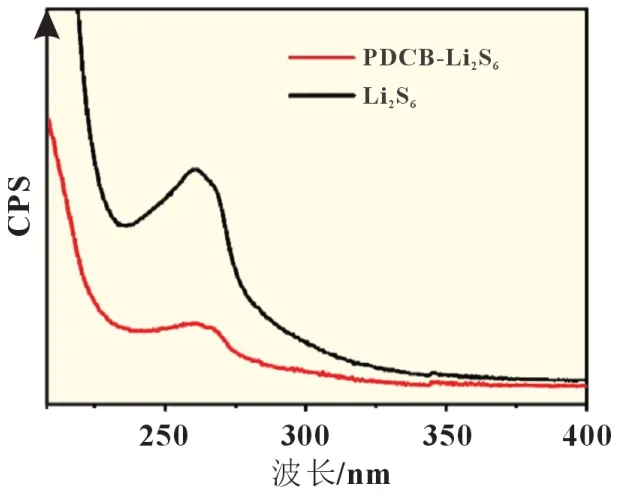
圖2 PDCB引入前后Li2S6溶液的紫外可見光光譜圖
圖3 所示為XPS 光譜。在圖3(a)中,結合能以286.4 eV 為中心,原始PDCB 的C 1s 光譜顯示了C-Cl 鍵的明顯信號。在圖3(b)中,固體聚硫化物的C 1s 光譜中C-Cl 鍵消失,取而代之的是在285.6 eV 的結合能下清楚觀察到的C-S 鍵信號。上述結果證明了在多硫化物和PDCB 之間的親核取代反應。因此,當LiPSs 形成時,在電池電解液中的PDCB 將捕獲并共價固定LiPSs 在有機硫結構中,進而實現液體LiPSs 的原位固化。這種方法有效地阻止了多硫化物向陽極的擴散。

圖3 PDCB和PDCB-Li2S6的XPS譜圖
進一步將CNF@S 作為正極組裝成紐扣電池,電解液為上述制備的四種,硫含量控制在1.5 mg/cm2左右。首先,考慮到液體多硫化物在提高活性材料利用率和氧化還原動力學方面的作用,在本策略中,并非所有多硫化物都轉化為固體有機硫,即添加到電解液中的PDCB 濃度低于基于親核取代的化學計量出的多硫化物和PDCB 之間反應的用量。圖4 所示為含有不同濃度PDCB 的電池循環性能。可以得出結論,當選用含有0.2 mol/L PDCB 的電解液時,電池在放電容量方面表現出最優的性能。具體來說,在氧化還原反應過程中最初產生的多硫化物被PDCB 固化,在硫電極表面形成固體攔截層,用于將隨后形成的多硫化物固位在正極內。通過這種方式,可以在不犧牲活性材料利用率和氧化還原反應動力學的情況下解決多硫化物的溶解和擴散問題,從而在硫利用率和容量保持之間取得良好的平衡。因此,以下部分的電化學測量中使用的均為PDCB 含量為0.2 mol/L 的電解液。
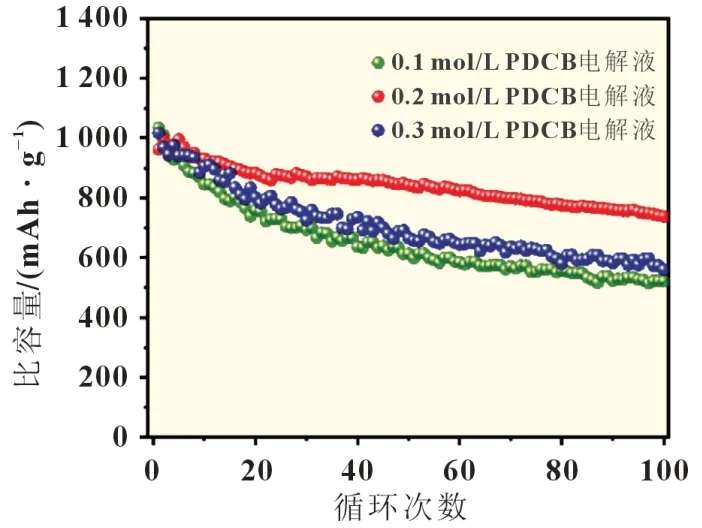
圖4 不同濃度的PDCB電池的0.2 C循環性能
圖5 顯示了穩定的長循環性能。含有PDCB 的鋰硫電池即使在1C下也能表現出781 mAh/g 的初始比容量,穩定循環超過130 次后仍具有690 mAh/g 的比容量,平均每次衰減率僅為0.09%,遠優于不含PDCB 的鋰硫電池0.32%的平均衰減率。而且,含有PDCB 電池的庫侖效率穩定在97%以上,該結果表明固化層的構建是實現穩定轉化鋰硫電池的關鍵。

圖5 含有和不含有PDCB電池的1 C長循環性能
循環伏安(CV)曲線用來描述電極在放電和充電過程中的電化學性能,出現的不同峰表示電極反應中包含多個相轉化。圖6 為含有和不含有PDCB 電池的循環伏安曲線,曲線為典型的鋰硫電池CV 曲線。位于高電位和低電位的兩個還原峰為S8向長鏈LiPSs 的轉變以及由長鏈再向短鏈的LiPSs轉換過程,隨著硫的還原逐步進行,最終產物為Li2S。在2.4 V 左右出現的氧化峰與Li2S 的分解有關。含有PDCB 電池的氧化還原峰大幅度正向移動,呈現出氧化還原反應過程中較小的極化,表明更快的反應動力學。

圖6 含有和不含有PDCB電池的循環伏安圖
圖7 為PDCB 引入前后的能級圖。為了進一步了解含有PDCB 電池的動力學進展的起源,對關于LiPSs 的代表Li2S6以及它的復合物PDCB-Li2S6單體進行了第一性原理計算。為了揭示分子的氧化還原性質,分析了最低未占分子軌道(LUMO)和最高被占分子軌道(HOMO)的能級。與含有相同硫原子的相應的Li2S6相比,PDCB-Li2S6單體提供了更高的HOMO 和更低的LUMO 能量,這表明在放電和充電過程中硫物質的氧化還原提高。值得注意的是,上述模擬只提供熱力學結果,而工作的Li-S 電池中PDCB-Li2S6和Li2S6處于動力學控制下,不同濃度和空間分布隨充放電深度而變化。然而,上述模擬結果為從根本上理解PDCB 改性過程對硫氧化還原反應的化學反應提供了可能性。

圖7 PDCB引入前后的能級圖
因此,含有PDCB 的電池必然具有優異的倍率性能。如圖8 所示,在電流由0.1C逐漸增加到2C的過程中,含有PDCB 的電池的平均放電比容量分別為1 216、1 050、880、788、682 mAh/g。電流密度立即恢復到0.1C時,含有PDCB電池的放電比容量變為1 051 mAh/g,不含有PDCB 電池的放電比容量僅剩601 mAh/g,表明PDCB 不僅成功地抑制了多硫化物的穿梭,還提高了多硫化物的轉化動力學。

圖8 含有和不含有PDCB電池的倍率性能圖
3 結論
面對鋰硫電池中難以解決的可溶性多硫化物問題,通過引入添加劑實現多硫化物的原位固化是可行的策略。本文通過引入PDCB 與多硫化物親核取代形成不溶性聚硫化物,附著在硫物質表面,抑制后續產生的多硫化物溶解。同時,PDCB-LiPSs 單體具有較低的能級,進而實現快速的氧化還原動力學。因此,引入PDCB 后的鋰硫電池具有更高的質量比容量、更低的極化、更好的循環性能和更好的倍率性能。本研究提供了一種新策略,通過將溶解的多硫化物轉化為固態聚硫化物來解決鋰硫電池中可溶性多硫化物的穿梭和轉化問題。

