膿毒癥誘導大鼠延髓內臟帶膽堿能神經元凋亡及其對系統性炎癥和行為學的影響
黃 偉,李紅兵,張 程
膿毒癥誘導的失控系統性炎癥與高死亡率密切相關[1],對膿毒癥誘導的系統性炎癥進行神經調控是近年的研究熱點。既往研究證實延髓內臟帶(medullary visceral zone,MVZ)參與應激反應,是重要的自主神經及免疫調節的整合中樞[2]。MVZ通過膽堿能抗炎通路(cholinergic anti-inflammatory pathway,CAP)釋放乙酰膽堿,作用于免疫細胞的α7煙堿型乙酰膽堿受體(α7 nicotinic acetylcholine receptor,α7nAChR),從而抑制系統性炎癥與免疫[3-4];GTS-21作為α7nAchRs特異性激動劑,可顯著抑制膿毒癥導致的系統性炎癥,同樣,MLA作為α7nAchRs特異性拮抗劑,可增強系統性炎癥反應,表明干預CAP對系統性炎癥具有明顯影響。已知膿毒癥能誘導MVZ等區域的神經炎癥并導致神經功能的異常[5-7]。另一方面,膿毒癥誘導的腦損傷可導致血腦屏障的破壞[8],促進GTS-21和MLA通過血腦屏障進入中樞。中樞神經元及小膠質細胞均能表達α7nAChRs[9],且激活小膠質細胞上的α7nAChRs能抑制中樞炎癥[10],干預CAP 對MVZ神經病理及神經功能的影響目前尚不清楚。此外,膿毒癥病人往往表現為精神萎靡、情緒低落、活動減少、呼吸異常等病態行為,與部分中樞的神經炎癥相關[11]。已知MVZ通過杏仁核及前腦等高級中樞參與調控膿毒癥病人的情緒與行為[12],抑制神經炎癥是治療膿毒癥抑郁癥的重要的策略[13]。干預CAP對膿毒癥病態行為的影響及其機制,需要進一步的探索。
1 材料與方法
1.1 實驗動物
無特定病原體(specific pathogen free,SPF)級Sprague Dawley(SD)大鼠64只,周齡6周,許可證號:SYXK(鄂)2018-0104;購自三峽大學實驗動物中心[出售許可證號:SCXK(鄂)2017-0012]。大鼠實驗干預嚴格按照實驗動物關愛和使用協定指南(IACUC)執行,并經過貴陽市第一人民醫院醫學倫理委員會批準(審批號:2019007)。
1.2 主要試劑
GTS-21,貨號:29834(dihydrochloride MCE);甲基牛扁亭(methyllycaconitine,MLA),貨號:HY-N2332A/CS-0021211 (MCE);熒光(FITC)標記羊抗兔IgG,武漢博斯特,貨號:BA1105;熒光(Cy3)標記羊抗小鼠IgG,武漢博斯特,貨號:BA1031;DAPI,武漢三鷹,貨號:C1002; CHAT,武漢博斯特,貨號:bs-2423R;TH,武漢博斯特,批號:BM4568;Caspase-3,武漢三鷹,貨號:66470-2-IG。
1.3 主要儀器
脫水機,型號:武漢俊杰JT-12J電腦生物組織脫水機;病理切片機,型號:德國Leica RM 2016輪轉式切片機;抗原修復用電陶爐,型號:SKG;顯微鏡,型號:奧林巴斯BX53型生物顯微鏡。
1.4 研究方法
1.4.1 動物及分組、處理方法
大鼠適應性喂養7 d后按照隨機數字表分為3組,并進行相應的干預。對照組8只:正常飼養,不做任何處理。假手術組8只:大鼠剖腹但不進行盲腸穿刺結扎法(cecum ligation and puncture,CLP)進行膿毒癥制備[14],并予哌拉西林(50 mg/kg)腹腔注射,每日3次,連續3 d。膿毒癥組48只,采用CLP制備膿毒癥模型,成功后隨機再分為3組,每組16只,哌拉西林使用同假手術組;模型組給予生理鹽水(1 mL/100 g)腹腔注射,每日3次,連續3d;GTS-21組以GTS-21(4 mg/kg[15])腹腔注射,每日1次,連續3 d進行干預;MLA組以MLA(4.8 mg/kg)[16-17]腹腔注射,每日1次,連續3 d進行干預。3 d后處死大鼠進行延髓的免疫熒光檢測。
1.4.2 大鼠行為學評分
采用膿毒癥嚴重程度評分(Murine Sepsis Score,MSS)進行評分[18],記錄大鼠外觀、意識水平、行為表現、對刺激的反應、睜眼反應、呼吸頻率、呼吸質量等分值。由3名實驗人員進行單獨評分,取平均值評價各組大鼠在造模后1、2、3 d的病情嚴重程度。
1.4.3 免疫熒光雙標檢測
采用灌注取腦的方式,制備大鼠延髓中尾段的石蠟包埋切片,分別用于標記 Caspase-3及膽堿乙酰轉移酶(choline acetyltransferase,CHAT)的一抗混合物中孵育24 h,然后將切片與熒光標記的二抗(Cy3,FITC標記的山羊抗兔IgG)中孵育4 h,最后將切片用帶有 DAPI 媒介對切片中所有細胞進行核染色,使用奧林巴斯 BX53 生物顯微鏡拍攝,用Image pro(ipp6.0)軟件分析每組3幅圖像,計算平均光密度。
1.5 統計學處理
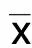
2 結 果
2.1 各組大鼠MSS評分比較
對照組MSS評分為0,膿毒癥模型組、GTS-21組及MLA組評分高于對照組,且MLA組評分高于GTS-21組(P<0.05),GTS-21組在第1天第2天評分低于模型組;同組大鼠評分差異無統計學意義。詳見圖1。
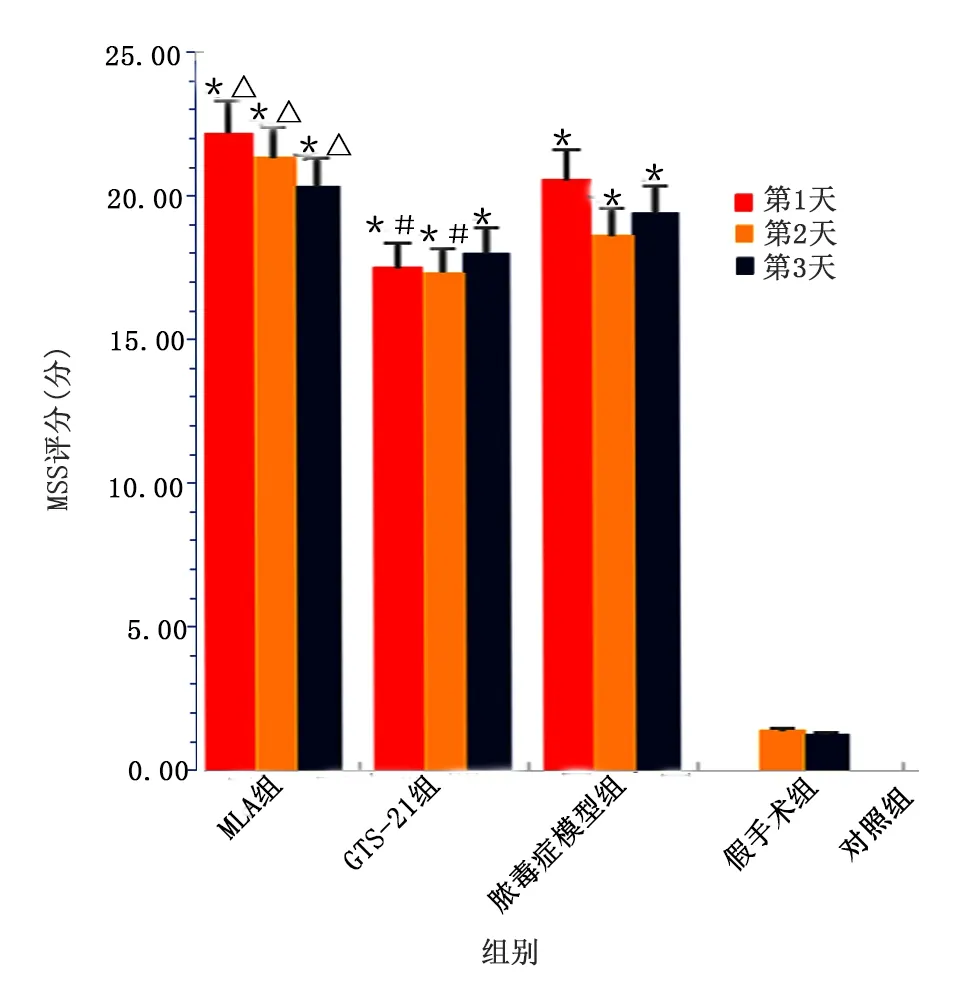
圖1 各組大鼠MSS評分比較
2.2 各組大鼠行為學分類評分比較
分類評分中,膿毒癥各組外觀、意識水平、行為表現、對刺激反應、睜眼反應、呼吸頻率、呼吸質量評分均高于對照組和假手術組(P<0.05),3組間分類評分差異無統計學意義(P>0.05)。詳見圖2。
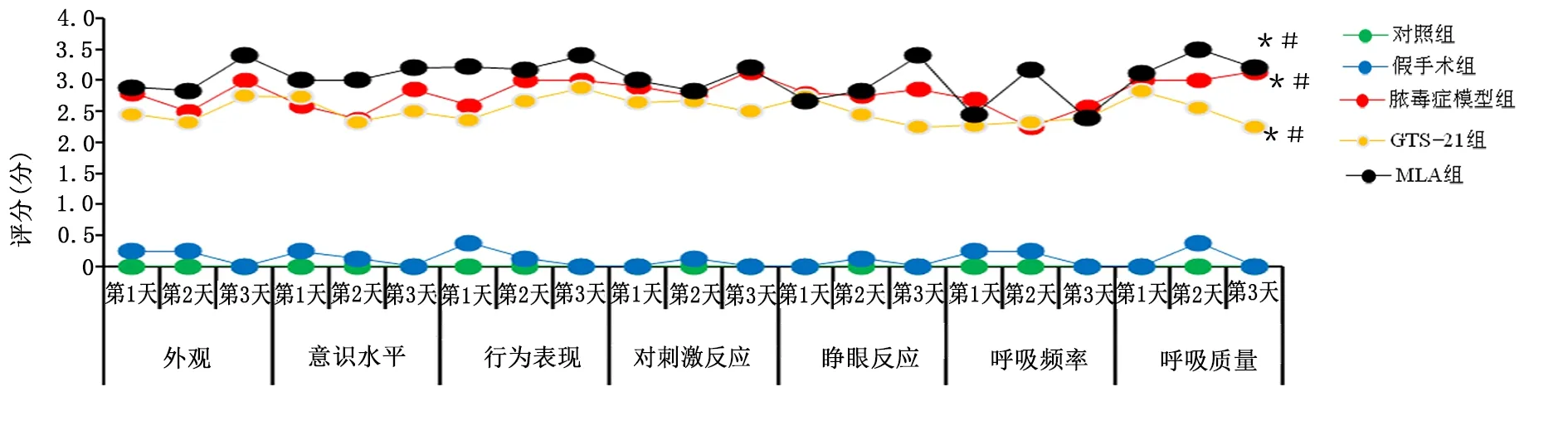
圖2 各組大鼠MSS分類評分散點圖(與對照組同時間比較,* P<0.05;與假手術組同時間比較,#P<0.05)
2.3 延髓中尾段膽堿能神經元的分布
免疫熒光可以看出膽堿能神經元主要集中在孤束核(solitary nucleus,NTS)、迷走神經背側運動核(dorsal vagus motor nucleus,DVMN)和腹外側網狀核(rostral ventrolateral medulla,RVLM)。詳見圖3。
2.4 各組大鼠MVZ中CHAT/Caspase-3免疫熒光雙標表達情況
與對照組比較,膿毒癥各組CHAT表達有降低的趨勢,與MLA組比較,GTS-21組有升高CHAT表達的趨勢;膿毒癥各組Caspase-3表達升高。提示炎癥可使膽堿能神經元凋亡,但對CHAT表達無明顯影響,惡化的炎癥可導致CHAT表達降低。詳見圖4。各組CHAT/Caspase-3 表達比較見圖5。
圖4 各組代表性的熒光雙標圖像及融合圖(200倍)
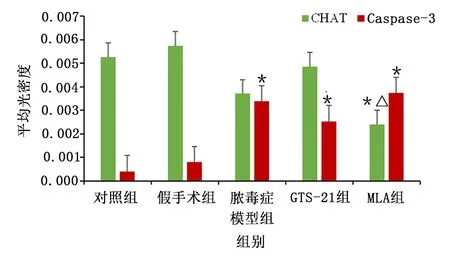
圖5 各組CHAT/Caspase-3 表達比較的柱狀圖
3 討 論
系統性炎癥及免疫的紊亂與異常行為學之間具有復雜的交互關系,如抑郁癥病人可表現出不同特征的免疫表型,抗抑郁藥具有抗炎作用,而抗炎藥物也顯示出抗抑郁作用[19]。此外,研究證實:系統性炎癥除導致血清細胞因子升高外,還導致延髓背側炎癥標志物升高,提示延髓膠質細胞的激活,并與較高的MSS評分有關[20-21]。表明膿毒癥誘發的炎癥風暴影響了大鼠行為學,MSS評分的升高可能與MVZ神經炎癥具有密切的關系。
MVZ中膽堿能神經元主要位于孤束核及迷走背側運動核,分別是迷走神經的傳入和傳出的初級中樞,感受并調節系統性炎癥強度。研究證實:外周迷走神經的刺激能抑制神經炎癥,促進神經功能的恢復[22]。經皮迷走神經刺激有效降低脂多糖誘導的血清TNF-α水平,同時促進MVZ的重要核團如孤束核和迷走神經背側運動核中CHAT表達,阻礙小膠質細胞的激活,改善認知功能[23],表明CAP的激活除可抑制系統性炎癥外,還可通過改善MVZ的病理和功能而增強認知功能。
膿毒癥可導致中樞促炎細胞因子的升高及小膠質細胞的激活[24],通過激活線粒體凋亡途徑,導致Caspase-3 表達增高和功能神經元的凋亡[25-26];研究證實:激活α7nAChRs可減少促炎性M1表型的小膠質細胞數量,增加抗炎M2表型的細胞數量[27]、減輕神經元的凋亡和腦組織損傷[28]。本研究中,模型組大鼠MVZ的膽堿能神經元明顯凋亡,但CHAT表達并未明顯減少,表明膽堿能神經元與神經環路具有一定的補償機制[29-30],從而在膿毒癥中維持對炎癥的穩定調節。GTS-21通過激活中樞α7nAChRs而抑制了神經炎癥,減少了膽堿能神經元的凋亡;MLA則相反。上述研究表明,膿毒癥導致MVZ膽堿能神經元凋亡,功能水平低下,并進一步導致 CAP對系統性炎癥的負向調控作用減弱,可能是系統性炎癥失控的中樞機制,干預CAP對MVZ神經炎癥和系統性炎癥具有重要的影響。
神經炎癥對行為學具有顯著影響[31]。膿毒癥呼吸功能損壞與延髓的早期炎癥反應有關,與脂多糖的濃度和損害時長具有一定的關系[32],無菌性炎癥誘導的嘆息樣呼吸與孤束核的星形膠質細胞的激活與IL-1表達增加有關[33]。作為低位中樞的MVZ神經炎癥對高級行為學的影響,可能在于:1)中樞膽堿能系統和杏仁核對于動機和記憶等行為具有重要的調節作用,腦干內膽堿能神經元的激活可導致中央外側杏仁核活動的短暫增加,從而調整情緒記憶等相關行為[34]。2)MVZ兒茶酚胺能神經元能將炎癥信息傳遞給中央杏仁核,神經炎癥可誘導基底外側杏仁核投射神經元的突觸和非突觸傳遞的失調,從而導致焦慮和抑郁樣行為[35],杏仁核的功能改變可能與膿毒癥誘導的大鼠情緒低下、恐懼、躁動、反應遲鈍等有關。3)MVZ神經元也投射到基底前腦,基底前腦膽堿能系統廣泛地投射到整個皮層,調節皮層功能、行為喚醒和注意力[36-37]。這些神經元可劃分為爆發性放電膽堿能神經元和常態化放電的膽堿能神經元,前者與激勵和懲罰機制相關,后者與行為后果相關,兩種基底前腦膽堿能神經元類型的差異化募集會產生行為特異性的皮質激活[38],從而導致不同的高級智能行為反應。可見,MVZ的功能和結構的改變,勢必通過杏仁核、基底前腦-前腦等神經投射從而影響意識狀態及行為反應等高級神經功能。
前腦M1型膽堿能神經元也可激活MVZ的膽堿能神經元,通過CAP進一步抑制系統性炎癥[39]。因此,MVZ的炎癥及膽堿能神經元的凋亡,通過MVZ-基底前腦-前腦-MVZ等神經環路的影響,將進一步加劇系統性炎癥風暴,與膿毒癥早期失控的炎癥有關,因此,阻斷MVZ的神經炎癥,恢復MVZ膽堿能神經元對系統性炎癥調控功能和向杏仁核,基底前腦等投射功能的正常,及時打斷炎癥的初級中樞和高級調控的異常環路調節,對于控制系統性炎癥風暴和異常行為學具有重要的理論意義。
MVZ是CAP的調控中心,其膽堿能神經元在調控系統性炎癥中具有重要作用;同時,MVZ通過杏仁核、基底前腦-前腦的膽堿能系統調控膿毒癥的行為學反應,是膿毒癥病態行為發生的重要機制之一;通過CAP的干預來調控MVZ神經炎癥可能成為控制系統性炎癥風暴、恢復膿毒癥異常行為學表現的重要靶點。

