微流控芯片技術和流式細胞術檢測替格瑞洛抗血小板療效
黃小靜 張天聰 高雪梅 何翠 宦宣容 李遠

摘要:目的 應用微流控芯片技術和流式細胞術體外分析剪切力作用下替格瑞洛的抗血小板療效。方法 采用微流控芯片技術檢測300/s、1500/s剪切率條件下替格瑞洛對血小板聚集行為的影響,以血小板聚集體表面覆蓋率為量化指標,計算替格瑞洛半抑制率;運用光學比濁法驗證替格瑞洛抑制ADP誘導的血小板聚集效應;應用微流控芯片構建體外狹窄血管模型,探究高剪切率作用下血小板反應性,并采用流式細胞術分析替格瑞洛對高剪切誘導活化的血小板膜表面纖維蛋白原受體(PAC-1)和P-選擇素(CD62P)表達的影響。結果 在300/s、1500/s剪切率流動條件下,替格瑞洛呈濃度依賴性抑制血小板聚集,300/s較1500/s抑制程度更明顯(P均<0.001),當濃度≥4 μmol/L時幾乎完全抑制血小板聚集;替格瑞洛抑制ADP誘導的血小板聚集效應與流動條件下的結果相似,亦呈濃度依賴性抑制血小板聚集;替格瑞洛能夠抑制PAC-1和CD62P的表達。結論 應用微流控芯片技術分析血小板聚集和流式細胞術檢測血小板活化,與僅用ADP誘導的基于聚集的分析相比,可確定不同患者對替格瑞洛反應的差異性。
關鍵詞:微流控芯片;流式細胞術;替格瑞洛;血小板聚集;剪切率;剪切誘導活化
中圖分類號: R446.11文獻標志碼: A文章編號:1000-503X(2023)02-0257-07
DOI:10.3881/j.issn.1000-503X.15155
Microfluidic Chip and Flow Cytometry for Examination of the Antiplatelet Effect of Ticagrelor
HUANG Xiaojing,ZHANG Tiancong,GAO Xuemei,HE Cui,HUAN Xuanrong,LI Yuan
ABSTRACT:Objective To examine the antiplatelet effect of ticagrelor by microfluidic chip and flow cytometry under shear stress in vitro.Methods Microfluidic chip was used to examine the effect of ticagrelor on platelet aggregation at the shear rates of 300/s and 1500/s.We adopted the surface coverage of platelet aggregation to calculate the half inhibition rate of ticagrelor.The inhibitory effect of ticagrelor on ADP-induced platelet aggregation was verified by optical turbidimetry.Microfluidic chip was used to construct an in vitro vascular stenosis model,with which the platelet reactivity under high shear rate was determined.Furthermore,the effect of ticagrelor on the expression of fibrinogen receptor (PAC-1) and P-selectin (CD62P) on platelet membrane activated by high shear rate was analyzed by flow cytometry.Results At the shear rates of 300/s and 1500/s,ticagrelor inhibited platelet aggregation in a concentration-dependent manner,and the inhibition at 300/s was stronger than that at 1500/s (both P<0.001).Ticagrelor at a concentration ≥4 μmol/L almost completely inhibited platelet aggregation.The inhibition of ADP-induced platelet aggregation by ticagrelor was similar to the results under flow conditions and also in a concentration-dependent manner.Ticagrelor inhibited the expression of PAC-1 and CD62P.Conclusion We employed microfluidic chip to analyze platelet aggregation and flow cytometry to detect platelet activation,which can reveal the responses of different patients to ticagrelor.
Key words:microfluidic chip;flow cytometry;ticagrelor;platelet aggregation;shear rate;shear-induced activation
Acta Acad Med Sin,2023,45(2):257-263
血小板黏附和聚集是正常止血和病理性血栓形成的基礎[1],血小板活化是止血和血栓形成的重要環節。有研究證實血小板活化和聚集依賴于流體剪切力[2]。高剪切力可以觸發血小板細胞內信號傳遞,激活其表面受體糖蛋白Ⅱb/Ⅲa和糖蛋白Ⅰbα,循環中的血小板通過其表面受體識別纖維蛋白原和血管性血友病因子(von Willebrand factor,vWF)等黏附蛋白,隨后血小板被激活,通過釋放 ADP和血栓素 A2等可溶性激動劑從血液中募集其他血小板,經信號級聯放大和調節最終形成血小板聚集體。替格瑞洛是一種直接作用的P2Y12受體拮抗劑,不需要代謝,它可逆地與P2Y12受體結合在不同于ADP結合位點的位置,抑制ADP通道誘導的血小板聚集[3]。目前指南提出替格瑞洛作為急性冠脈綜合征患者首選的抗血小板藥物,用于預防和治療成人急性冠脈綜合征患者的血栓栓塞癥[4]。然而,服用替格瑞洛的患者仍可能出現血栓形成或出血并發癥[5-6]。基于血小板對剪切力的反應性測試的抗血小板治療可能會減少這些并發癥。目前,盡管已有椎板分析儀、血小板功能分析儀PF-100/200等幾種基于剪切力的儀器用于評估剪切率條件下抗血小板藥物對血小板功能的影響[7-9]。然而,這些設備連續剪切血小板以評估不同的抗血小板藥物,沒有考慮到血小板之間的瞬時相互作用和增加的剪切力,在測試體內血小板所經歷的血流動力學環境中抗血小板藥物的有效性方面能力有限。因此,本研究利用微流控芯片通過模擬體內微血管尺寸和結構特征以精準調控的微流體動力學研究血小板功能。此外,近年流式細胞術被廣泛用于基礎和臨床研究,成為檢測血小板活化的重要手段。本研究采用微流控芯片技術和流式細胞術研究血小板對剪切力的反應性,以期能夠為替格瑞洛的療效提供更多的信息。
材料和方法
儀器 IX71倒置熒光顯微鏡購自日本Olympus公司,單色制冷CCD相機購自美國Photometrics公司,PSP01-CS雙向推拉型精密注射泵購自嘉善瑞創電子科技有限公司,PDG-32G-2等離子清洗機購自德國Harrick公司,Streampix 7.0視頻錄制軟件購自加拿大Norpix公司,Varioskan Flash多功能酶標儀購自美國Thermofisher公司,CytoFLEX流式細胞儀購自美國Beckman Coulter公司。
試劑 Sylgard 184聚二甲基硅氧烷購自美國Dow Corning公司,替格瑞洛和ADP購自美國Topscience公司,Calcein AM熒光染料、Anti-Human CD61-PerCP-eFluorTM710、Anti-Human CD62P-PE和Anti-Human PAC-1-FITC均購自美國Invitrogen公司,3.2%檸檬酸鈉抗凝真空采血管購自山東威高采血耗材有限公司,4%多聚甲醛溶液購自上海碧云天生物技術有限公司,牛血清白蛋白和磷酸鹽緩沖液(phosphate buffered saline,PBS)購自上海生工生物工程有限公司。
血液樣品采集和處理 12名健康志愿者由重慶市血液中心永川分中心招募,志愿者1個月內無影響血小板功能服藥史,其血常規和凝血功能(活化部分凝血酶時間、凝血酶原時間、凝血酶時間和纖維蛋白原)檢測指標均在正常參考值范圍內。真空采血管采集靜脈血液樣品,全血樣品以3.2%檸檬酸鈉抗凝,室溫放置,2 h內使用。將每名志愿者抗凝全血均分為5等份,其中4份作為處理組,分別加入不同濃度的替格瑞洛(終濃度0.5、 1.0、 2.0、 4.0 μmol/L),剩余1份加入PBS作為對照組。最后,將濃度為 2 mmol/L Calcein AM熒光染料按 1∶500(v/v)加入到 5 組血液樣品中,輕輕吹打混勻后,在37 ℃靜止孵育 30 min,對血小板進行熒光標記。
微通道芯片設計、加工和處理 微通道芯片設計、加工和處理參考課題組前期報道[10]。選用寬度和深度分別為700 μm和70 μm的直微通道。在前期研究基礎上增加狹窄微通道,模擬小動脈狹窄時的病理性高剪切率。本研究使用的狹窄微通道狹窄處寬度為140 μm(狹窄程度為80%),狹窄長度為0.5 mm,其他組成部分同直通道。
微流控芯片血小板聚集分析 微通道血小板聚集實驗參考課題組前期文獻報道[11]。本研究設定直微通道壁剪切率為300/s和1500/s,分別代表生理條件下人體靜脈和動脈內的血液流動壁剪切率。全血樣本灌注到微通道中,持續150 s,采集熒光圖像進行分析。
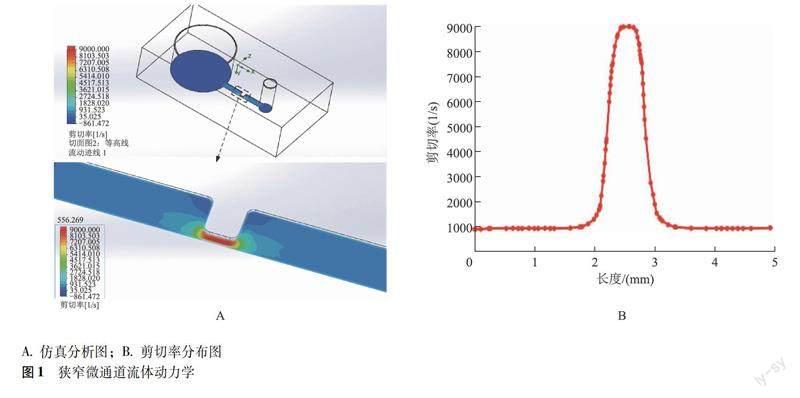
狹窄微通道流體動力學分析 運用Solidworks3D建模軟件的有限元分析模塊對狹窄微通道的流體動力學進行分析(圖1)。設置狹窄微通道的流量為52 μl/min,通過有限元分析壁面剪切率可達到9000/s。狹窄微通道大部分區域的剪切率分布是均勻的,狹窄微通道長度為0.50 mm,上下游剪切率梯度變化區域位于狹窄微通道前后0.75 mm處,梯度從狹窄微通道向兩端遞減。抗凝全血通過狹窄微通道灌注,其中血小板進入高剪切力的上游區域,隨后流出到較低剪切力的區域,聚集在較低剪切力區域逐漸形成穩定的血小板聚集體。因此,本研究血小板聚集圖像選擇狹窄下游0.75 mm處的聚集區域。
光學比濁法血小板聚集效應驗證 ADP誘導的血小板聚集采用基于96孔板的光學比濁法進行分析[12]。將抗凝全血167×g離心10 min,獲取上層富血小板血漿(platelet-rich plasma,PRP);將PRP 3000×g進一步離心15 min,獲取上層貧血小板血漿(platelet-poor plasma,PPP);將PRP與不同濃度(0、0.5、1.0、2.0、4.0 μmol/L)的替格瑞洛37 ℃孵育30 min;在96孔板中加入5 μl ADP(終濃度為5.0 μmol/L)或PBS;取100 μl 替格瑞洛處理的PRP加入到96孔板,作為參考,將100 μl PRP或PPP加入到PBS的孔中,將96孔板37 ℃震蕩孵育15 min后用Varioskan Flash多功能酶標儀結合SkanIt Software 2.4.3 RE for Varioskan Flash軟件測試溶液在572 nm處波長的吸光度,結果報告為光密度值(optical density,OD)。實驗以PPP和PRP的溶液作為對照孔,其吸光度分別代表血小板聚集率為100%和0,并依此計算加入不同濃度替格瑞洛的血小板聚集率,血小板聚集率(%)=[OD(PRP)-OD(樣本)]/[OD(PRP)-OD(PPP)]×100。
流式細胞術血小板活化分析 抗凝全血(陽性對照)和替格瑞洛(終濃度2.0 μmol/L)處理的全血在37 ℃靜止孵育30 min后,將血液灌注到牛血清白蛋白封閉的80%狹窄微通道中,在52 μl/min體積流量下收集血液樣品,各取5 μl與抗人CD61、CD62P、PAC-1室溫下避光孵育20 min;在灌注前,先標記1份血液作為陰性對照。標記后的樣品加入1%多聚甲醛1 ml,充分混勻固定10 min,用流式細胞術三色熒光分析CD62P和PAC-1的表達,用Flowjo 10.5.3進行數據分析。
統計學處理 采用SPSS 26.0統計軟件進行數據分析,計量資料用均數±標準差表示。多組均值比較采用隨機區組設計方差分析,采用LSD檢驗進行多重比較,兩組均數比較采用配對t檢驗,采用Shapiro-Wilk 實驗進行正態性檢驗。P<0.05為差異有統計學意義。
結果
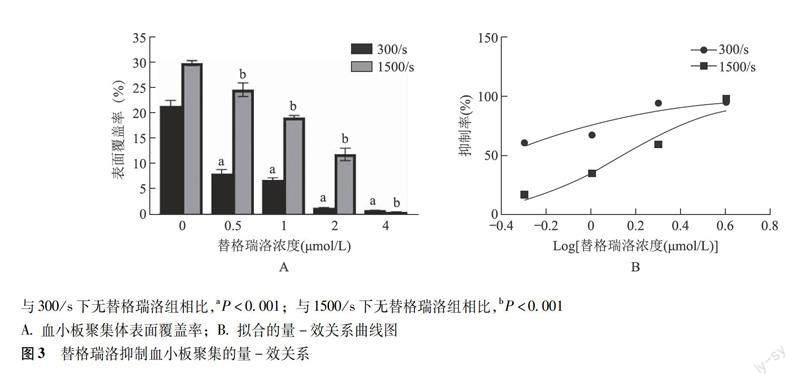
兩種生理性剪切率條件下替格瑞洛療效 不同終濃度替格瑞洛處理組在300/s、1500/s剪切率條件下流動150 s后,其典型的血小板黏附聚集熒光圖像顯示300/s條件下血小板聚集體較小,分布無方向性,1500/s條件下血小板聚集體較大,沿流動方向延伸(圖2)。在兩種剪切率條件下替格瑞洛均顯著降低血小板表面覆蓋率,且呈濃度依賴性,其中2.0 μmol/L濃度下替格瑞洛能夠穩定抑制血小板聚集,4.0 μmol/L濃度下血小板幾乎不發生聚集,300/s相較1500/s降低程度更明顯(P均<0.001)。進一步分析顯示,替格瑞洛濃度與血小板表面覆蓋率能進行良好擬合,繪制擬合的量-效關系曲線并得出300/s和1500/s剪切率下替格瑞洛對血小板黏附聚集的半抑制率分別為0.376、1.364 μmol/L(圖3)。
ADP誘導條件下替格瑞洛療效 基于傳統的光學比濁法測試顯示,對照組ADP誘導的血小板聚集率為(80.1±1.1)%,0.5、1.0、2.0、4.0 μmol/L替格瑞洛處理組的血小板聚集率分別為(65.5±5.1)%、(41.0±6.2)%、(22.0±1.4)%、(6.8±5.2)%,血小板聚集率呈濃度依賴性降低。與剪切力誘導的聚集結果相似,2.0 μmol/L濃度下替格瑞洛的抑制率大于50%,可用于后續病理性高剪切率對血小板活化和聚集的研究。
病理性剪切率條件下替格瑞洛對血小板活化和聚集的影響 將熒光素標記的抗血小板單克隆抗體免疫熒光染色的標本在流式細胞儀上分析,以CD61 PerCP/SSC雙參數設定血小板門,分析PAC-1和CD62P陽性血小板百分率。與對照組相比,替格瑞洛處理組顯著降低P-選擇素(CD62P)[降低13.44%(t=5.390,P =0.033]和糖蛋白Ⅱb/Ⅲa受體(PAC-1)[降低12.30%(t=8.059,P =0.015)]的表達。病理性高剪切率條件下,與對照組相比,替格瑞洛處理后血小板聚集體較小,且顯著降低血小板聚集體表面覆蓋率[降低22.91%(t=12.190, P=0.007)](圖4)。
討論
替格瑞洛通過可逆阻斷P2Y12受體結合,抑制糖蛋白Ⅱb/Ⅲa受體活化及纖維蛋白原連接從而抑制血栓的形成。盡管替格瑞洛抗血小板機制已經十分清楚,但剪切力作用下替格瑞洛抑制血小板活化聚集行為的確切機制尚不清楚。本研究采用微流控芯片分析剪切力誘導的血小板聚集體的熒光圖像顯示,在300/s和1500/s剪切率條件下,替格瑞洛能顯著抑制血小板黏附聚集,并呈濃度依賴性,但血小板聚集體不會被完全抑制。推測原因可能為替格瑞洛抑制了ADP通路誘導的血小板聚集,少量血小板仍然可以通過花生四烯酸-環氧合酶-血栓素 A2等途徑發生聚集。值得注意的是,替格瑞洛在300/s剪切率流動條件下抑制血小板聚集程度較1500/s剪切率大,提示替格瑞洛抑制血小板聚集效應與剪切率大小相關。在相對較低剪切率條件下(<1000/s),血小板聚集依賴于糖蛋白Ⅱb/Ⅲa-纖維蛋白原相互作用,這種相互作用可以獨立于vWF-糖蛋白Ⅰb發生;當剪切率在1000~10 000/s時,血小板相互作用逐漸變得更加依賴于vWF、糖蛋白Ⅰb和糖蛋白Ⅱb/Ⅲa[13]。有報道持續的ADP-P2Y12信號轉導對于維持糖蛋白Ⅱb/Ⅲa的活性構象水平以促進血小板聚集體的穩定至關重要[14-15]。因此,認為阻斷ADP-P2Y12可能對300/s剪切率下的血小板聚集影響更大。替格瑞洛對血小板聚集的影響進一步采用光學比濁法進行驗證,本研究選用ADP作為血小板激動劑,用于評估替格瑞洛調控血小板聚集的P2Y12-APD受體途徑,結果顯示替格瑞洛呈濃度依賴性顯著抑制血小板聚集,在濃度為2.0 μmol/L時能夠穩定抑制血小板聚集,該結果與替格瑞洛抑制剪切率條件下血小板聚集的結果相似,符合預期的理論。本研究表明替格瑞洛不僅減弱ADP途徑誘導的血小板聚集反應,而且對剪切誘導的血小板聚集反應也有強的抑制作用。
在心腦血管動脈血栓性疾病中,血管狹窄可導致血流受到遠高于生理水平的剪切力,這種高剪切力在體外可以直接誘導血小板迅速活化/聚集[16-18]。PAC-1是糖蛋白Ⅱb/Ⅲa活化后暴露的纖維蛋白原結合位點,即活化的糖蛋白Ⅱb/Ⅲa;CD62P是靜息血小板α顆粒膜蛋白成分,血小板活化時發生脫顆粒反應,α顆粒膜迅速與血小板融合,P-選擇素轉移到血小板表面或脫顆粒成為可溶性P-選擇素,這種蛋白可作為血小板活化的標志物[19,20]。本研究采用狹窄微流控芯片提供高剪切作用,通過流式細胞儀分析替格瑞洛降低活化糖蛋白Ⅱb/Ⅲa和P-選擇素的表達,表明替格瑞洛能夠抑制剪切率誘導的血小板活化,與Goto等[21]報道的實驗結果相符,即阻斷血小板釋放的ADP對P2Y12的活化可抑制vWF-糖蛋白Ⅰb相互作用引發的血小板活化。流式細胞術測量剪切誘導的糖蛋白Ⅱb/Ⅲa活化、P-選擇素表達可以深入了解接受抗血小板治療的患者的抑制狀態,并可能識別出更嚴格的抗血小板治療中血小板抑制程度不佳的患者。
綜上,本研究的血小板黏附聚集功能微流控芯片技術可分析不同剪切率條件下血小板功能反應性差異,聯合流式細胞術可用于出凝血功能臨床診斷及抗血小板藥物個性化用藥分析,未來可進一步研究這兩種檢測方法在監測治療中的血小板反應性方面的價值。
參 考 文 獻
[1]van der Meijden PEJ,Heemskerk JWM.Platelet biology and functions:new concepts and clinical perspectives [J].Nat Rev Cardiol,2019,16(3):166-179.DOI:10.1038/s41569-018-0110-0.
[2]高振岳,楊春,莊逢源.高剪切場誘導血小板活化和聚集機制的研究進展 [J].醫用生物力學,2005,256-259.DOI:10.16156/j.1004-7220.2005.04.012.
[3]Loganath K,Adamson PD,Moss AJ.Ticagrelor in the management of coronary artery disease [J].Future Cardiol,2021,17(4):561-571.DOI:10.2217/fca-2020-0108.
[4]Valgimigli M,Bueno H,Byrne RA,et al.2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS:the Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS) [J].Eur Heart J,2018,39(3):213-260.DOI:10.1093/eurheartj/ehx419.
[5]Cuisset T,Cayla G,Frere C,et al.Predictive value of post-treatment platelet reactivity for occurrence of post-discharge bleeding after non-ST elevation acute coronary syndrome.Shifting from antiplatelet resistance to bleeding risk assessment[J].EuroIntervention,2009,5(3):325-329.DOI:10.4244/51.
[6]Martin AC,Houssany-Pissot S,Zlotnik D,et al.Management of the bleeding risk associated with antiplatelet agents [J].Rev Med Interne,2017,38(7):467-473.DOI:10.1016/j.revmed.2017.01.013.
[7]Nakamura T,Uchiyama S,Yamazaki M,et al.Effects of dipyridamole and aspirin on shear-induced platelet aggregation in whole blood and platelet-rich plasma [J].Cerebrovasc Dis,2002,14(3-4):234-238.DOI:10.1159/000065669.
[8]Reséndiz JC,Feng S,Ji G,et al.Purinergic P2Y12 receptor blockade inhibits shear-induced platelet phosphatidylinositol 3-kinase activation [J].Mol Pharmacol,2003,63(3):639-645.DOI:10.1124/mol.63.3.639.
[9]Grove EL,Storey RF,Wurtz M.Platelet function testing in atherothrombotic disease [J].Curr Pharm Design,2012,18(33):5379-5391.DOI:10.2174/138161212803251862.
[10]黎洋,丁玲,鄧素容,等.在生理流動條件下分析血小板黏附聚集的簡易微流控芯片技術 [J].軍事醫學,2017,41(7):586-593.DOI:10.7644/j.issn.1674-9960.2017.07.008.
[11]張天聰,陳丹,廖娟,等.生理性流動條件下血小板在玻璃表面的聚集行為 [J].醫用生物力學,2021,37(3):425-432.DOI:10.16156/j.1004-7220.2022.03.007.
[12]Vinholt PJ,Nybo M,Nielsen CB,et al.Light transmission aggregometry using pre-coated microtiter plates and a Victor X5 plate reader [J].PloS One,2017,12(10):e0185675.DOI:10.1371/journal.pone.0185675.
[13]Jackson SP.The growing complexity of platelet aggregation [J].Blood,2007,109(12):5087-5095.DOI:10.1182/blood-2006-12-027698.
[14]Cosemans JM,Munnix IC,Wetzker R,et al.Continuous signaling via PI3K isoforms beta and gamma is required for platelet ADP receptor function in dynamic thrombus stabilization [J].Blood,2006,108(9):3045-3052.DOI:10.1182/blood-2006-03-006338.
[15]Goto S,Tamura N,Ishida H,et al.Dependence of platelet thrombus stability on sustained glycoprotein Ⅱb/Ⅲa activation through adenosine 5-diphosphate receptor stimulation and cyclic calcium signaling [J].J Am Coll Cardiol,2006,47(1):155-162.DOI:10.1016/j.jacc.2005.08.055.
[16]李綿洋,叢玉隆,鄧新立,等.剪切力作用對血小板膜糖蛋白分子表達的影響 [J].中華醫學雜志,2002,82(4):267-270.DOI:10.3760/j:issn:0376-2491.2002.04.015.
[17]Nesbitt WS,Westein E,Tovar-Lopez FJ,et al.A shear gradient-dependent platelet aggregation mechanism drives thrombus formation [J].Nat Med,2009,15(6):665-673.DOI:10.1038/nm.1955.
[18]Kamada H,Imai Y,Nakamura M,et al.Shear-induced platelet aggregation and distribution of thrombogenesis at stenotic vessels [J].Microcirculation,2017,24(4).DOI:10.1111/micc.12355.
[19]Yang H,Lang S,Zhai Z,et al.Fibrinogen is required for maintenance of platelet intracellular and cell-surface P-selectin expression [J].Blood,2009,114(2):425-436.DOI:10.1182/blood-2008-03-145821.
[20]McEver RP.Selectins:initiators of leucocyte adhesion and signalling at the vascular wall [J].Cardiovasc Res,2015,107(3):331-339.DOI:10.1093/cvr/cvv154.
[21]Goto S,Tamura N,Eto K,et al.Functional significance of adenosine 5-diphosphate receptor (P2Y(12)) in platelet activation initiated by binding of von Willebrand factor to platelet GP Ibalpha induced by conditions of high shear rate [J].Circulation,2002,105(21):2531-2536.DOI:10.1161/01.cir.0000016703.93845.af.
(收稿日期:2022-06-14)
基金項目:國家自然科學基金(11702047)、重慶市社會事業與民生保障科技創新專項(cstc2017shmsA130009)、重慶市醫學科研計劃項目(2017MSXM079)和重慶市博士后科研流動站項目(Xm2017082)

