大鼠神經(jīng)性勃起功能障礙模型在實驗中的應(yīng)用
胡軒韓 錢麟 魏海彬 徐智慧
摘要:勃起功能障礙(ED)是指陰莖持續(xù)不能達(dá)到和/或維持足夠的勃起以獲得滿意的性生活。ED對于患者及其性伴侶的生活質(zhì)量會帶來較大的影響。近些年來,為闡明ED的病理生理機(jī)制,多種ED動物模型應(yīng)運而生,并取得了一系列的進(jìn)展。嚙齒類動物的海綿體神經(jīng)(CN)在解剖上與人類相近,且具有性價比高、粗大易辨認(rèn)等優(yōu)勢,逐漸成為ED動物模型的主流。本文回顧了近年來大鼠雙側(cè)CN損傷所致神經(jīng)性ED動物模型的建立方式,總結(jié)了其模型的檢測及評價指標(biāo),探討了ED動物模型在基礎(chǔ)實驗研究當(dāng)中的應(yīng)用及進(jìn)展。
關(guān)鍵詞:海綿體神經(jīng)損傷;勃起功能障礙;大鼠;動物模型
中圖分類號: R332文獻(xiàn)標(biāo)志碼: A文章編號:1000-503X(2023)02-0311-06
DOI:10.3881/j.issn.1000-503X.14954
Application of Rat Model of Neurotic Erectile Dysfunction in Experiment
HU Xuanhan QIAN Lin WEI Haibin XU Zhihui2
ABSTRACT:Erectile dysfunction (ED) refers to the persistent inability to achieve and/or maintain a sufficient erection of the penis to obtain a satisfactory sexual life,which affects the quality of life of the patients and their sexual partners.To decipher the pathophysiological mechanism of ED,researchers have established a variety of animal models and achieved a series of progress.The cavernous nerve (CN) of rodents,anatomically similar to that of humans,is cost-effective,thick,and easy to be identified,which has gradually become the mainstream of animal models.In this paper,we reviewed the modeling methods of the neurological ED caused by bilateral CN injury in rats in recent years,summarized the model evaluation indicators,and discussed the application and progress of ED models in basic experimental research.
Key words:cavernous nerve injury;erectile dysfunction;rat;animal model
Acta Acad Med Sin,2023,45(2):311-316
勃起功能依賴于神經(jīng)和血管的相互作用,需要中樞神經(jīng)、脊髓骶骨節(jié)段的副交感神經(jīng)、陰部內(nèi)動脈、環(huán)狀靜脈、背深靜脈等神經(jīng)或血管通路共同完成。因此,通路中的任何損害皆可導(dǎo)致勃起功能障礙(erectile dysfunction,ED)[1]。器質(zhì)性ED根據(jù)損傷機(jī)制的不同又可分為血管性ED、神經(jīng)性ED、內(nèi)分泌性ED、藥物性ED和平滑肌損傷性ED[2]。神經(jīng)性ED是神經(jīng)末梢、陰部神經(jīng)、脊髓,或誘發(fā)勃起的大腦中樞病變的結(jié)果。在前列腺根治性切除術(shù)(radical prostatectomy,RP)中,海綿體神經(jīng)(cavernous nerve,CN)損傷可能是RP術(shù)后神經(jīng)性ED的主要原因[3]。Haglind等[4]的研究顯示,即使接受微創(chuàng)的機(jī)器人輔助下前列腺癌根治術(shù),在術(shù)后12個月時,仍有高達(dá)70.4%的患者勃起功能未恢復(fù)。
雄性大鼠的海綿體神經(jīng)位于其前列腺背外側(cè)盆神經(jīng)節(jié)(major pelvic ganglion,MPG)的下游,從MPG發(fā)出分支后向內(nèi)下方的尿道括約肌方向走行。與其他哺乳動物相比,大鼠的相對成本較低,在基礎(chǔ)研究領(lǐng)域的應(yīng)用更加廣泛,因而是一種比較標(biāo)準(zhǔn)化的ED動物模型。本文回顧了近年來大鼠雙側(cè)CN損傷所致神經(jīng)性ED動物模型的建立方法,總結(jié)了神經(jīng)性ED動物模型的檢測及評價指標(biāo),探討了神經(jīng)性ED動物模型在基礎(chǔ)實驗研究當(dāng)中的應(yīng)用及進(jìn)展。
手術(shù)流程
本文中所涉及大鼠均為Sprague-Dawley(SD)大鼠。選取大鼠在麻醉狀態(tài)下進(jìn)行手術(shù),根據(jù)實驗條件可選用2.5%~3.0%的異氟醚、戊巴比妥鈉(50 mg/kg)、55~75 mg/kg氯雷他定聯(lián)合鹽酸塞拉嗪等藥物腹腔注射麻醉。先將大鼠以仰臥位放置在加熱墊上,進(jìn)行常規(guī)的腹部消毒,在恥骨聯(lián)合至中腹部做一個中線切口,依次暴露膀胱、前列腺。在前列腺兩側(cè)葉的背外側(cè)尋找MPG,CN是MPG發(fā)出的分支當(dāng)中較為粗大的一支、且在直腸和尿道之間的凹槽中向尾部延伸。在顯微鏡下暴露CN,根據(jù)建模的不同選擇合適方式損傷雙側(cè)CN,關(guān)閉腹腔并縫合切口[5-6]。
CN損傷模型
CN損傷模型根據(jù)術(shù)中損傷類型的不同可分為牽拉模型、擠壓模型、冷凍模型、橫切模型、切除模型。CN損傷是實驗的中心環(huán)節(jié)之一,然后配合不同的方法、手段、策略組成實驗方案,如與勃起刺激方法(藥物、電刺激)、勃起監(jiān)測手段(海綿體內(nèi)壓、交配實驗)、ED治療策略(神經(jīng)移植、干細(xì)胞治療、藥物治療)等相結(jié)合。根據(jù)研究終點的不同,可選取不同的實驗方案進(jìn)行研究。
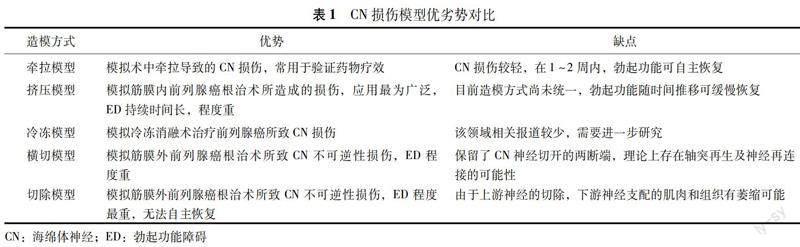
牽拉模型 在RP手術(shù)中,由CN參與構(gòu)成的血管神經(jīng)束是前列腺筋膜的重要組成部分,無論術(shù)中如何注意保護(hù)血管神經(jīng)束,都無法避免直接或間接牽拉CN,因此牽拉模型常用來評估其對勃起功能的影響。Li等[7]研究表明,CN不受物理損傷下的最大拉力是0.2 N,CN牽拉2 min后,引起海綿體內(nèi)壓(intracavernous pressure,ICP)/平均動脈壓(mean arterial pressure,MAP)值明顯下降,陰莖背神經(jīng)神經(jīng)纖維數(shù)量減少,海綿體膠原纖維/平滑肌比例升高,細(xì)胞凋亡增加,證實CN牽拉是一種有效的制造CN損傷模型手段。由于牽拉模型對于雙側(cè)CN損傷較輕,大鼠的勃起功能往往為一過性損傷,在1~2周內(nèi)可以緩慢恢復(fù)。基于上述特點,牽拉模型常用于驗證藥物的療效實驗中。
擠壓模型 雙側(cè)CN擠壓傷造模是模擬保留神經(jīng)血管束的RP的主要模型,在基礎(chǔ)研究領(lǐng)域應(yīng)用最為廣泛。由于造模的工具(止血鉗、鑷子、動脈夾)和擠壓持續(xù)時間的不同,目前尚無國際統(tǒng)一的造模方式。在Sezen等[8]的研究中,用鑷子擠壓雙側(cè)CN 15 s,反復(fù)3次,即可造成ICP下降至正常組大鼠的50%。Cong等[9]使用非鋸齒狀止血鉗擠壓雙側(cè)CN 2 min,術(shù)后大鼠均表現(xiàn)為重度ED。相較于牽拉模型,擠壓模型更貼近筋膜內(nèi)保留神經(jīng)血管術(shù)的RP。目前已有一系列研究將干細(xì)胞、神經(jīng)生長因子、中藥、電針等諸多療法應(yīng)用于該模型中。然而由于造模方式的不同,各研究中大鼠海綿體損傷程度并不一致,難以橫向?qū)Ρ韧愌芯浚磥響?yīng)考慮界定標(biāo)準(zhǔn)的造模方式。
冷凍模型 1996年,美國泌尿外科協(xié)會正式將冷凍療法作為前列腺癌的治療選擇之一,其優(yōu)勢在于住院時間短、復(fù)發(fā)率低、無復(fù)發(fā)生存率高等,然而由于多次的凍融循環(huán)及擴(kuò)展至腺體外側(cè)的冷凍,極易損傷CN,引起術(shù)后ED(50%~90%)[10]。Yang等[11]將放置于液氮中的鋼棒接觸大鼠雙側(cè)CN 20 s,間隔1 min后,再度接觸20 s,以模擬冷凍消融術(shù),結(jié)果顯示陰莖背神經(jīng)中神經(jīng)型一氧化氮合酶(neuronal nitric oxide synthase,nNOS) 顯著減少,陰莖海綿體萎縮,血管竇內(nèi)平滑肌細(xì)胞凋亡明顯增加。目前冷凍消融治療在國內(nèi)開展較少,關(guān)于大鼠的冷凍模型僅有1篇文獻(xiàn)報道,后續(xù)仍需進(jìn)一步實驗研究的證實。
橫切模型 橫切模型主要模擬筋膜外RP手術(shù),術(shù)中切斷雙側(cè)CN后,神經(jīng)軸突及外鞘的連續(xù)性中斷,造成了不可逆的損傷,但保留了CN神經(jīng)切開的兩斷端,理論上存在軸突再生及神經(jīng)再連接的可能性。在Cho等[12]的研究中,用顯微外科剪切斷雙側(cè)MPG遠(yuǎn)心端5 mm的海綿體神經(jīng),術(shù)后1周提示平滑肌/膠原比例顯著下降,術(shù)后8周較前有所恢復(fù),提示術(shù)后8周時受損的CN神經(jīng)已部分完成軸突再生及神經(jīng)再連接。與擠壓模型相比,橫切模型雙側(cè)CN損傷更為嚴(yán)重,研究中往往會通過局部予新型材料或移植自身組織等手段促進(jìn)CN再生,而單一的藥物療法在橫切模型中效用并不顯著,因此橫切模型常被用于模擬重度ED,研究雙側(cè)CN切斷后的病理生理學(xué)改變,以及測定新型材料和自體組織對于CN的再生和勃起功能的恢復(fù)和改善程度情況。
切除模型 與橫切相比,切除是更徹底的破壞,意味著CN片段的缺失,根據(jù)切除工具的不同,可分為普通切除及消融切除。Ying等[13]用顯微外科剪在雙側(cè)CN上各切除8 mm,結(jié)果發(fā)現(xiàn)海綿體神經(jīng)nNOS相較于對照組明顯下降。Li等[14]比較切除模型和擠壓模型,結(jié)果顯示相較于擠壓模型,切除模型引起的ED更嚴(yán)重,表現(xiàn)為不可逆性的ED,更適合用于長期研究。由于CN節(jié)段的切除,兩側(cè)斷端分離,神經(jīng)無法自主再生,因此常用自體組織或外源性材料替代切除節(jié)段,觀察大鼠勃起功能恢復(fù)狀況。目前常用自體神經(jīng)、細(xì)胞洗脫支架或海藻酸鹽凝膠等作為移植物,通過負(fù)載不同的藥物或細(xì)胞,測定在大鼠切除模型中的療效。相比于筋膜內(nèi)的RP,筋膜外的RP手術(shù)難度較低,切除越徹底,術(shù)后ED發(fā)生率越高。橫切模型和切除模型模擬了筋膜外的RP,為接受該手術(shù)的患者提供了治療ED的基礎(chǔ)。切除模型常被用于研究神經(jīng)移植替代物在重度ED的療效。
CN損傷模型造模方式、優(yōu)勢、劣勢簡單列表如下(表1)。
ED的檢測及評價方法
隨著ED檢測技術(shù)的進(jìn)步,評價方法不再局限于原有的生物行為學(xué)研究和分子生物學(xué)研究,根據(jù)評價方式的類型,一般分為以下3類:(1)功能學(xué)評價,如勃起功能評價、交配實驗等;(2)常規(guī)分子生物學(xué)評價,如HE染色、蛋白印跡分析、免疫組織化學(xué)、免疫熒光、Masson染色、甲苯胺藍(lán)染色、透射電鏡等方法;(3)生物信息學(xué)評價,如蛋白組學(xué)、基因組學(xué)等方法。
勃起功能評價 測量大鼠陰莖ICP等是評價大鼠勃起功能的主要手段,ICP最早由Lewi等[15]提出,主要采用穿刺測壓法。具體操作為:常規(guī)麻醉、消毒,在下腹部切開5 cm左右正中切口,暴露海綿體和白膜,將注射器與壓力傳感器相連接,將含有肝素生理鹽水的注射器插入海綿體組織中,記錄ICP;以同樣的方法,將含有肝素生理鹽水的PE-50管插入大鼠的左頸動脈,檢測MAP;在不同電壓或電流刺激下,用雙極電極鉤施加于雙側(cè)或單側(cè)CN,記錄刺激期間的壓力數(shù)據(jù),并計算最大ICP與相應(yīng)MAP之間的比值(ICP/MAP)[16-18]。該方法有一缺陷,即在電極施加于CN的過程中,機(jī)械牽拉、電流刺激等可能會對CN造成潛在損傷,從而影響實驗結(jié)果,仍需要進(jìn)一步改進(jìn)。
蛋白印跡分析 測量海綿體組織、CN、陰莖背神經(jīng)中的相關(guān)蛋白成分也是評價ED的檢驗方法之一。通過收集大鼠的陰莖海綿體組織、CN組織、背神經(jīng)組織,進(jìn)行蛋白質(zhì)印跡分析以量化蛋白質(zhì)表達(dá),根據(jù)image J軟件評估每種蛋白質(zhì)與β-肌動蛋白的相對定量,從而評價CN損傷后ED的程度[16]。
組織學(xué)評估 在兩側(cè)前列腺腺葉外側(cè)的CN受損后,海綿體的竇腔內(nèi)出現(xiàn)血管內(nèi)皮細(xì)胞及平滑肌細(xì)胞凋亡、纖維化等一系列表現(xiàn),可用于評估陰莖海綿體組織中平滑肌變化;Masson染色通過平滑肌/膠原評估海綿體纖維化程度;甲苯胺藍(lán)染色通過顯微鏡下CN軸突的計數(shù)來評估神經(jīng)的再生修復(fù)情況[19-20]。
凋亡細(xì)胞檢測 除了應(yīng)用蛋白印跡法進(jìn)行凋亡相關(guān)蛋白的檢測外,還可以在細(xì)胞層面進(jìn)行凋亡細(xì)胞的檢測。Fall等[21]通過原位細(xì)胞凋亡試劑盒測定和量化海綿體組織中的凋亡細(xì)胞,進(jìn)而通過計算凋亡細(xì)胞數(shù)量和細(xì)胞總數(shù)的比例以確定凋亡指數(shù),發(fā)現(xiàn)大鼠雙側(cè)CN損傷5周后,海綿體組織彌漫性凋亡,海綿體動脈的平滑肌細(xì)胞和內(nèi)皮細(xì)胞也發(fā)生凋亡。
交配實驗 交配實驗是目前較為常見的實驗手段,能直觀評估大鼠的勃起功能。通過誘導(dǎo)交配行為,設(shè)置插入潛伏期、導(dǎo)入潛伏期、射精潛伏期、射精后間隔期、射精頻率、交配間隔等一系列的參數(shù)來評價勃起功能。具體操作為誘導(dǎo)雌鼠發(fā)情,之后將雌鼠放置在一處環(huán)境安靜、光線適度的觀察籠中,經(jīng)過10 min的適應(yīng)期后,將雄鼠放入觀察籠內(nèi),實驗持續(xù)30 min,記錄相關(guān)參數(shù)[22-23]。交配實驗易受環(huán)境、藥物、大鼠主動性等多種因素影響,即使是正常勃起的大鼠,也可能有陰性表現(xiàn),因此該實驗仍存在一定的局限性。
神經(jīng)性ED動物模型在藥物治療領(lǐng)域的應(yīng)用
隨著ED研究的深入,越來越多的基礎(chǔ)實驗開始將側(cè)重點聚焦于應(yīng)用研究,傳統(tǒng)的藥物治療如磷酸二酯酶-5抑制劑是目前治療ED最常見的藥物之一。隨著神經(jīng)生長因子的研究深入,可以通過一系列信號通路調(diào)節(jié)神經(jīng)元功能和狀態(tài),從而改善海綿體神經(jīng)損傷所致ED,如文獻(xiàn)報道腦源性神經(jīng)營養(yǎng)因子、生長分化因子-5、膠質(zhì)細(xì)胞源性神經(jīng)營養(yǎng)因子等與勃起功能的恢復(fù)相關(guān)[24]。此外由于激酶在細(xì)胞信號傳導(dǎo)中的關(guān)鍵作用,一系列研究報道了其在ED中的應(yīng)用,如轉(zhuǎn)化生長因子-β、Rho激酶/Akt通路、LIMK通路等被報道與細(xì)胞的凋亡和海綿體纖維化相關(guān)[25]。傳統(tǒng)中醫(yī)藥治療ED的配方在我國源遠(yuǎn)流長,對于RP術(shù)后導(dǎo)致的ED,中醫(yī)多認(rèn)為是氣虛血瘀所致。Ma等[26]給CN損傷大鼠每日灌胃紅景Ⅰ號方,發(fā)現(xiàn)紅景Ⅰ號方不僅促進(jìn)了神經(jīng)絲蛋白-200,生長相關(guān)蛋白-43、nNOS等因子的表達(dá),還能促進(jìn)神經(jīng)生長、平滑肌細(xì)胞增殖,從而提高勃起硬度、恢復(fù)勃起功能。
神經(jīng)性ED動物模型在干細(xì)胞治療領(lǐng)域當(dāng)中的應(yīng)用
干細(xì)胞療法可能為將來的ED治療提供持久的、有效的治療選擇,目前已有大量基礎(chǔ)研究報道各類干細(xì)胞用于治療神經(jīng)性ED[27]。Ying等[28]將脂肪源性干細(xì)胞注射到擠壓模型大鼠的海綿體中,發(fā)現(xiàn)脂肪源性干細(xì)胞可有效緩解海綿狀神經(jīng)損傷及海綿體纖維化程度,改善勃起功能。將來的干細(xì)胞若進(jìn)入臨床應(yīng)用,還需解決如下問題:(1)商品化問題:如何將干細(xì)胞標(biāo)準(zhǔn)化及商品化統(tǒng)一;(2)來源問題:自體/異體來源的比較,間充質(zhì)干細(xì)胞及誘導(dǎo)性多能干細(xì)胞的細(xì)胞來源比較;(3)不良反應(yīng)問題:比如成瘤、致畸等問題;(4)作用機(jī)制問題:比如干細(xì)胞在體內(nèi)的定位及作用方式等,均需要進(jìn)一步地深入研究。
總結(jié)
大鼠雙側(cè)CN損傷所致的神經(jīng)性ED動物模型是目前ED動物模型的主流,根據(jù)損傷方式不同,可分為牽拉模型、冷凍模型、擠壓模型、橫切模型、切除模型。因為研究目的決定了大鼠模型的選擇以及相應(yīng)的ED評價手段,所以為了研究的成功,了解各種ED動物模型的適用條件和選擇合適的ED檢測方法至關(guān)重要。在牽拉和擠壓模型中,海綿體神經(jīng)通路仍有保留,大鼠可逐漸恢復(fù)勃起功能,所以牽拉或擠壓模型適合藥物或神經(jīng)生長因子等對于勃起功能的恢復(fù)為研究終點選用。而在切斷和切除模型中,下游的血管、平滑肌失神經(jīng)支配,往往會發(fā)生不可逆的生理功能缺失,因此,建議當(dāng)研究終點為海綿體組織形態(tài)學(xué)、分子生物學(xué)改變等,可選用橫切或切除模型。目前臨床上治療神經(jīng)性ED以磷酸二酯酶-5抑制劑最為常見,國內(nèi)常常會加用中藥以調(diào)節(jié)氣血,輔助恢復(fù)勃起功能,其余諸如干細(xì)胞療法、激酶抑制劑等大多仍處于臨床前實驗階段,目前應(yīng)用較少,仍需進(jìn)一步深入研究。
參 考 文 獻(xiàn)
[1]Irwin GM.Erectile dysfunction[J].Prim Care,2019,46(2):249-255.DOI:10.1016/j.pop.2019.02.006.
[2]Glina S,Cohen DJ,Vieira M.Diagnosis of erectile dysfunction [J].Curr Opin Psychiatry,2014,27(6):394-399.DOI:10.1097/YCO.0000000000000097.
[3]Wu YN,Chen KC,Liao CH,et al.Spontaneous regeneration of nerve fiber and irreversibility of corporal smooth muscle fibrosis after cavernous nerve crush injury:evidence from serial transmission electron microscopy and intracavernous pressure[J].Urology,2018,118:98-106.DOI:10.1016/j.urology.2017.10.008.
[4]Haglind E,Carlsson S,Stranne J,et al.LAPPRO steering committee.Urinary incontinence and erectile dysfunction after robotic versus open radical prostatectomy:a prospective,controlled,nonrandomised trial[J].Eur Urol,2015,68(2):216-225.DOI:10.1016/j.eururo.2015.02.029.
[5]Chen Z,Han X,Ouyang X,et al.Transplantation of induced pluripotent stem cell-derived mesenchymal stem cells improved erectile dysfunction induced by cavernous nerve injury[J].Theranostics,2019,9(22):6354-6368.DOI:10.7150/thno.34008.
[6]Matsui H,Sopko NA,Campbell JD,et al.Increased level of tumor necrosis factor-alpha (TNF-α) leads to downregulation of nitrergic neurons following bilateral cavernous nerve injury and modulates penile smooth tone[J].J Sex Med,2021,18(7):1181-1190.DOI:10.1016/j.jsxm.2021.05.001.
[7]Li H,Chen L,Wang T,et al.The effect of cavernous nerve traction on erectile function in rats[J].PLoS One,2017,12(10):e0186077.DOI:10.1371/journal.pone.0186077.
[8]Sezen SF,Hoke A,Burnett AL,et al.Immunophilin ligand FK506 is neuroprotective for penile innervation[J].Nat Med,2001,7(10):1073-1074.DOI:10.1038/nm1001-1073.
[9]Cong R,Wang Y,Wang Y,et al.Comprehensive analysis of lncRNA expression pattern and lncRNA-miRNA-mRNA network in a rat model with cavernous nerve injury erectile dysfunction[J].J Sex Med,2020,17(9):1603-1617.DOI:10.1016/j.jsxm.2020.05.008.
[10]Chalasani V,Williams AK,Chin J.Contemporary results of focal therapy for prostate cancer using cryotherapy[J].Panminerva Med,2010,52(3):217-222.
[11]Yang R,F(xiàn)ang F,Wang J,et al.Adipose-derived stem cells ameliorate erectile dysfunction after cavernous nerve cryoinjury[J].Andrology,2015,3(4):694-701.DOI:10.1111/andr.12047.
[12]Cho MC,Park K,Chai JS,et al.Involvement of sphingosine-1-phosphate/RhoA/Rho-kinase signaling pathway in corporal fibrosis following cavernous nerve injury in male rats[J].J Sex Med,2011,8(3):712-721.DOI:10.1111/j.1743-6109.2010.02147.x.
[13]Ying C,Hu W,Cheng B,et al.Erectile function restoration after repair of resected cavernous nerves by adipose-derived stem cells combined with autologous vein graft in rats[J].Cell Mol Neurobiol,2014,34(3):393-402.DOI:10.1007/s10571-013-0024-7.
[14]Li M,Yuan YM,Yang BC,et al.Comparative study of intracavernous pressure and cavernous pathology after bilateral cavernous nerve crushing and resection in rats[J].Asian J Androl,2020,22(6):629-635.DOI:10.4103/aja.aja_10_20.
[15]Lewis JE,Walker DF,Beckett SD,et al.Blood pressure within the corpus cavernosum penis of the bull[J].J Reprod Fertil,1968,17(1):155-156.DOI:10.1530/jrf.0.0170155.
[16]Lee J,Kim SW,Cho MC.Combination therapy with a JNK inhibitor and hepatocyte growth factor for restoration of erectile function in a rat model of cavernosal nerve injury:comparison with a JNK inhibitor alone or hepatocyte growth factor alone[J].Int J Mol Sci,2021,22(23):12698.DOI:10.3390/ijms222312698.
[17]Gu SJ,Li M,Yuan YM,et al.A novel flavonoid derivative of icariside II improves erectile dysfunction in a rat model of cavernous nerve injury[J].Andrology,2021,9(6):1893-1901.DOI:10.1111/andr.13065.
[18]Wu CJ,F(xiàn)u FD,Qin F,et al.Vacuum therapy ameliorates erectile dysfunction in bilateral cavernous nerve crush rats by inhibiting apoptosis and activating autophagy[J].Asian J Androl,2021,23(3):273-280.DOI:10.4103/aja.aja_79_20.
[19]Ouyang X,Han X,Chen Z,et al.MSC-derived exosomes ameliorate erectile dysfunction by alleviation of corpus cavernosum smooth muscle apoptosis in a rat model of cavernous nerve injury[J].Stem Cell Res Ther,2018,9(1):246.DOI:10.1186/s13287-018-1003-1.
[20]Wang Y,Meng XH,Zhang QJ,et al.Losartan improves erectile function through suppression of corporal apoptosis and oxidative stress in rats with cavernous nerve injury[J].Asian J Androl,2019,21(5):452-459.DOI:10.4103/aja.aja_8_19.
[21]Fall PA,Izikki M,Tu L,et al.Apoptosis and effects of intracavernous bone marrow cell injection in a rat model of postprostatectomy erectile dysfunction[J].Eur Urol,2009,56(4):716-725.DOI:10.1016/j.eururo.2008.09.059.
[22]Senbel AM,Mostafa T.Yohimbine enhances the effect of sildenafil on erectile process in rats[J].Int J Impot Res,2008,20(4):409-417.DOI:10.1038/sj.ijir.3901630.
[23]燕浩,王瓊,肖冬冬,等.勃起功能障礙的動物模型建立及檢測評價[J].中華男科學(xué)雜志,2017,23(11):1032-1037.DOI:10.13263/j.cnki.nja.2017.11.013.
[24]Bella AJ,Lin G,Lin CS,et al.Nerve growth factor modulation of the cavernous nerve response to injury[J].J Sex Med,2009,6(Suppl 3):347-352.DOI:10.1111/j.1743-6109.2008.01194.x.
[25]Haney NM,Talwar S,Akula PK,et al.Insulin-like growth factor-1-loaded polymeric poly(lactic-co-glycolic) acid microspheres improved erectile function in a rat model of bilateral cavernous nerve injury[J].J Sex Med,2019,16(3):383-393.DOI:10.1016/j.jsxm.2018.12.018.
[26]Ma K,Zhao F,Ye MY,et al.Neuroprotective effect of Hongjing I granules on erectile dysfunction in a rat model of bilateral cavernous nerve injury[J].Biomed Pharmacother,2020,130:110405.DOI:10.1016/j.biopha.2020.110405.
[27]Park J,Chai JS,Kim SW,et al.Inhibition of Jun N-terminal kinase improves erectile function by alleviation of cavernosal apoptosis in a rat model of cavernous nerve injury[J].Urology,2018,113:253.e9-253.e16.DOI:10.1016/j.urology.2017.11.040.
[28]Ying CC,Yang M,Wang Y,et al.Neural-like cells from adipose-derived stem cells for cavernous nerve injury in rats[J].Neural Regen Res,2019,14(6):1085-1090.DOI:10.4103/1673-5374.25063.
(收稿日期:2022-02-25)
基金項目:浙江省衛(wèi)生健康科技計劃項目(2021KY449)

