阿爾茨海默病的影響因素及其預測模型構建
吳天晨,楊卉,梁艷
阿爾茨海默病(Alzheimer disease,AD)是最常見的神經退行性疾病之一,也是癡呆最常見的病因,目前全球約有癡呆患者5 000萬例,且預計到2050年將上升到1.52億;其以散發型病例為主,病因多樣,與環境和遺傳因素密切相關[1]。由于AD起病隱匿且缺乏治療方法和早期診斷工具,故早期確診AD較為困難。AD是一個連續的病理生理學過程,其臨床前期階段長達數十年,且檢測腦脊液相關生物學標志物或腦組織病理學檢查均為有創檢查,故對于大多數進行健康篩查的人群而言,較難接受[2]。對于輕度認知障礙患者,延遲確診可導致治療的滯后,進而直接影響患者預后。因此,構建AD預測模型能在患者出現明顯認知障礙前預測AD的發生風險,可對該病起到預警作用且能指導高危患者進行早期防治,具有較大的臨床意義。基于此,本研究旨在探討AD的影響因素并構建其預測模型。
1 對象與方法
1.1 研究對象 選取2019年1月至2021年1月就診于南京市中醫院的61例AD患者作為AD組,另選取同期于該院體檢中心進行體檢的健康者122例作為健康組。AD組納入標準:符合美國國家衰老研究院-阿爾茨海默病協會制定的AD診斷標準[3],即簡易精神狀態檢查量表〔文盲≤17分,小學≤20分,中學(包括中專)≤22分〕、Blessed癡呆評定量表(>10分可認為有癡呆)或類似檢查診斷為癡呆;認知缺陷至少累積2個認知領域,無意識障礙。AD組排除標準:(1)嚴重腦血管病造成的認知障礙或癡呆、意識障礙、譫妄、短暫性意識障礙及藥物、毒物引起的認知障礙;(2)入院72 h內血生化指標不完整者。健康組納入標準:年齡>45歲。本研究免除倫理審查。
1.2 觀察指標 通過南京市中醫院臨床大數據平臺收集所有研究對象的基線資料,包括性別、年齡、高血壓史、糖尿病史、冠心病史、載脂蛋白E(apolipoprotein E,ApoE)基因分型、實驗室檢查指標〔TG、TC、LDL-C、HDL-C、脂蛋白a、載脂蛋白A1、載脂蛋白B、促甲狀腺激素(thyroid-stimulating hormone,TSH)、游離甲狀腺素(free thyroxine,FT4)、游離三碘甲狀腺原氨酸(free triiodothyronine,FT3)、總三碘甲狀腺原氨酸(total triiodothyronine,TT3)、總甲狀腺素(total thyroxine,TT4)〕。
1.3 統計學方法 采用R 4.2.1統計學軟件進行數據分析。計數資料以相對數表示,組間比較采用χ2檢驗;偏態分布的計量資料以M(P25,P75)表示,組間比較采用Wilcoxon非參數檢驗;采用mice包進行缺失值分析及多重插補;采用LASSO回歸[4]進行自變量的篩選,調整懲罰系數,以lambda.1se為截斷點篩選自變量[5-6];采用多因素Logistic回歸分析探討AD的影響因素,自變量的選擇方法為逐步向后回歸法,并根據AD的影響因素構建預測模型;繪制ROC曲線以探討預測模型對AD的預測價值。以P<0.05為差異有統計學意義。
2 結果
2.1 基線資料 兩組TG、LDL-C、HDL-C、脂蛋白a、載脂蛋白A1、TSH、FT4、TT3比較,差異無統計學意義(P>0.05)。兩組性別、年齡、ApoE基因分型、TC、載脂蛋白B、FT3、TT4比較,差異有統計學意義(P<0.05),見表1。
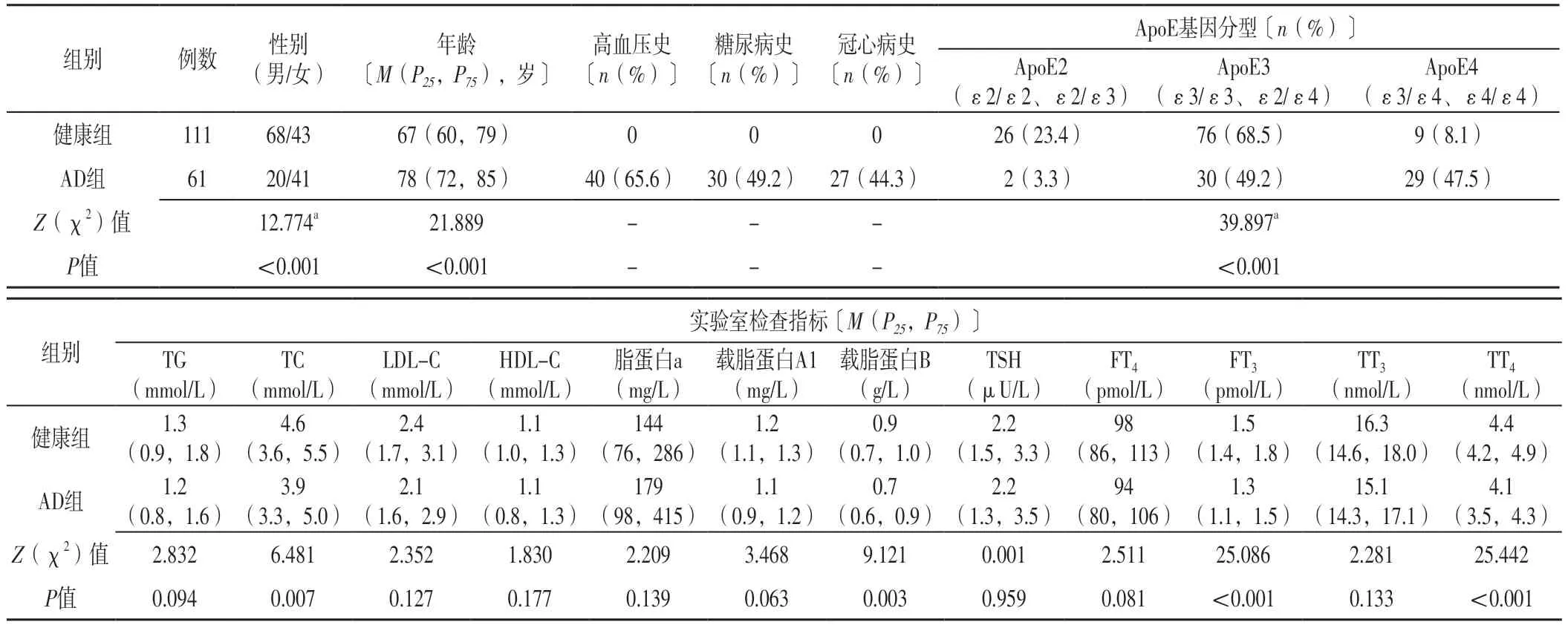
表1 兩組基線資料比較Table 1 Comparison of baseline data between the two groups
2.2 LASSO回歸 將基線資料的18個變量納入LASSO回歸模型,計量資料為實測值,分類變量進行賦值,即性別:男=1,女=0;高血壓史:有=1,無=0;糖尿病史:有=1,無=0;冠心病史:有=1,無=0;ApoE基因分型:ApoE2(ε2/ε2、ε2/ε3)=2、ApoE3(ε3/ε3、ε2/ε4)=3、ApoE4(ε3/ε4、ε4/ε4)=4,構建LASSO交叉驗證圖及回歸路徑圖。通過調整懲罰系數,以lambda.1se為截斷點篩選出性別、年齡、ApoE基因分型、FT3、TT35個系數不為零的因子,見圖1~2。
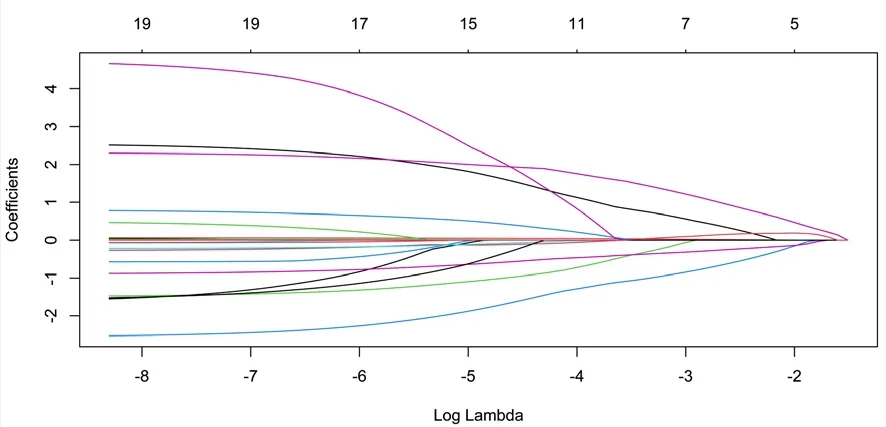
圖2 LASSO回歸路徑圖Figure 2 LASSO regression path diagram
2.3 AD影響因素的多因素Logistic回歸分析及其預測模型的構建 以LASSO回歸篩選出的4個變量為自變量(賦值不變,由于FT3與TT3存在共線性,將其剔除),以研究對象是否患有AD為因變量(賦值:是=1,否=0),進行多因素Logistic回歸分析,結果顯示,性別、年齡、ApoE基因分型、TT3是AD的獨立影響因素(P<0.05),見表2。基于上述影響因素構建預測模型:P=ex/(1+ex),其中x=-5.170+1.267×男性+0.058×年齡+2.389×ApoE3(ε3/ε3、ε2/ε4)+4.572×ApoE4(ε3/ε4、ε4/ε4)-2.059×TT3。
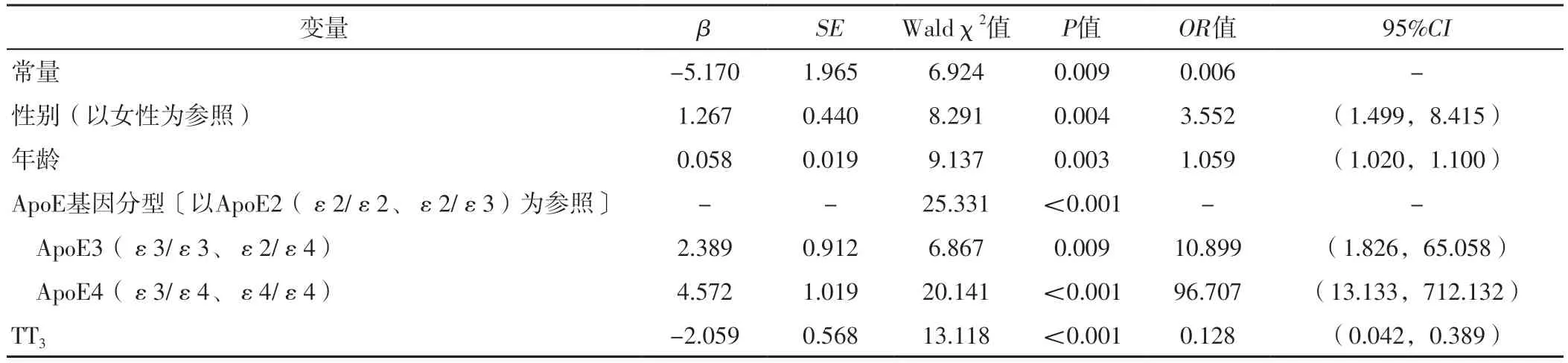
表2 AD影響因素的多因素Logistic回歸分析Table 2 Multivariate Logistic regression analysis of the influencing factors of AD
2.4 ROC曲線分析 ROC曲線分析結果顯示,預測模型預測AD的AUC為0.885〔95%CI(0.832,0.938)〕,見圖3。
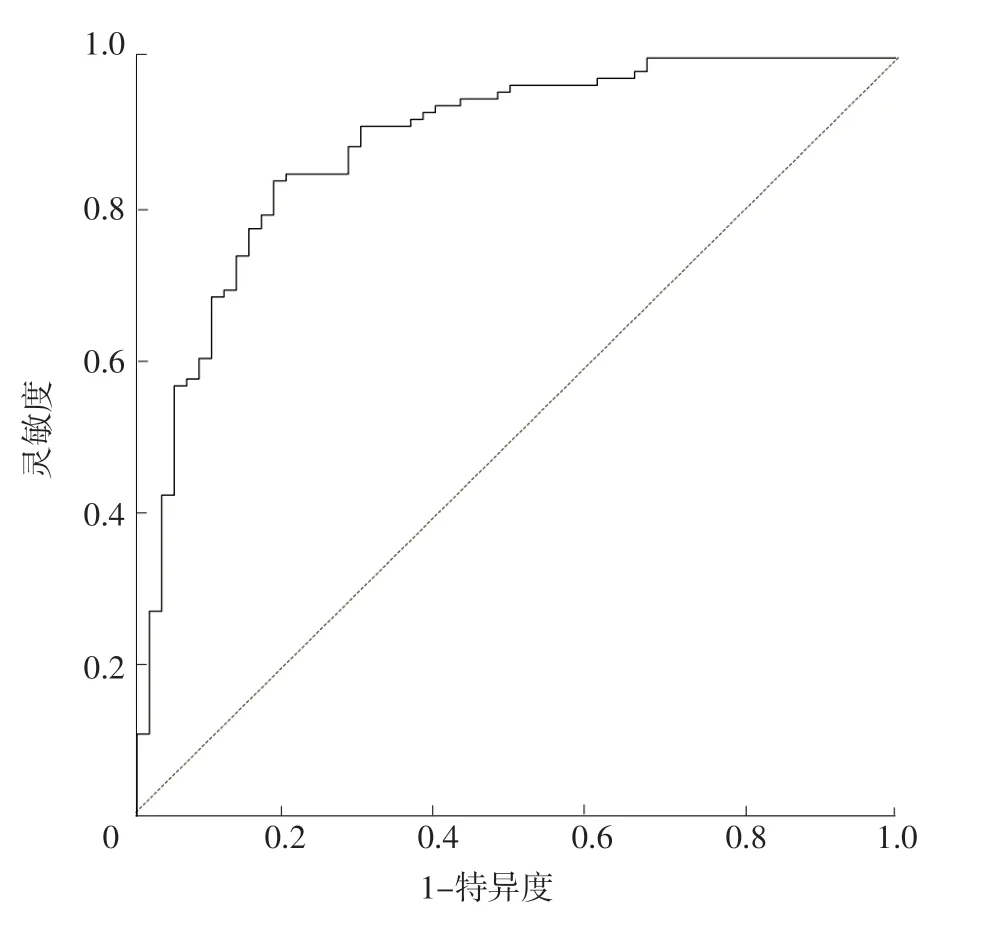
圖3 預測模型預測AD的ROC曲線Figure 3 ROC curve of prediction model for predicting AD
3 討論
AD是一種漸進的、不可逆轉的神經退行性疾病,其發病隱匿,會導致神經元的退變和凋亡,迄今為止尚無有效的治療策略。而盡早篩查臨床前期AD并進行早期干預,對降低AD發生風險及改善AD患者預后具有重要意義[7]。既往研究顯示,血管危險因素與AD患者腦內病理改變無明顯相關性[8-10]。干預LIVINGSTON等[11]薈萃分析結果顯示的9個癡呆影響因素(受教育程度低、高血壓、聽力障礙、吸煙、肥胖、抑郁、缺乏運動、糖尿病和低社會接觸)及近年來新發現的3個癡呆影響因素(過量飲酒、腦外傷和空氣污染),理論上可以預防或延緩癡呆,但上述影響因素一般是針對非AD患者,且大部分AD患者通過生活方式干預收效甚微。因為這些針對血管損傷的二級預防措施可能無法有效預防AD的發生及腦內β淀粉樣蛋白(β-amyloid,Aβ)的異常沉積,故需要從其他角度尋找AD的預防措施,如構建早期AD的預測模型,然后可以針對AD發病風險高的人群采取針對性的預防措施。本研究LASSO回歸及多因素Logistic回歸分析結果顯示,性別、年齡、ApoE基因分型、TT3是AD的影響因素,并據此構建了AD的預測模型。
有研究者認為,性別與AD的發病密切相關,女性比男性更容易罹患AD,盡管男性和女性的Aβ負荷相似,但女性可能具有更高的Tau蛋白負荷[12]。且目前的流行病學數據顯示,AD患者中約2/3是女性[13]。但LIESINGER等[14]研究指出,在神經病理學診斷的AD患者中,男性與女性的AD發病率比較,差異無統計學意義,且男性AD患者發生認知障礙的時間早于女性,其特點為病程短、死亡率高、非典型臨床癥狀隱匿,考慮男性AD發病率低可能與其臨床癥狀隱匿性高、報道較少有關。但本研究結果顯示,男性是AD的危險因素,考慮與以下因素有關:(1)既往研究顯示,雌激素為AD的保護因素[15],雖然絕經期婦女認知功能下降較男性更為明顯,但絕經前女性AD發病風險可能低于男性;(2)此外,還可能與男性吸煙、飲酒者占比更高有關。在人口學資料中,AD與年齡的關系密切,隨著年齡增長,AD患者記憶力和認知能力均會出現進行性下降,分析原因可能與腦神經元的自由基積累、脂代謝紊亂、不可逆轉的神經變性及腦萎縮有關[16]。AD最強的危險因素是高齡[17]。
ApoE是大腦中的主要膽固醇載體,可參與神經元生長、細胞膜修復和重塑、清除和降解Aβ以及減輕神經炎癥[18]。ApoE2(ε2/ε2、ε2/ε3)、ApoE3(ε3/ε3、ε2/ε4)、ApoE4(ε3/ε4、ε4/ε4)是ApoE的3個等位基因。研究表明,與攜帶ApoE3 ε3/ε3的患者相比,攜帶ApoE3 ε2/ε4的患者罹患AD的風險升高1.64倍,攜帶ApoE 4 ε3/ε4的患者罹患AD的風險升高2.63倍,而攜帶ApoE4 ε4/ε4的患者罹患AD的風險升高近14.00倍[19]。近年研究認為,ApoE4(ε3/ε4、ε4/ε4)是導致遲發型AD最強的遺傳風險因素,ApoE4可誘導神經元產生淀粉樣蛋白斑塊和神經原纖維纏結,而ApoE2可以預防或逆轉上述過程的發生,進而發揮神經保護作用[20]。相關研究表明,相對于ApoE2和ApoE3,ApoE4在促進Aβ肽異常聚集而形成Aβ寡聚體和原纖維的同時也抑制Aβ從大腦清除,延長了其消除t1/2,并且在神經元間質液中抑制降解酶對其進行降解[21]。相較于其他ApoE亞型,ApoE2具有較明顯的神經保護作用;而與ApoE2相對應的ApoE4對AD的發生發展起到推動作用,并且隨著年齡增長,其影響逐漸增強。KIM等[22]將研究對象按照年齡分為三組(<65歲、65~74歲和≥75歲),通過比較各年齡組ApoE4攜帶者與未攜帶ApoE4者的腦皮質厚度和認知功能發現,隨著年齡增長,ApoE4攜帶者首先于額葉和外側裂出現萎縮,進而于內側顳葉出現萎縮,導致語言、視覺空間和額葉功能出現進展性的減退;而未攜帶ApoE4者上述現象的出現時間延遲,且相應的癥狀出現更晚或幾乎不出現。
由自身甲狀腺合成的三碘甲狀腺原氨酸占體內TT3的10%~20%,由TT4脫碘轉化成的三碘甲狀腺原氨酸占TT3的80%~90%。血清中絕大多數三碘甲狀腺原氨酸與血漿中的特異蛋白結合,僅極少數處于游離狀態。FT3能透過細胞膜進入組織細胞,進而發揮生理效應,其濃度與組織中的三碘甲狀腺原氨酸濃度一致。研究表明,低三碘甲狀腺原氨酸或者低FT3會導致情緒障礙及抑郁癥的發生[23],老年人出現重度抑郁是其罹患AD的危險因素。抑郁狀態及抑郁癥和長期低落的情緒會造成癡呆的提前出現[24]。FT3的下降可能是造成癡呆發生的一個重要因素[25],但在本研究中,考慮FT3是TT3的一部分,且其含量低,二者存在共線性[26],故未將FT3納入多因素Logistic回歸分析。血清三碘甲狀腺原氨酸在組織中主要與血漿中的特異蛋白結合,基本很少發揮作用。所以FT3可能是真正對癡呆起作用的因素。GE等[27]一項前瞻性橫斷面研究發現,FT3水平可影響腦脊液Aβ水平和Aβ42/Aβ40比值,是AD的重要預測因子,在甲狀腺功能正常的情況下,血清低水平FT3會導致AD的發生風險增加。CHANG等[28]研究顯示,AD患者的皮質醇水平較高,且三碘甲狀腺原氨酸及FT3水平低于正常水平,考慮下丘腦-垂體-甲狀腺軸與AD的發生相關。18F-FDG PET/CT掃描對神經退行性疾病具有診斷價值。CHIARAVALLOTI等[29]通過18F-FDG PET/CT掃描檢測AD患者顱內葡萄糖消耗水平,結果顯示,AD患者TSH、FT3與顱內葡萄糖消耗之間存在相關關系,AD患者表現出下丘腦-垂體-甲狀腺軸的異常生物反饋調節,并且在前扣帶皮質和內側額葉回的葡萄糖消耗水平與體內游離三碘甲狀腺素呈現同步關系,提示前扣帶和額葉的皮質功能障礙可能會影響AD患者血清TSH水平。上述研究提示,血清甲狀腺功能指標可能與AD發病相關,故本研究建模時納入了血清甲狀腺功能相關指標。本研究結果顯示,TT3是AD的影響因素,但FT3與TT3為從屬關系,故本研究與上述研究結論并不相悖。而甲狀腺激素是否會對Aβ的生成起到抑制作用,需要進一步研究論證。本研究ROC曲線分析結果顯示,預測模型預測AD的AUC為0.885〔95%CI(0.832,0.938)〕,提示本研究構建的預測模型對AD具有一定預測價值。
綜上所述,性別、年齡、ApoE基因分型、TT3是AD的影響因素,而根據上述影響因素構建的預測模型對AD發生具有一定預測價值。但本研究為小樣本量、單中心研究,根據10倍EPV原則[30],AD相關臨床指標的納入受到限制,未來可通過擴大樣本量,增加AD發病風險因素如受教育程度、焦慮抑郁等,以構建更加穩健的預測模型,且后期應對構建的預測模型進行驗證。
作者貢獻:吳天晨、楊卉進行文章的構思與設計,撰寫、修訂論文,負責文章的質量控制及審校;楊卉進行研究的實施與可行性分析,對文章整體負責,監督管理;吳天晨、梁艷進行資料收集;梁艷進行資料整理;吳天晨進行統計學處理。
本文無利益沖突。

