靛玉紅的提取分離和藥理研究進展
馬夢雪 寧 夏 劉華石
黑龍江省中醫藥科學院,黑龍江 哈爾濱 150036
靛玉紅(Indirubin)又名玉紅片、炮彈樹堿B,在結構上稱為2-(2-氧代-1H-吲哚-3-亞基)-1H-吲哚-3-酮,是一種新型雙吲哚類化合物,具有一定弱堿性,其分子式為C16H10N2O2,相對分子質量262.2628。化學結構如圖1所示。

圖1 靛玉紅化學結構圖
靛玉紅為暗紅色針狀結晶,密度1.417 g/cm3,熔點350 ℃,溶于乙酸乙酯、丙酮、氯仿、乙醚,微溶于乙醇,不溶于水[1]。天然靛玉紅主要存在于十字花科植物菘藍(IsatisindigoticaFort.)的根和葉即板藍根(Isatidis radix)和大青葉(Isatidis folium),爵床科植物馬藍(Baphicacanthuscusia(Nees)Bremek.)的根和根莖即南板藍根以及蓼科植物蓼藍(PolygonumtinctoriumAit.)即大青葉這些藥用植物中。靛玉紅具有抗癌作用,由于其獨特的化學結構可以阻斷腫瘤細胞 DNA的合成而具有抗腫瘤活性,且毒副作用很低,所以有大量的國內外研究報道靛玉紅及其衍生物的各種藥理學作用和機理,如抗菌消炎、抗增殖、抗腫瘤和抗病毒等生物學效應[2-8],受到越來越多的關注。隨著科技的進步發展,靛玉紅提取分離也由有效成份損失過多的水煎煮醇沉逐步變成經濟實惠且能提高提取率的方法。本文綜述了近年靛玉紅的提取分離及藥理作用的研究進展,為后續的產品開發和質量控制提供依據。
1 靛玉紅的提取分離
提取分離板藍根和南板藍根中的靛玉紅可采用回流提取法[9-10]和超聲輔助提取法[11],兩種方法提取效率較高、操作相對簡便、成本稍低廉、效率也較高,減壓輔助提取[12]和真空輔助熱回流提取法[13],可以在低溫下提取靛玉紅,不但節能、提取效率更高,還可以防止有效成分氧化。復方板藍根等已上市制劑,靛玉紅常采用水煎煮或者回流提取[14],因此有較大的工藝提升空間。
靛玉紅常以乙醇、乙酸乙酯等有機試劑作為提取溶劑,采用回流或超聲法進行提取,提取液采用氧化鋁和硅膠G干柱等柱色譜進行分離和純化[15-20],靛玉紅的純度可高達97.78%。已上市的芪藍囊病飲中靛玉紅用氯仿振搖來提取[21],北京市《醫療單位制劑規程》收載的口腔潰瘍散II號采用N,N-二甲基甲酰胺作為靛玉紅的提取溶劑,采用超聲提取進行[22]。相關提取工藝條件和靛玉紅的提取率見表1。
2 靛玉紅藥理作用研究
2.1 抗癌作用
2.1.1 慢性粒細胞白血病 靛玉紅是我國首創的可以對抗白血病的中藥提取物,現在主要用于治療慢性粒細胞白血病(CML)。高淑香[23]臨床采用靛玉紅治療26例CML患者,發現血液學緩解效果較好,總血液學緩解16例61.5%。Zhou Chao[24]和劉存等[25]通過網絡藥理學和分子對接技術篩選出青黛中的靛玉紅可以通過改變靶蛋白PIK3CA,MYC,JAK2,和TP53的表達在CML耐藥中發揮作用,JAK2很可能是關鍵節點,降低其表達來干預K562細胞的增殖。
2.1.2 乳腺癌 吳瓊等[26]發現靛玉紅可以通過抑制細胞增值或者引起凋亡來抑制人乳腺癌細胞MCF-7的生長,其機制可能是通過降低P-gp耐藥蛋白的表達來實現的。況秀平[27]進行體內外實驗,發現靛玉紅對乳腺癌有抑制作用,機制研究表明,是通過促進GSK-3β的Ser 9位點磷酸化上調PTGS2,誘導乳腺癌細胞發生鐵死亡作用來抗乳腺癌。
2.1.3 前列腺癌 魏云飛等[28]研究靛玉紅對雄激素非依賴性前列腺癌PC-3細胞的殺傷作用及可能的機制,發現靛玉紅降低前列腺癌細胞的存活率呈濃度依賴性,且能抑制細胞周期進展關鍵調控蛋白cyclin D1,及與之相關Wnt信號通路的下游基因c-myc的表達。
2.1.4 神經膠質瘤 張濤等[29]和Li Zhaohui等[30]先后都發現靛玉紅可以通過下調抗凋亡蛋白Bcl-2表達來實現對神經膠質瘤的抑制作用。此外,后者還發現靛玉紅對所有膠質瘤細胞均有抑制作用,其中對U87和U118膠質瘤細胞具有抑制生長的作用,機制為自噬和凋亡性細胞死亡,創面愈合實驗也表明,靛玉紅顯著降低U87和U118細胞的遷移能力,具有抗轉移潛能。
2.1.5 卵巢癌 Chen Lihong等[31]研究靛玉紅在人卵巢癌細胞增殖中的作用時,發現靛玉紅能致使磷酸化的STAT3水平降低,抑制下游的促生存蛋白,提高促凋亡蛋白來抑制卵巢癌細胞活性,表明靛玉紅在治療人類卵巢癌方面有一定潛力,有待進一步研究開發。
2.2 抗炎作用
2.2.1 潰瘍性結腸炎 李楠等[32]研究靛玉紅對三硝基苯磺酸誘導的大鼠潰瘍性結腸炎的治療作用,發現大鼠DAI評分降低,結腸HE染色病理顯示炎癥細胞明顯減少,TGF-β1水平降低,ITF mRNA表達升高,說明靛玉紅有抑制炎癥的效果,可以改善UC模型大鼠癥狀、結腸病理形態。臧思源[33]應用脂多糖誘導人正常結腸上皮細胞構建潰瘍性結腸炎細胞模型,發現靛玉紅能夠降低促炎細胞因子TNF-α、IL-12、IL-6表達量的同時增加抑炎細胞因子IL-4的表達量,還可抑制NF-κB和PI3K/AKT信號通路活性,作用于多個治療靶點。Naruo Tokuyasu等[34]和梁艷妮等[35]先后研究靛玉紅對葡聚糖硫酸鈉(DSS)所導致的小鼠潰瘍性結腸炎模型的影響,發現DAI評分降低,結腸組織損傷減輕,炎性細胞浸潤減少,IL-6水平顯著降低。此外,后者還發現促炎細胞因子IL-8、IL-1β和TNF-α水平顯著降低,抗炎細胞因子IL-10水平升高,16S rRNA基因測序結果顯示,小鼠腸道菌群多樣性升高,在門水平主要表現為擬桿菌門與厚壁菌門比例回升,都說明了靛玉紅可以用于治療潰瘍性結腸炎。
2.2.2 牛皮癬(銀屑病) Xue Xiaochun等[36]研究靛玉紅對銀屑病皮損的抑制作用,發現CD274是靛玉紅介導的小鼠銀屑病樣皮損效應的調節因子,有助于減輕小鼠銀屑病樣皮損。Nguyen Ly Thi Huong等[37]發現靛玉紅可能通過降低細胞內ROS的生成及其細胞中ICAM-1等炎性因子的生成,和降低IL-22處理的HaCaT細胞進入S期的比例以及下調銀屑病皮損中K16的表達,對IL-22誘導的銀屑病模型起到治療作用。
2.2.3 類風濕性關節炎 Huang Mingcheng等[38]旨在探討靛玉紅對類風濕患者成纖維樣滑膜細胞(RA FLS)的抑制作用,發現靛玉紅可以降低RA-FLSs的遷移、侵襲、炎癥和增殖,且證實在細胞遷移過程中抑制了板狀偽足的形成,深入了解分子機制還發現靛玉紅抑制了PAK1和MAPK的活性。
2.2.4 乳腺炎 賴金倫[39]研究發現靛玉紅可以通過抑制TLR4 介導的 NF-κB和 MAPKs信號通路抑制 IL-1β、IL-6、TNF-α、COX-2和MPO的表達,發揮對 LPS 誘導小鼠乳腺炎的治療和保護作用,機制如圖2所示,發揮對 LPS 誘導 MMECs 凋亡的抑制作用,起到抗炎作用。
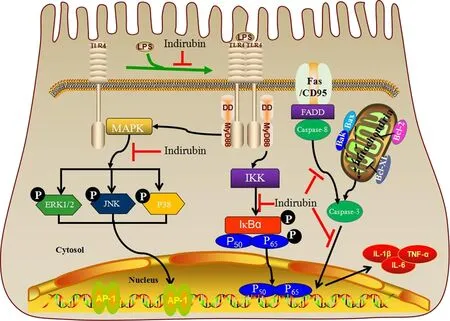
圖2 靛玉紅抑制TLR4介導的NF-κB和MAPK發揮對LPS誘導MMECs和小鼠乳腺炎具有防治作用示意圖
2.3 抗病毒 Yang Ying等[40]將HepG2.2.15細胞系作為體外細胞模型首次證實了靛玉紅具有抗病毒能力,能有效抑制HBV抗原(HBsAg和HBeAg)和HBV DNA的分泌,還能顯著降低HBsAg和PTB蛋白水平,可用于治療HBV感染。 Jie Chong等[41]建立了小鼠H1N1易感性模型,發現靛玉紅降低了小鼠流感病毒的易感性、死亡率且減輕小鼠抑制應激模型的肺損傷,機制如圖3所示,促進了干擾素-β和干擾素誘導跨膜蛋白3的表達,表明其可能是一種治療流感的候選藥物。

圖3 靛玉紅誘導的H1N1發病機制在易感模型中的衰減機制示意圖
2.4 其他
2.4.1 心臟保護作用 Zheng Suxia等[42]研究了靛玉紅對異丙腎上腺素(ISO)誘導的Wistar大鼠心肌梗死心臟標志物的保護作用,發現LDH(1、2)同工酶條帶表達增強,心臟和血漿中LPO的水平改善,證實了其顯著的保護作用,與靛玉紅治療大鼠的組織病理學研究結果一致,表明大鼠心肌梗死明顯恢復。
2.4.2 治療血液病-血小板減少 Zhao Yajing等[43]研究發現靛玉紅能顯著增加Treg的數量和功能,并以劑量依賴性的方式抑制效應T細胞的激活,還可恢復ITP患者CD4+T細胞上PD1和PTEN的表達,導致隨后AKT/mTOR通路的減弱,確定了靛玉紅通過PD1/PTEN/AKT信號通路調節CD4+T細胞的穩態來治療ITP的一種潛在新機制。Shao Kai等[44]從19名ITP成年患者和20名健康對照(HCs)中分離出PBMCs,發現用靛玉紅進行治療對PBMC活力沒有細胞毒性作用,顯著增強了ITP患者PBMCs中MPL表達,抑制TNF表達從而降低ITP的炎癥反應而在血小板生成中發揮直接作用。
2.4.3 治療肺纖維化 Wang Qi等[45]研究靛玉紅對博萊霉素(BLM)誘導的肺纖維化的影響,發現靛玉紅治療后的小鼠存活率明顯提高,并呈劑量依賴性,且顯著減輕炎性細胞的浸潤,其機制可能是通過抑制TGF-β/Smad信號以劑量依賴性的方式抑制成纖維細胞向肌成纖維細胞分化。
3 結語
隨著國內外對靛玉紅不斷的深入研究,新的藥理作用和機制被發現,市場及臨床對于靛玉紅的需求越來越大,探求經濟高效且簡潔的提取分離方法一直是研究的熱點,但目前多為實驗室級別,需要進行放大以便工業化生產,過程中必會產生一些問題,等待解決和完善。
靛玉紅雖有廣泛的藥理作用,但其在水和油中的溶解性低,口服吸收有限,生物利用度低,導致臨床療效較慢,對其進一步的應用和開發被限制。目前已有研究團隊研究出了很多增加溶解性和提高生物利用度的方法,例如合成新的衍生物,對靛玉紅3’位進行結構修飾,引入羥肟;藥對配伍間的增溶作用,青黛和甘草;以及新型的給藥系統,靛玉紅白蛋白納米粒、脂質體和自微乳等,這些都為靛玉紅后續的結構優化和劑型改進提供了依據。優化后的靛玉紅衍生物其分子機制和作用機理都不甚明確,可對此進行深入研究,為持續的新藥研發奠定基礎。

