我國(guó)進(jìn)口藥品管理制度對(duì)藥品檢驗(yàn)的影響和啟示
王 穎
(上海市藥品和醫(yī)療器械不良反應(yīng)監(jiān)測(cè)中心,上海 200040)
進(jìn)口藥品在充實(shí)藥品資源、保障用藥需求方面發(fā)揮了重要作用。我國(guó)不斷加強(qiáng)對(duì)進(jìn)口藥品的管理,進(jìn)口藥品管理工作邁進(jìn)了新的發(fā)展時(shí)期。目前,我國(guó)實(shí)施的《藥品進(jìn)口管理辦法》(以下簡(jiǎn)稱《辦法》)是由原國(guó)家食品藥品監(jiān)督管理局、海關(guān)總署于2003 年8 月共同頒布的。在國(guó)內(nèi)國(guó)際雙循環(huán)發(fā)展新格局、我國(guó)藥品監(jiān)管體制機(jī)制轉(zhuǎn)變、信息化數(shù)字化轉(zhuǎn)型進(jìn)程、政府“放管服”和優(yōu)化營(yíng)商環(huán)境等政策環(huán)境的不斷變化下,對(duì)進(jìn)口藥品相關(guān)管理制度進(jìn)行研究具有一定的必要性和緊迫性。在此,本研究中探討了我國(guó)進(jìn)口藥品管理制度對(duì)藥品檢驗(yàn)工作的影響和啟示。現(xiàn)報(bào)道如下。
1 我國(guó)進(jìn)口藥品監(jiān)管的理論與實(shí)踐基礎(chǔ)
1.1 我國(guó)藥品進(jìn)口管理的法規(guī)政策背景
我國(guó)已頒布一系列法規(guī)對(duì)進(jìn)口藥品的管理進(jìn)行完善。2003 年,原國(guó)家食品藥品監(jiān)督管理局、海關(guān)總署頒布了《辦法》,規(guī)范了我國(guó)進(jìn)口藥品的備案、報(bào)關(guān)、口岸檢驗(yàn)等工作;2012 年,原衛(wèi)生部、海關(guān)總署對(duì)2003 年版《辦法》按《中華人民共和國(guó)行政強(qiáng)制法》的要求進(jìn)行了兩處修改;2017 年,中國(guó)加入人用藥品技術(shù)要求國(guó)際協(xié)調(diào)理事會(huì)(ICH),為加快與國(guó)際通行規(guī)則接軌進(jìn)程,相關(guān)部門發(fā)布一系列藥品技術(shù)指導(dǎo)原則;2019 年,新修訂的《藥品管理法》《進(jìn)口藥材管理辦法》重新對(duì)進(jìn)口藥品審批檢驗(yàn)等作出相應(yīng)規(guī)定;2020 年,國(guó)家市場(chǎng)監(jiān)督管理總局頒布了《藥品注冊(cè)管理辦法》,對(duì)境外生產(chǎn)藥品的注冊(cè)申請(qǐng)作出規(guī)定。
2003 年版《辦法》分為總則、進(jìn)口備案、口岸檢驗(yàn)、監(jiān)督管理、附則五章共四十五條;2012 年,原衛(wèi)生部、海關(guān)總署對(duì)《辦法》進(jìn)行了修改,但對(duì)程序性規(guī)定等基本原則未作修改。《辦法》不是對(duì)藥品進(jìn)口全流程進(jìn)行管理的文件,除上述文件外,我國(guó)陸續(xù)發(fā)布了50 多部藥品進(jìn)口管理相關(guān)法規(guī)政策文件。部分文件見表1。
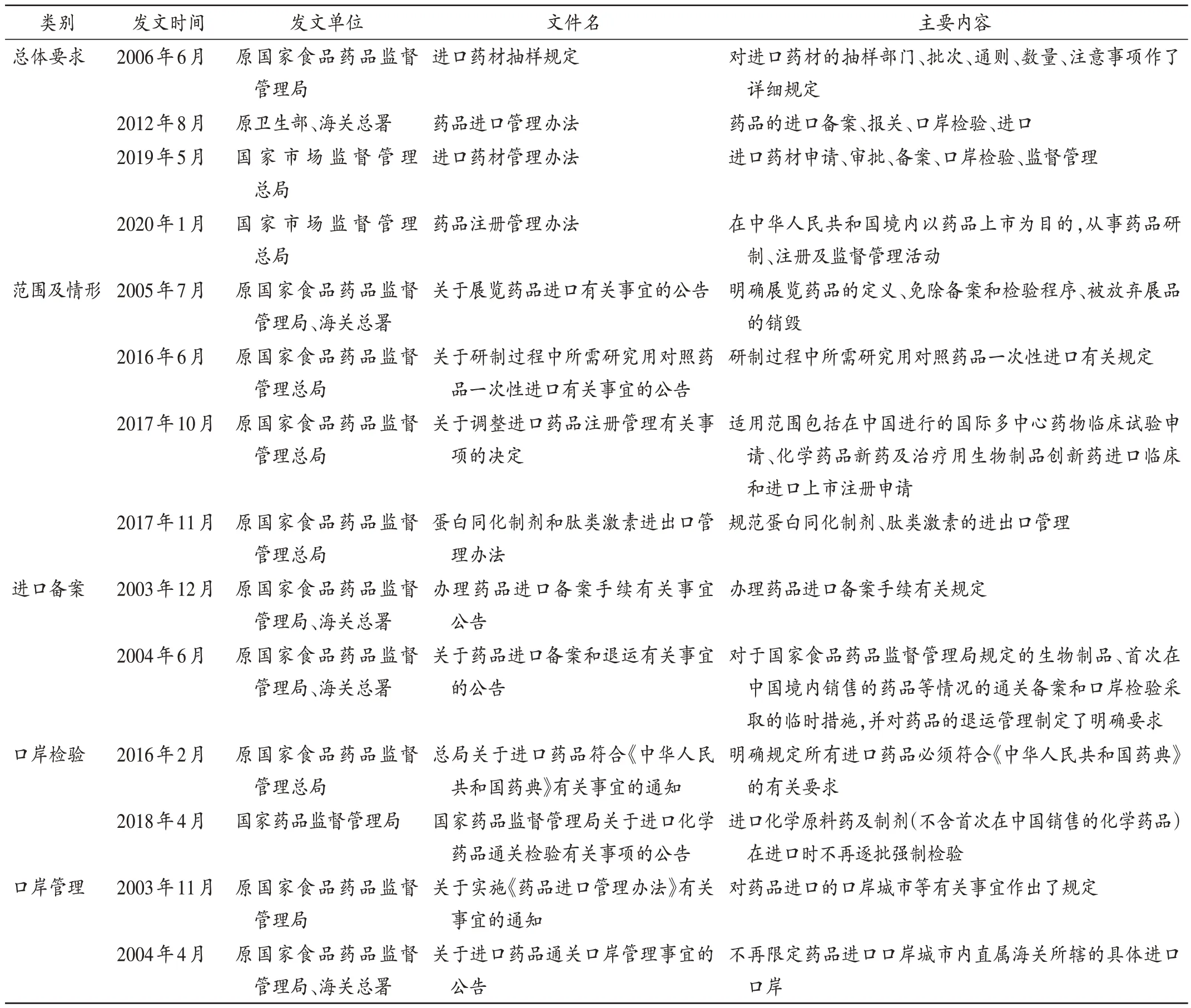
表1 部分現(xiàn)行藥品進(jìn)口管理相關(guān)規(guī)定Tab.1 Some current regulations on drug import management
1.2 “一帶一路”地區(qū)成為醫(yī)藥外貿(mào)新增長(zhǎng)點(diǎn)
近年來(lái),進(jìn)口藥品的貿(mào)易規(guī)模不斷擴(kuò)大。隨著我國(guó)一系列審評(píng)新政的實(shí)施,進(jìn)口藥品在國(guó)內(nèi)上市的速度加快,帶動(dòng)了市場(chǎng)擴(kuò)大和需求增長(zhǎng)。根據(jù)海關(guān)數(shù)據(jù)顯示,2017年至2021年,我國(guó)醫(yī)藥材及藥品進(jìn)口數(shù)量和進(jìn)口金額整體均呈增長(zhǎng)趨勢(shì);2021 年,我國(guó)醫(yī)藥材及藥品進(jìn)口數(shù)量達(dá)22.61 萬(wàn)噸,同比增長(zhǎng)3.1%;2021 年,我國(guó)醫(yī)藥材及藥品進(jìn)口金額達(dá)2 884 億元,同比增長(zhǎng)11.8%[1]。值得注意的是,我國(guó)與“一帶一路”沿線國(guó)家和地區(qū)的醫(yī)藥外貿(mào)比全球其他市場(chǎng)更加活躍。根據(jù)海關(guān)數(shù)據(jù)顯示,2019 年,我國(guó)從“一帶一路”地區(qū)和國(guó)家進(jìn)口的醫(yī)藥保健品達(dá)65 億美元,同比增長(zhǎng)26.1%[2]。近年來(lái),我國(guó)醫(yī)藥品的進(jìn)口量呈持續(xù)增長(zhǎng)態(tài)勢(shì)。
1.3 對(duì)進(jìn)口藥品分類有利于高效監(jiān)管
《辦法》及進(jìn)口相關(guān)法律、法規(guī)文件均未明確進(jìn)口藥品的定義和分類,業(yè)內(nèi)一般將在中國(guó)境外(或境內(nèi)關(guān)外)完成生產(chǎn),并申請(qǐng)進(jìn)入中國(guó)境內(nèi)的各類具有藥用用途的產(chǎn)品統(tǒng)稱為進(jìn)口藥品。從監(jiān)管實(shí)踐經(jīng)驗(yàn)出發(fā),進(jìn)口藥品在不同的劃分標(biāo)準(zhǔn)下呈現(xiàn)不同類型(表2)。但這無(wú)法代表所有分類,如臨床急需藥品就不包含在其中;且分類之間存在交叉,只能區(qū)分主要類型。故對(duì)進(jìn)口藥品進(jìn)行明確定義和區(qū)分,有利于在具體工作中進(jìn)行符合實(shí)際情況、高效、精準(zhǔn)的監(jiān)管。

表2 進(jìn)口藥品分類Tab.2 Different classifications of imported drugs
《商品名稱及編碼協(xié)調(diào)制度》(以下簡(jiǎn)稱HS)是國(guó)際貿(mào)易商品的分類體系,是我國(guó)為商品的國(guó)際貿(mào)易流通而設(shè)立的進(jìn)出口稅則,編碼原則側(cè)重于征稅的統(tǒng)計(jì)功能。海關(guān)不根據(jù)商品品名,而是以商品編碼(HS編碼)認(rèn)定商品分類。HS 編碼中以“藥品”命名的章節(jié)為第三十章,其中商品范圍涉及6個(gè)大類。另外,某些與藥品相關(guān)的商品散布于第三十章以外,包括第二十八章、第二十九章的原料藥,以及HS編碼以1302開頭的醫(yī)藥浸膏等。
首次進(jìn)口藥品的歸類工作非常關(guān)鍵。進(jìn)口藥品的化學(xué)成分和用途非常復(fù)雜,尤其是難以界定不屬于法定意義的藥品,如研發(fā)用物品(非上市藥品)和非藥用藥材,難免出現(xiàn)藥品監(jiān)管部門對(duì)商品歸類意見與海關(guān)稅則不一致的情形。即通關(guān)申報(bào)用途(如食用)與申報(bào)要求(如藥用)不一致[3],導(dǎo)致各個(gè)部門對(duì)查驗(yàn)文件的要求不一致,影響后續(xù)監(jiān)管處置。
2 現(xiàn)行管理制度對(duì)藥品檢驗(yàn)的影響
2.1 進(jìn)口藥品行業(yè)進(jìn)入有序發(fā)展的新階段
2003 年8 月公布的《辦法》對(duì)規(guī)范進(jìn)口藥品的通關(guān)備案、口岸檢驗(yàn)等管理工作起到了積極作用,但實(shí)施以來(lái)相繼出現(xiàn)了新的情況。一是近年來(lái)國(guó)家出臺(tái)和修訂了一系列法律法規(guī),《藥品管理法》《進(jìn)口藥材管理辦法》《藥品注冊(cè)管理辦法》等固化了藥品治理改革和創(chuàng)新的總體思路和制度框架,并進(jìn)一步規(guī)范相關(guān)制度,如追溯管理制度、藥品記錄與數(shù)據(jù)管理制度、《藥品技術(shù)審評(píng)質(zhì)量管理規(guī)范》(GRP)、藥物警戒制度等。二是我國(guó)醫(yī)藥行業(yè)加快了與國(guó)際標(biāo)準(zhǔn)接軌的步伐,2017 年我國(guó)加入ICH,相關(guān)部門發(fā)布了一系列藥品技術(shù)指導(dǎo)原則,進(jìn)一步縮小了藥物研發(fā)注冊(cè)要求和國(guó)際要求的差異,助推藥品研發(fā)和注冊(cè)進(jìn)入全球化時(shí)代。三是國(guó)家關(guān)于進(jìn)口藥品安全管理有了新要求,特別是為了保障國(guó)內(nèi)患者的重大疾病用藥需求,支持更多進(jìn)口醫(yī)藥產(chǎn)品進(jìn)入中國(guó)市場(chǎng),出臺(tái)了境外上市臨床急需藥品審批程序,優(yōu)化藥品臨床試驗(yàn)審批程序,取消進(jìn)口化學(xué)藥品逐批檢驗(yàn)等政策,進(jìn)一步加快境外新藥的上市速度。四是各地藥品監(jiān)管部門和海關(guān)部門在實(shí)施進(jìn)口藥品安全管理工作中積累了大量的實(shí)踐經(jīng)驗(yàn),應(yīng)進(jìn)行認(rèn)真總結(jié)和吸收。
建立健全我國(guó)藥品進(jìn)口管理制度,是提升國(guó)內(nèi)患者臨床用藥的可及性,滿足廣大群眾日益增長(zhǎng)的健康生活需求的必然要求。通過(guò)實(shí)地調(diào)研、專家咨詢等方式,了解到2012 年8 月發(fā)布的《辦法》在長(zhǎng)期實(shí)施過(guò)程中存在如下問題:1)部分配套文件等法律法規(guī)需要更新,部分操作細(xì)則需進(jìn)一步完善,未完全涵蓋非常規(guī)商業(yè)化用途的產(chǎn)品;2)與其他部門的協(xié)調(diào)有待加強(qiáng),各監(jiān)管部門對(duì)同一品名商品的監(jiān)管互認(rèn)機(jī)制有待建立;3)完善信息系統(tǒng)建設(shè),需進(jìn)一步完善技術(shù)支撐;4)通關(guān)便利性有待進(jìn)一步加強(qiáng)。
2.2 口岸檢驗(yàn)是把控藥品質(zhì)量的重要環(huán)節(jié)
進(jìn)口藥品在到港口岸藥品監(jiān)督管理局備案后,由口岸藥品檢驗(yàn)機(jī)構(gòu)對(duì)需檢驗(yàn)的藥品品種進(jìn)行現(xiàn)場(chǎng)核驗(yàn)、資料查驗(yàn)、抽樣、檢驗(yàn)、復(fù)驗(yàn)等,口岸局根據(jù)檢驗(yàn)結(jié)果確定是否予以進(jìn)口備案,經(jīng)檢驗(yàn)合格的藥品才可用于藥物研發(fā)、臨床試驗(yàn)、商業(yè)銷售等。進(jìn)口藥品的生產(chǎn)地在境外,無(wú)法對(duì)生產(chǎn)環(huán)節(jié)進(jìn)行監(jiān)管,故通關(guān)檢驗(yàn)成了保護(hù)國(guó)門藥品質(zhì)量安全的第一道防線。從口岸檢驗(yàn)情況看,2021 年中國(guó)食品藥品檢定研究院(以下簡(jiǎn)稱中檢院)及19 個(gè)口岸藥檢機(jī)構(gòu)對(duì)涉及54 個(gè)國(guó)家或地區(qū)的9 056 批次、188.52 億美元的申請(qǐng)進(jìn)口藥品進(jìn)行了檢驗(yàn),其中檢驗(yàn)不合格藥品77 批次(0.85%)[4];從藥品抽檢情況看,2021 年國(guó)家共抽檢進(jìn)口藥品590 批次,其中口岸環(huán)節(jié)232 批次、生產(chǎn)環(huán)節(jié)14 批次、經(jīng)營(yíng)環(huán)節(jié)288 批次、使用環(huán)節(jié)56 批次,所檢項(xiàng)目均符合規(guī)定,合格率為100.00 %[5]。
自1999年起,我國(guó)開始實(shí)施進(jìn)口藥品逐批檢驗(yàn)(以下簡(jiǎn)稱批批檢)制度。2018 年,《國(guó)家藥品監(jiān)督管理局關(guān)于進(jìn)口化學(xué)藥品通關(guān)檢驗(yàn)有關(guān)事項(xiàng)的公告》規(guī)定,非首次進(jìn)口化學(xué)藥改為憑企業(yè)檢驗(yàn)結(jié)果通關(guān),不再需要逐批強(qiáng)制檢驗(yàn)。取消批批檢可解決2 個(gè)突出問題:一是按批次檢驗(yàn)經(jīng)濟(jì)成本較高,包括樣品成本、檢驗(yàn)費(fèi)、倉(cāng)儲(chǔ)費(fèi)用等;二是檢驗(yàn)時(shí)間較長(zhǎng),一般情況下口岸檢驗(yàn)機(jī)構(gòu)的檢驗(yàn)時(shí)間至少為1 個(gè)月,而中檢院的檢驗(yàn)時(shí)間更長(zhǎng)(3 個(gè)月)[6],物流周期延長(zhǎng),易導(dǎo)致國(guó)內(nèi)上市時(shí)間推后。2018 年取消批批檢后,在物流、通關(guān)、檢驗(yàn)、倉(cāng)儲(chǔ)等方面為企業(yè)和監(jiān)管部門帶來(lái)了極大便利。
3 取消批批檢對(duì)日常檢驗(yàn)工作的積極意義
3.1 抽樣數(shù)量減少,降低檢驗(yàn)成本
在通關(guān)檢驗(yàn)抽樣時(shí),由于需對(duì)樣品進(jìn)行多次重復(fù)檢驗(yàn),不僅同一批藥品要被抽取多件樣品,檢驗(yàn)機(jī)構(gòu)還需投入大量人力和物力保證檢驗(yàn)工作的進(jìn)行[7];抽取的藥品除檢驗(yàn)用量消耗外,剩余藥量作為留樣,至少需在專門設(shè)置的留樣間儲(chǔ)存3 年。上述要求對(duì)實(shí)驗(yàn)儀器、耗材和場(chǎng)地提出了較大需求。另外,過(guò)期的留樣藥品還需委托專業(yè)機(jī)構(gòu)進(jìn)行無(wú)害化銷毀。
3.2 抽樣與檢驗(yàn)任務(wù)減少,促使合理分配檢驗(yàn)資源
化學(xué)藥片劑、注射劑及相關(guān)原料藥是抽樣和檢驗(yàn)任務(wù)的重點(diǎn)。隨著抽樣和檢驗(yàn)任務(wù)的大幅減少,藥品檢驗(yàn)機(jī)構(gòu)可優(yōu)化檢驗(yàn)人員、實(shí)驗(yàn)儀器耗材、相關(guān)服務(wù)保障的資源配置,以及現(xiàn)場(chǎng)核驗(yàn)、資料查驗(yàn)、抽樣、檢驗(yàn)、復(fù)驗(yàn)等過(guò)程中的流程,提高進(jìn)口藥品通關(guān)報(bào)驗(yàn)和檢驗(yàn)效率。
3.3 釋放檢驗(yàn)機(jī)構(gòu)的檢驗(yàn)?zāi)芰?/h3>
國(guó)家對(duì)口岸檢驗(yàn)機(jī)構(gòu)的實(shí)驗(yàn)室建設(shè)、儀器設(shè)備購(gòu)置維護(hù)、人員培訓(xùn)等已投入大量經(jīng)費(fèi),檢驗(yàn)機(jī)構(gòu)可著重提升實(shí)驗(yàn)室技術(shù)和管理能力,提高檢驗(yàn)機(jī)構(gòu)技術(shù)水平和質(zhì)量控制能力,完善實(shí)驗(yàn)室質(zhì)量管理體系,以及申請(qǐng)適用于本機(jī)構(gòu)的其他資質(zhì)認(rèn)定等。此外,通過(guò)加強(qiáng)對(duì)檢驗(yàn)人員的考核和培訓(xùn),提升在藥品注冊(cè)標(biāo)準(zhǔn)的探究性研究、特殊藥品(如捐贈(zèng)藥品)檢驗(yàn)標(biāo)準(zhǔn)研究、強(qiáng)化與其他部門在進(jìn)口藥品的風(fēng)險(xiǎn)評(píng)估、檢測(cè)鑒定和后續(xù)處置的協(xié)作等研究項(xiàng)目的研發(fā)能力,為進(jìn)口藥品的監(jiān)管提供堅(jiān)強(qiáng)的技術(shù)支持。
4 政策建議
4.1 加快法律法規(guī)的修訂進(jìn)程
取消非首次進(jìn)口化學(xué)藥批批檢最大的啟示,就是要全面加強(qiáng)現(xiàn)行進(jìn)口藥品相關(guān)法規(guī)和政策間的銜接,相關(guān)法規(guī)及其配套文件也需作出相應(yīng)調(diào)整。因《辦法》不是對(duì)藥品進(jìn)口管理全流程的程序性規(guī)定,目前涉及進(jìn)口方面的法規(guī)眾多,部分配套文件需要更新,且部分操作細(xì)則需進(jìn)一步完善。在相關(guān)規(guī)定調(diào)整到位前,若進(jìn)口藥品的進(jìn)口備案、口岸檢驗(yàn)、監(jiān)督管理等現(xiàn)行規(guī)定存在與未廢除規(guī)定不相匹配的情況,需用新規(guī)定取代。近年來(lái),有關(guān)藥品監(jiān)管領(lǐng)域的改革舉措都涉及法律規(guī)定的創(chuàng)新與調(diào)整,如何制訂科學(xué)、嚴(yán)謹(jǐn)?shù)恼咝杞y(tǒng)籌考慮,如緊密聯(lián)合商務(wù)委員會(huì)、海關(guān)、國(guó)家衛(wèi)生健康委員會(huì)、體育局、農(nóng)業(yè)局等其他部門;建立并完善分層法規(guī)體系,用相關(guān)配套文件等與《辦法》進(jìn)一步銜接等。
4.2 部署取消批批檢品種的抽檢工作
取消非首次進(jìn)口化學(xué)藥批批檢改變了口岸管理的原有程序,對(duì)進(jìn)口藥品質(zhì)量把關(guān)工作將由口岸檢驗(yàn)環(huán)節(jié)變?yōu)檫M(jìn)口備案環(huán)節(jié)承擔(dān),但批批檢制度的取消不意味著所有檢測(cè)的取消。進(jìn)口藥品一直主要由口岸所檢驗(yàn),而市場(chǎng)抽樣計(jì)劃相對(duì)較少,取消批批檢的同時(shí),也減弱了第一道質(zhì)量把關(guān)的防線。因此,監(jiān)管部門應(yīng)強(qiáng)化對(duì)進(jìn)口藥品的日常監(jiān)管,如在藥品抽檢買樣制度條件下,省級(jí)藥品年度抽檢計(jì)劃制訂過(guò)程中需把握監(jiān)管成本與質(zhì)量風(fēng)險(xiǎn)間的平衡,包括如何覆蓋更多的進(jìn)口藥品品種、根據(jù)不同季節(jié)和原料藥進(jìn)行動(dòng)態(tài)抽檢等。
4.3 完善信息數(shù)據(jù)庫(kù)系統(tǒng)建設(shè)
信息電子化通報(bào)對(duì)于取消非首次進(jìn)口化學(xué)藥批批檢后進(jìn)口藥品檢驗(yàn)工作的管理十分必要,完善信息數(shù)據(jù)庫(kù)系統(tǒng)建設(shè)顯得十分迫切。建議藥品監(jiān)督管理局和海關(guān)等部門內(nèi)部或部門之間建立可供查核和推送信息的數(shù)據(jù)庫(kù)系統(tǒng),包括藥品進(jìn)口注冊(cè)證、原產(chǎn)地證、出廠檢驗(yàn)報(bào)告書、批簽發(fā)原件及其他重要數(shù)據(jù);國(guó)家與省級(jí)監(jiān)督管理部門之間要及時(shí)通報(bào)涉及進(jìn)口藥品的案件和預(yù)警信息,便于省級(jí)藥品監(jiān)督管理部門增強(qiáng)對(duì)藥品市場(chǎng)檢查監(jiān)督的針對(duì)性;在對(duì)進(jìn)一步完善電子通關(guān)系統(tǒng)的基礎(chǔ)上,通過(guò)電子證照(密鑰)、區(qū)塊鏈加密等方式核驗(yàn)申報(bào)材料,并探討解決多口岸同時(shí)報(bào)關(guān)的問題。
- 中國(guó)藥業(yè)的其它文章
- 臨床藥師參與境外遠(yuǎn)航途中2 例惡性瘧疾患者的藥學(xué)監(jiān)護(hù)
- 注意缺陷多動(dòng)障礙發(fā)病機(jī)制及治療藥物研究進(jìn)展*
- 基于藥物滴速預(yù)警規(guī)則降低某院輸液速度相關(guān)不良反應(yīng)發(fā)生率的藥學(xué)實(shí)踐*
- 基于Granada- Ⅱ分類法評(píng)價(jià)利伐沙班用于非瓣膜性心房顫動(dòng)藥物相關(guān)問題*
- 阿來(lái)替尼聯(lián)合吉西他濱治療肺腺癌臨床研究*
- 決奈達(dá)隆治療陣發(fā)性/持續(xù)性心房顫動(dòng)的快速衛(wèi)生技術(shù)評(píng)估*

