基于PARP-1裂解引發非小細胞肺癌細胞凋亡的蟾酥抗腫瘤機理研究*
毛佩芝 吳紀恒 王龍虎 嚴熒燕 汪志春
1 寧波市婦女兒童醫院 浙江 寧波 315000
2 浙江大學醫學院附屬兒童醫院 浙江 杭州 310058
3 浙江大學藥學院 浙江 杭州 310058
4 江蘇京蟾生物資源開發有限公司 江蘇 盱眙 211700
非小細胞肺癌(NSCLC)是目前發病率和死亡率均排前列的惡性腫瘤[1]。臨床試驗以及實踐證明,中藥在提高放化療效果、改善腫瘤耐藥反應、降低術后復發和轉移、延長病人生存期、提升生存質量等方面具有明顯的優勢[2,3]。蟾酥為蟾蜍科動物中華大蟾蜍(Bufobufo gargarizans)或黑框蟾蜍(BufomelanostictusSchneider)的干燥分泌物,是我國傳統名貴中藥材。研究顯示,蟾酥的主要藥效物質是蟾毒配基類成分,其在抗腫瘤、免疫調節以及減輕癌痛等方面有顯著療效[4,5]。因此,蟾酥及其制劑廣泛用于抗腫瘤,治療肺癌效果尤佳[6-8]。然而蟾酥抗腫瘤的作用機制復雜,作用靶點尚未明確,加上它又是毒性中藥,其應用受到限制[9,10]。因此,探索蟾酥抗腫瘤的結合靶點及其作用機制,對其精準用藥具有重要意義。
分子對接技術可以通過算法模擬小分子與受體大分子蛋白之間的結合作用方式。在計算機輔助藥物設計中,模擬分子對接是關鍵步驟,即通過算法預測藥物分子與靶點結合互相作用的方式和過程[11]。分子對接技術在中藥活性成分篩選和靶點確證方面有著廣泛的應用前景。
本文在前期研究的基礎上[12],采用半柔性分子對接技術,研究蟾酥有效成分與PARP 蛋白間的相互結合方式,從結合自由能、疏水作用、構象穩定性、結合親和力等方面探討配體抑制活性的概率,初步探究蟾酥抗腫瘤作用機制。然后,在虛擬分析的基礎上,開展流式細胞術檢測沙蟾毒精引起的A549 細胞凋亡實驗,并檢測沙蟾毒精給藥后A549 細胞中cleaved PARP 的表達量,以達到與分子對接預測結果相互佐證的目的。本文研究的意義在于為蟾酥的精準用藥和新藥開發提供新的研究基礎。
1 材料與方法
1.1 細胞與試劑:A549和H157細胞由浙江大學中藥藥理實驗室提供。標準品沙蟾毒精(CAS:464-74-4)、遠華蟾毒精(CAS:472-26-4)、華蟾毒它靈(CAS:1108-68-5)購自上海源葉生物科技有限公司,質量分數均高于98%。噻唑藍(MTT)試劑盒(上海碧云天生物技術有限公司);Annexin V/PI 凋亡檢測試劑盒(中國Biosharp 公司);PARP 一抗(Abcam 公司,批號:ab227244);山羊抗兔二抗(Abcam公司,批號:ab7090)。
1.2 儀器:酶標儀(美國BIO-TEK 公司);FC 500MCL 流式細胞儀(美國Beckman Coulter 公司);化學發光成像儀(美國Bio-Rad公司)。
1.3 軟件和數據:Autodock 軟件由美國斯克利普斯研究所開發,免費授權。PARP 蛋白晶體結構來源于數據庫(https://www.rcsb.org/)。三維結構來源于(https://zinc.docking.org/substances/home/)。軟件運行于Windows操作系統下。相關軟件均已授權或免授權。
2 方法
2.1 蛋白結構預處理:在蛋白質數據庫中,搜索PARP-1 蛋白(蛋白號:5DS3)晶體結構文件,基源為大腸桿菌。利用Pymol軟件去除水分子和多余的配體,得到PARP-1蛋白結構。之后添加電荷和極性氫原子,應用Autodock軟件對小分子化合物進行能量優化,檢查可旋轉的化學鍵,另存為pdbqt[Protein Data Bank,Partial Charge(Q),& Atom Type(T)]文件。
2.2 Autodock 分子對接:Autodock 4.2 軟件運行于Windows 系統下,依次加載蛋白晶體結構(受體)和小分子化合物(配體)。用Auto Grid 計算格點能量,采用拉馬克遺傳算法對接運算,用半經驗的自由能評價方法評價各配體與蛋白之間的結合情況。參數設置:將參數“能量最大評價次數”確定為2500000,運行次數確定為100,其他參數為默認設置。根據相關文獻[13]報道,確定蛋白活性口袋的氨基酸殘基和中心點坐標(X、Y、Z):Gly 863、Ser 904、Tyr 907、Tyr 896、Lys 903 和Arg 878,中心坐標為(30.571,15.384,44.088)。
2.3 PILP 分析:PILP(Protein-Ligand Interaction Profiler)是一個在線的蛋白配體非共價聯系的分析工具。將Autodock 生成的PDB 文件導入PILP,經算法處理,以展示受體與配體之間的非共價鍵作用,包括氫鍵、π-π堆積、疏水作用等。
2.4 細胞培養及MTT檢測:選用第3代至第8代的A549和H157 細胞置于培養瓶中,在37℃、5% CO2及飽和濕度的細胞培養箱內培養,每隔12h觀察并記錄細胞生長狀態1 次,以確保細胞狀態良好。在細胞培養72h 后,加入MTT 20μL,再孵育4h 后于酶標儀490nm 處測定吸光度值,并計算細胞抑制率。
2.5 Western Blot:將培養的細胞用PBS 沖洗細胞2次,再加入蛋白酶抑制劑和RIPA預混液,提取A549細胞總蛋白樣本,并檢測蛋白濃度;將蛋白樣本上樣在10%SDS-PAGE 凝膠梳孔中,電泳,轉膜,封閉,一抗(1∶899)中孵育;過夜后,洗膜,二抗孵育,洗膜;ECL 發光顯影,凝膠成像儀曝光,拍照,應用ImageJ軟件檢測條帶灰度值,將目的條帶灰度值對比內參條帶灰度值,得到目的蛋白的相對表達量。
2.6 Annexin V-FITC 檢測細胞凋亡:將對數生長期細胞用胰酶消化制得懸液并將細胞接種于24 孔板,分組同上。藥物處理24h后消化、離心,預冷PBS重懸,將細胞密度調至1×105/mL,1000r/min 離心5min,棄上清,加入500μL 結合液輕輕重懸細胞,加入5μL Annexin VFITC,輕輕混勻;再加入5μL 碘化丙啶,輕輕混勻,室溫下避光孵育10min,上流式細胞儀檢測。
3 結果
3.1 分子對接結果:蟾酥主成分與PARP-1 蛋白靶點對接結果見表1。對接結果綜合了半經驗化的自由能評價評分抑制常數值(Ki)參與對接的氨基酸殘基等數據。PARP-1 分別與沙蟾毒精、嚏根草配基、嚏根草醇、華蟾毒它靈、遠華蟾毒精、19-氧代華蟾毒它靈和19-氧代華蟾酥毒基相互作用的最低結合自由能分別為-5.72、-6.47、-6.52、-5.81、-6.25、-6.16、-6.80 KJ/mol。通過拉馬克算法分析,得到了PARP 蛋白(5DS3)和小分子配體的最佳對接方式,如圖1 所示。
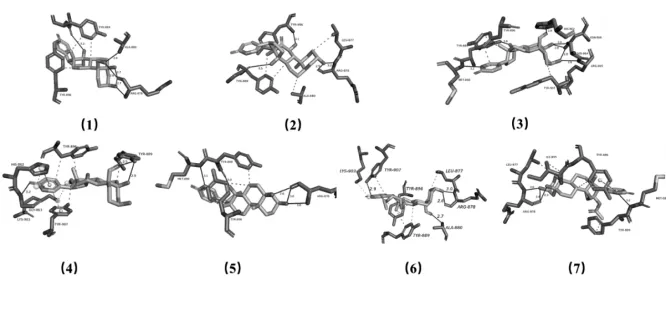
圖1 有效成分與PARP-1對接模式圖
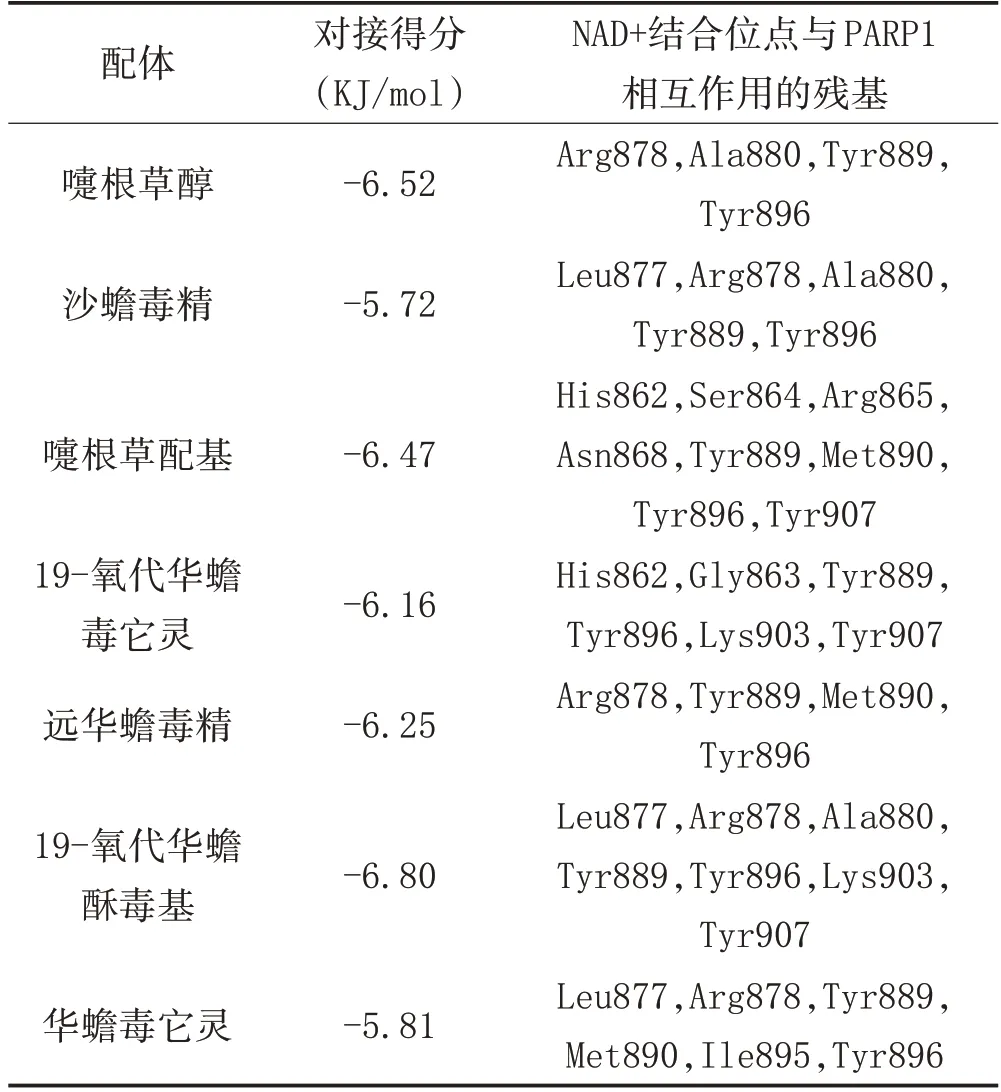
表1 蟾酥抗腫瘤活性成分與PARP蛋白的分子對接結果
3.2 體外活性試驗結果:為了驗證上述分析結果,本文選擇其中代表性化合物(沙蟾毒精、遠華蟾毒精和華蟾毒它靈),考察有效成分對癌細胞(A549和H157)的生長抑制作用,如表2所列。試驗結果表明,它們都能顯著抑制腫瘤細胞的生長,這與虛擬分析的結論相吻合。
表2 3種活性成分對A549、H157肺癌細胞的抑制作用(±s,n=3)

表2 3種活性成分對A549、H157肺癌細胞的抑制作用(±s,n=3)
IC50(ng/mL)A549 H157沙蟾毒精12.37±3.61 8.89±1.43遠華蟾毒精27.79±17.52 23.72±7.27華蟾毒它靈23.40±4.28 131.32±21.16
與空白對照比較,給藥干預A549 細胞、H157 細胞72h,各組細胞增殖受到抑制,細胞增殖抑制率隨給藥濃度上升而增高,差異具有統計學意義(P<0.01),且500ng/mL濃度組增殖抑制效果最佳(圖2)。
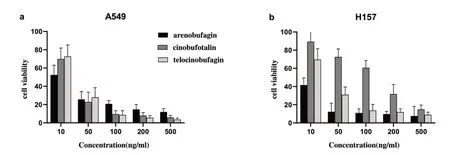
圖2 三種化合物對A549、H157細胞的增殖抑制作用
3.3 沙蟾毒精誘導A549 細胞凋亡結果:我們進一步測試了蟾酥抗腫瘤成分沙蟾毒精誘導A549細胞凋亡的效果。結果如圖3所示。與對照組(0ng/mL)比較,處理組細胞的凋亡率明顯升高(P<0.05),且呈濃度依賴性,其中25ng/mL濃度組細胞凋亡比例最高。
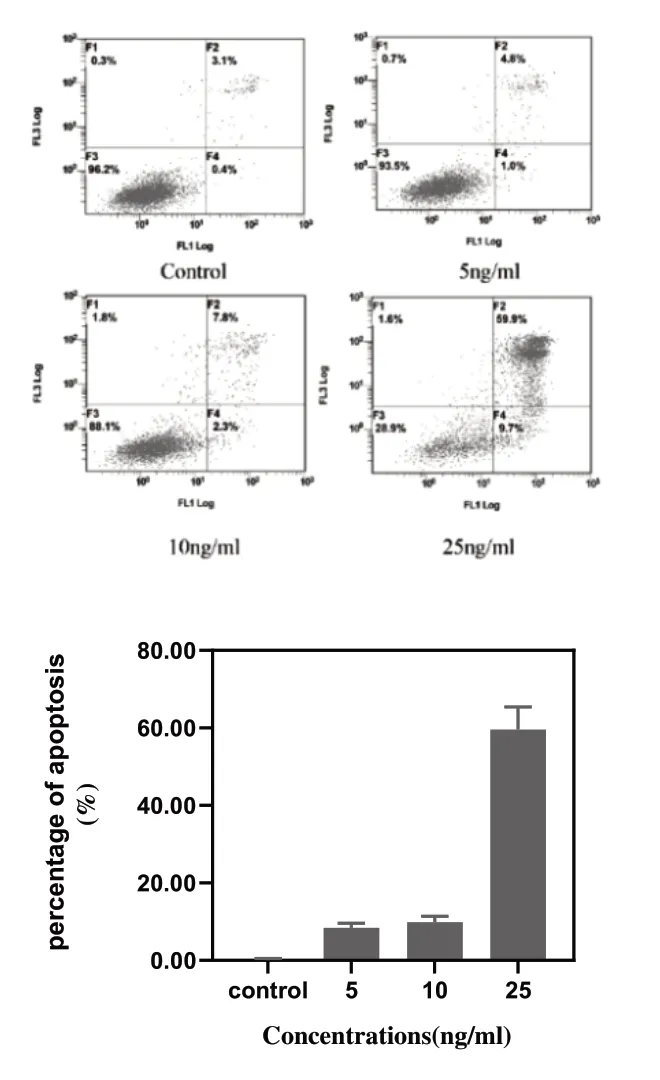
圖3 沙蟾毒精誘導A549細胞凋亡實驗結果
3.4 誘導PARP 蛋白裂解結果:圖4 是免疫印跡法探究沙蟾毒精誘導A549 細胞的PARP 蛋白裂解的實驗結果。由圖4 可知,與對照組(0ng/mL)相比,處理組的cleaved PARP 表達量明顯增加且呈濃度依賴性。分子生物學實驗結果與Autodock軟件模擬結果相一致。

圖4 免疫印跡法測定PARP蛋白的表達量
4 討論
PARP-1 是近年來腫瘤治療的一個熱門靶點,而PARP-1抑制劑能夠靶向抑制DNA損傷修復過程,體外試驗和臨床試驗均證實PARP-1 抑制劑具有較強的抗腫瘤效果,其已進入臨床使用并取得了一系列令人滿意的療效[14]。由于腫瘤細胞基因組不穩定,其存活非常依賴DNA 損傷應答修復機制[15]。PARP-1 最重要的功能是參與堿基切除與修復,在單鏈DNA損傷修復中發揮重要作用[16]。PARP 在細胞DNA 損傷后可以被激活,并識別DNA單鏈損傷缺口,最終結合到缺口上進行修復。根據已有文獻[17]報道,蟾酥成分單體能夠通過誘導腫瘤細胞凋亡抑制其生長。
首先本研究通過Autodock分子對接技術和PILP分析平臺,模擬并預測了蟾酥有效成分的抗腫瘤作用靶點。結合表1 和圖1 所示,沙蟾毒精等7 種化合物均能與PARP-1的NAD+結合口袋中的部分氨基酸殘基發生氫鍵、鹽橋等相互作用,且與PARP-1 結合活性較強,說明這些化合物可能阻斷PARP-1 蛋白對損傷DNA 的修復作用,并以此發揮抗腫瘤活性。他們與PARP-1 結合的差異,在于各種結合自由能的差異,反映出配體與受體之間具有相當的親和力。
其次是結合的氨基酸殘基種類和結合方式的不同,由此可能導致最終藥效活性的差異。這7種化合物均屬于蟾毒配基類成分。根據文獻[13],對于蟾毒配基類分子的母核而言,在C-17位有α-吡喃環的甾體A/B順式、C/D順式結構基本骨架對于維持其藥理活性至關重要。3-OH和5β-OH取代基能夠增加其活性,而C-3位的大取代基則不利于此類化合物的活性,可能是由于3位的大取代基會增大分子的極性。根據篩選結果,具有11α-羥基和12-羰基的沙蟾毒精表現出最強的藥理活性,說明此結構特征有利于增強其活性;對于19-氧代華蟾酥毒基、19-氧代華蟾毒它靈和華蟾毒它靈而言,16β-乙酰氧基有利于其分子活性增強;此外,嚏根草醇的C-10位羥甲基;嚏根草配基,19-氧代華蟾毒它靈和19-氧代華蟾酥毒基的C-10位的醛基能夠增強其化合物活性,這與相關研究結果一致[18],說明相對于蟾酥中的其他成分,我們篩選出的化合物具有對藥效活性更有利的取代基團,使得這些化合物在蟾酥對肺癌細胞產生細胞毒作用。
本研究通過分子對接技術成功預測PARP-1 有可能為蟾酥抗肺癌的腫瘤靶點,隨后通過對沙蟾毒精、遠華蟾毒精和華蟾毒它靈進行藥效驗證,證明3種成分具有顯著的肺癌細胞抑制作用。它們在細胞毒活性強弱排序為沙蟾毒精、遠華蟾毒精、華蟾毒它靈。參考已上市的靶向PARP 蛋白的小分子藥物奧拉帕利(Olaparib)對A549 細胞的IC50 值:(13.38±1.2)μg/mL[19],以及現行質量標準中的脂蟾毒配基對A549 細胞的IC50 值:(8.83±2.1)μg/mL[20]。對比實驗結果可以發現,本文篩選出的小分子的IC50值顯著低于奧拉帕利和脂蟾毒配基,意味著更強的抑制作用。
最后本研究選擇其中含量最高的沙蟾毒精,探究其對細胞凋亡的作用及誘導PARP蛋白裂解的作用。結果表明,沙蟾毒精可以顯著誘導PARP蛋白發生裂解,并誘導A549細胞凋亡,由此抑制腫瘤細胞增殖,該結果與分子對接預測結果相互佐證。

