靈芪合劑影響肝細胞生長因子/上皮間質轉化因子通路抑制結直腸癌
王國勝 李嘉雯 李 娜 何西濤 董咨余 劉振新
(1 哈爾濱醫科大學附屬第一醫院,哈爾濱,150000; 2 哈爾濱醫科大學附屬第四醫院,哈爾濱,150000; 3 哈爾濱醫科大學附屬第六醫院,哈爾濱,150000)
我國結直腸癌(Colorectal Cancer,CRC)發病率在近幾十年來呈逐漸上升趨勢。現在CRC的死亡率為全部惡性腫瘤死亡率中的主要類型之一[1],CRC調整死亡率男性為5.29/10萬,女性為3.86/10萬[2]。近年來,腫瘤的治療越來越多地應用中藥。有研究發現,中藥對腫瘤的作用機制可能是“多靶點作用”,并且具有獨特的功效[3],即有選擇地反復作用于某種疾病的多個直接靶點和間接靶點從而達到治療疾病的目的[4]。在本實驗室的前期研究中發現,部分中藥對LoVo人結直腸癌細胞(Human Colon Cancer Cells)的相關表達因子有所影響[5]。在我們以往的研究中,根據LoVo的細胞生長曲線,靈芪膠囊各組對腫瘤細胞的生長具有一定的抑制作用;靈芪膠囊(換氣、靈芝、莪術、茯苓、人參、枸杞子、山藥、山慈菇、重樓等)對誘導細胞凋亡效果顯著[6]。另一方面,肝細胞生長因子(Hepatocyte Growth Factor,HGF)/上皮間質轉化因子(Mesenchymal-epithelial Transition Factor,c-Met)信號通路被認為是結直腸癌轉移所必需的,結直腸癌早期的強有力的診斷指標[7-8]。HGF/c-Met信號轉導通路是目前誘導細胞遷移的關鍵信號通路[9]。因此,本實驗室通過建立腫瘤模型,使用自研中藥靈芪合劑(黃芪、靈芝、莪術等合劑)[10],來驗證本合劑配方是否可通過調控HGF/c-Met信號通路從而抑制CRC細胞的侵襲和轉移。
1 材料與方法
1.1 材料
1.1.1 細胞 LoVo細胞(黑龍江省腫瘤研究所,貨號:STCC00011G)。
1.1.2 動物 24只裸鼠由黑龍江中醫藥大學藥物安全性評價中心提供,合格證編號:SCXK(黑)2020-003。體質量20~25 g,清潔級,8周齡,給藥前適應性喂養5~7 d(普通飼料,常規飲水,室溫控制在22 ℃左右,相對濕度約60%)。本課題所有涉及動物的試驗均已通過哈爾濱醫科大學實驗動物倫理委員會的批準,動物倫理審批號:LL2017032802,符合清潔級實驗動物標準。
1.1.3 藥物 靈芪合劑由哈爾濱醫科大學附屬第一醫院制劑室生產,由黃芪、靈芝、莪術、茯苓、人參、貫眾、山藥、枸杞子、重樓、山慈菇等組成,每粒含生藥1.65 g[11]。
1.1.4 試劑與儀器 胸苷酸合成酶抑制藥5-氟尿嘧啶(5-Fluorouracil,5-FU)注射液(國泰醫藥股份有限公司,國藥準字H2020959)。細胞裂解液(增強型,上海碧云天生物技術研究,貨號:P0013);0.45 μm聚偏二氟乙烯(Polyvinylidene Fluoride,PVDF)膜(Sigma公司,德國,貨號:P2938);HGF多克隆抗體[貨號:Anti-HGF antibody(EPR12230)ab178395]、c-Met多克隆抗體[貨號:Anti-Met(c-Met) antibody(EP1454Y)-N-terminal ab51067]以上購自美國Abcam公司;通用型電泳儀(上海天能科技有限公司,型號:TanonESP300);轉膜儀(BayGene公司,美國,型號:BG-Power60);倒置熒光顯微鏡(Olympus公司,日本,型號:CKX41);熒光顯微鏡(NIKON公司,日本,型號:NIKON ECLIPSE C1);高速低溫離心機(Sigma公司,德國,型號:Centrifuge 5424R);微量分析天平(METTLER公司,瑞士,型號:E260);全自動化學發光分析儀(通用電氣公司,美國,型號:Imager 600)。
1.2 方法
1.2.1 分組與模型制備 1)動物實驗分組:裸鼠按照完全隨機法分為6組,每組4只,陰性對照組,陽性對照組,5-FU注射液組,靈芪合劑高劑量組、中劑量組和低劑量組,每組4只。2)除陰性照組裸鼠外,其他組裸鼠按0.2 mL/只接種LoVo于常規皮膚消毒后的裸鼠右前肢腋部皮下,接種24 h后進行下步操作。
1.2.2 給藥方法 實驗時將靈芪合劑臨時配制成溶液。靈芪合劑高劑量組、中劑量組和低劑量組分別為5.0 g/kg、2.5 g/kg、1.25 g/kg,給藥方式均為灌胃給藥,連續給藥7 d;陰性對照組以0.2 mL生理鹽水灌胃;5-FU注射液組以5-FU注射液0.027 g/(kg·d)灌胃;陽性對照組不進行任何干預。
1.2.3 檢測指標與方法
1.2.3.1 動物實驗 蛋白質印跡法檢測裂解腫瘤組織細胞,提取蛋白,使用BSA計算蛋白含量和上樣量。灌膠、上樣,進行電泳。轉模后進行一抗和二抗的孵育,一抗濃度:HGF(1∶1 000稀釋)和c-Met(1∶1 000稀釋),二抗濃度:辣根過氧化物酶(Horseradish Peroxidase,HRP)標記二抗羊抗兔(1∶5 000)稀釋,時間分別為10 h和2 h。采用Imager 600全自動化學發光分析系統進行目的蛋白化學發光的檢測,獲取并保存結果。應用圖像處理軟件(ImageJ)分析蛋白灰度值。
1.2.3.2 c-Met的免疫熒光檢測步驟 1)準備處理好的腫瘤組織切片,并置于65 ℃恒溫箱烤片1 h。接下來使用1×磷酸鹽緩沖液(Phosphate Buffered Saline,PBS)洗滌3次,5 min/次。2)0.5%聚乙二醇辛基苯基醚(Triton X-100)使用1×PBS配制,室溫通透細胞15 min,1×PBS浸洗玻片3次,3 min/次。3)使用檸檬酸鹽緩沖液進行抗原修復。將切片浸入檸檬酸鹽緩沖液(pH=6.0),微波爐高火加熱8 min后拿出,冷卻至室溫。冷卻后PBS(pH值7.2~7.6)洗滌3次,3 min/次。4)加入3% H2O2,室溫10 min。PBS沖洗3次,3 min/次。5)血清封閉:切片滴加血清放入濕盒中,室溫20 min。6)孵育一抗:滴加適當稀釋的一抗(c-Met),對照組滴加等量PBS,4 ℃冰箱過夜。7)加熒光二抗:PBS浸洗3次,3 min/次,吸干切片上多余液體后滴加稀釋好的熒光二抗,濕盒中37 ℃孵育1 h,PBS浸洗3次,3 min/次。8)復染核:滴加4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)避光孵育5 min,對切片進行染核,PBS洗滌4次,去除多余DAPI。9)封片:使用防熒光淬滅封片劑進行封片,接下來使用熒光顯微鏡觀察。
1.2.3.3 凋亡檢測 用0.25%的胰酶消化腫瘤組織。在消化時加2%的牛血清白蛋白(Bovine Serum Albumin,BSA)可防止消化過度。用1×PBS洗滌。細胞收集:用胰酶消化收集后,于室溫2 000 r/min,離心半徑6 cm,離心5~10 min,離收集細胞;用預冷1×PBS(4 ℃)重懸細胞1次,2 000 r/min,離心半徑6 cm,離心5~10 min,洗滌細胞;加入300 μL的1×結合緩沖液(Binding Buffer)懸浮細胞;膜聯蛋白V熒光素(Annexin V-FITC)標記:加入5 μL的Annexin V-FITC混勻后,避光,室溫孵育15 min;碘化丙啶(Propidium Iodide,PI)標記:上機前5 min再加入5 μL的PI染色。
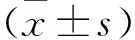
2 結果
2.1 HGF和c-Met的蛋白質印跡法檢測結果 靈芪合劑能夠顯著抑制HGF蛋白表達量,其中靈芪膠囊高、中、低劑量組與陽性對照組比較,差異有統計學意義(P<0.05)。見圖1。靈芪膠囊能夠影響c-Met蛋白相對表達量,高劑量組效果更為明顯,差異有統計學意義(P<0.05)。見圖2。

圖1 HGF蛋白的表達與HGF/β-actin結果(n=4)注:A. HGF與內參蛋白印跡圖; B. HGF與β-actin蛋白條帶強度之比;與陰性對照組比較,*P<0.05,**P<0.01;與陽性對照組比較,△P<0.05,△△P<0.01

圖2 檢測c-Met蛋白的表達與c-Met/β-actin結果(n=4)注:A. c-Met與內參蛋白印跡圖; B. c-Met與β-actin蛋白條帶強度之比;與陰性對照組比較,*P<0.05,**P<0.01;與陽性對照組比較,△P<0.05,△△P<0.01
2.2 凋亡檢測結果 靈芪合劑高劑量組誘導細胞凋亡的作用最為顯著,與陽性對照組比較,差異有統計學意義(P<0.01)。見圖3。

圖3 靈芪合劑誘導組織凋亡與調亡指數(免疫熒光染色,×400)注:A.細胞凋亡結果;B.各組凋亡指數;與陰性對照組比較,**P<0.01;與陽性對照組比較,△△P<0.01
2.3 c-Met的免疫熒光表達結果 在腫瘤組織中c-Met表達量很低,在靈芪合劑高劑量治療后c-Met表達量顯著增多,與蛋白質印跡法的蛋白表達結果相一致。見圖4。

圖4 c-Met免疫熒光表達(免疫熒光染色,×400)注:DAPI染藍色為細胞核,紅色為c-Met蛋白陽性表達
3 討論
CRC是全球癌癥被公認的死亡第三大原因[12]。發病率和死亡率隨著時間的推移迅速增加,預計全球CRC負擔將激增60%[13],新發病例超過220萬,到2030年將有110萬人死亡[14]。因此,找到一種除了手術療法外的有效治療方法刻不容緩。
在正常生理條件下,HGF/c-Met的相互作用強烈介導細胞組織和細胞分裂[15],如上皮細胞增殖和遷移、血管生成和傷口愈合[16]。而HGF/c-Met通路也參與不同類型的惡性腫瘤,在腫瘤的增殖、侵襲和轉移中起關鍵作用[17]。本課題組多年來從事著消化道腫瘤及相關研究[18-20],近些年來發現靈芪膠囊對于各種消化道腫瘤具有一定的抑制作用,其中該藥物對LoVo細胞的抑制作用非常明顯[6,21],具有一定的開發潛力。
從HGF和c-Met蛋白的表達結果可以看出,在沒有應用靈芪合劑治療的組別HGF表達量較高,c-Met的蛋白表達量較低;在應用靈芪合劑治療后,2個蛋白的表達量反轉,分別降低和升高,且差異顯著。在免疫熒光實驗中,其結果與蛋白質印跡法檢測結果基本一致,這也表明了靈芪合劑對HGF/c-Met信號通路的影響,從而影響癌癥發展。
本研究結果表明,c-Met在CRC進展和轉移中起重要作用。HGF/c-Met信號通路的干預可能為探索CRC轉移的新藥物療法提供寶貴的靶點,潛在的c-Met抑制劑可能在結腸癌的治療中具有治療價值,同時也為中藥治療癌癥提供先例,為中藥制劑提供新方向。
綜合本研究結果,經靈芪合劑治療的結直腸癌裸鼠模型,其腫瘤細胞的HGF蛋白表達明顯下降,而c-Met蛋白表達明顯增強,其高劑量靈芪合劑調控HGF和c-Met表達效果與5-FU相當,免疫熒光檢測結果與蛋白質印跡法檢測結果一致,表明靈芪合劑可能通過下調HGF的表達,上調c-Met的表達,達到抑制腫瘤的效果。制備CRC內體裸鼠荷瘤模型,并選取中醫藥經典方劑,經現代化工藝制成靈芪合劑,深入分析闡明靈芪合劑對CRC的抑制作用及其機制。并通過體內驗證靈芪合劑的生物學功能及藥效學研究,靈芪合劑能夠抑制CRC裸鼠荷瘤模型的腫瘤生長,其作用機制與靈芪膠囊機制腫瘤過程中激活的HGF/c-met細胞通路有關,進一步明確靈芪合劑對CRC的抑制作用及其作用途徑,為靈芪合劑在CRC腫瘤治療過程中積累了寶貴的臨床經驗,為CRC的治療提供理論基礎和新的思路。
利益沖突聲明:本研究作者均無利益沖突。

