前列腺癌根治術前NLR、LMR水平變化及其對預后的評估價值
潘亮,趙華才,王志剛,任偉,孫羿,李森
陜西省人民醫(yī)院泌尿外科,陜西 西安 710068
前列腺癌是一種對男性生命健康有著嚴重威脅的常見惡性腫瘤,在歐美國家男性死亡率中占第三位、發(fā)病率占第一位[1]。雖然國內前列腺癌發(fā)病率低于西方國家,然而隨著生活方式的變化、前列腺特異性抗原檢測的增加、壽命延長等因素影響,前列腺癌的發(fā)病率也在不斷提升[2]。盡管近幾年由于前列腺癌發(fā)現(xiàn)及時與盡早干預,患者預后得到了顯著改善,然而因為國內醫(yī)療技術相對落后、前列腺癌早期癥狀不具有特異性等,大部分患者在確診時已經處于中晚期,就算在前列腺癌早期就已經確診,依然有大多數(shù)患者于根治術后幾個月就發(fā)展至生化復發(fā)階段[3]。現(xiàn)在,臨床中沒有一個能夠較為準確的評估前列腺癌診斷、發(fā)展狀況與預后的相關標志物。諸多文獻顯示,惡性腫瘤同炎癥息息相關,慢性炎癥通常會造成細胞于分子水平方面發(fā)生變化,進而引發(fā)腫瘤[4-6]。全身炎癥反應可使循環(huán)血白細胞出現(xiàn)變化,相關文獻顯示,中性粒細胞/淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴細胞/單核細胞比值(lymphocyte to monocyte ratio,LMR)能夠有效反映機體炎癥變化[7]。近幾年,相關文獻指出,NLR 能夠準確評估人體抗腫瘤免疫同腫瘤炎癥反應間的關系,同諸多惡性腫瘤的預后相關[8]。基于此,本研究旨在探討前列腺癌根治術前NLR、LMR 水平變化及其對預后的評估價值,現(xiàn)報道如下:
1 資料與方法
1.1 一般資料 回顧性分析2013 年1 月至2020年12月在陜西省人民醫(yī)院泌尿外科行前列腺癌根治術的124例患者的臨床資料。納入標準:(1)符合相關診斷標準[9],且通過病理學確診;(2)符合手術指征,且均進行前列腺癌根治術;(3)臨床資料完整;(4)年齡>55歲。排除標準:(1)合并血液系統(tǒng)疾病;(2)有化療、放療、內分泌治療史;(3)確診前有重大感染或外傷者;(4)合并休克、急性感染性、其他腫瘤、器官衰竭等疾病。患者年齡56~87 歲,平均(68.26±10.43)歲;體質量指數(shù)19.25~25.30 kg/m2,平均(22.75±2.83)kg/m2;NLR 1.19~62.11,平均(4.71±1.27);LMR 0.89~39.08,平均(2.83±0.52);Gleason 評分不足8 分57 例、≥8 分67 例;TNM Ⅱ期51例、Ⅲ~Ⅳ期73 例;術前前列腺特異抗原(prostate specific antigen,PSA)1.32~55.0 ng/mL,平均(35.26±9.39) ng/mL;合并高血壓48 例、糖尿病32 例、飲酒史39例、吸煙史79例。
1.2 研究方法 (1)一般資料收集:所有患者均通過病歷收集年齡、體質量指數(shù)、高血壓、糖尿病、飲酒史、吸煙史、TNM 分期、Gleason 評分、術前PSA、術后切緣等。(2)NLR、LMR 計算:術前,所有患者于空腹狀態(tài)下采集2 mL空腹靜脈血,使用乙二胺四乙酸二鉀進行抗凝,并于30 min內使用深圳邁瑞公司生產的全自動血液分析儀BC-6800 Plus檢測中性粒細胞、單核細胞及淋巴細胞,然后計算NLR、LMR。(3)隨訪:術后所有患者均隨訪2 年,每3 個月進行1 次隨訪,隨訪終點是患者死亡時間或最近一次隨訪時間。無復發(fā)生存期(recurrence-free survival,RFS)指的是患者術后到出現(xiàn)生化轉移或復發(fā)的時間段。(4)分組:以NLR、LMR 均數(shù)為標準,分為高NLR 值組(>4.77,62 例)、低NLR值組(≤4.77,62例)、高LMR值組(>2.83,62例)、低LMR值組(≤2.83,62例)。
1.3 統(tǒng)計學方法 應用SPSS20.0 統(tǒng)計軟件進行數(shù)據(jù)分析。計量資料以均數(shù)±標準差(±s)表示,計數(shù)資料以例表示,選擇單因素與多因素COX 風險比例模型分析預后指標,繪制Kaplan-Meier 生存曲線,分析NLR、LMR 對前列腺癌患者預后的預測價值。均以P<0.05為差異具有統(tǒng)計學意義。
2 結果
2.1 前列腺癌患者術后RFS 影響因素的單因素COX 風險比例模型分析 經Cox 風險比例模型分析結果顯示,年齡≥75 歲、合并高血壓、有飲酒史、TNMⅢ~Ⅳ期、Gleason 評分≥8 分、術前PSA、術后切緣、NLR>4.77、LMR<2.83 均為術后RFS 的獨立危險因素(P<0.05),見表1。
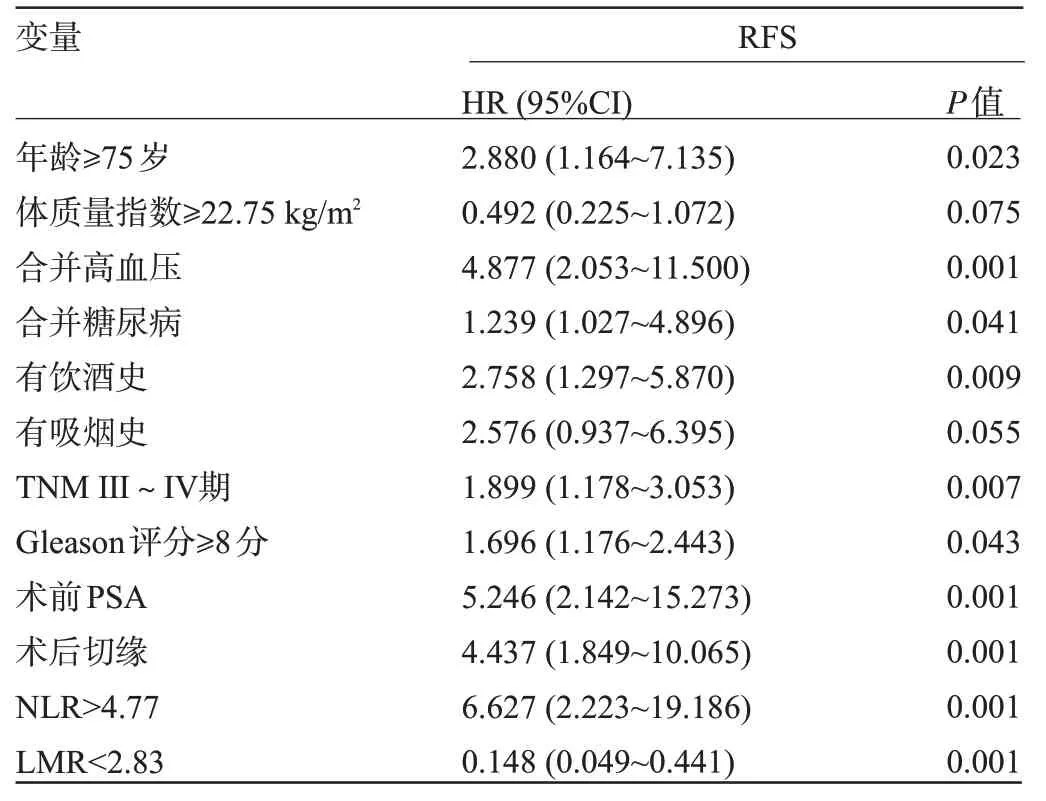
表1 前列腺癌患者術后RFS 影響因素的單因素COX 風險比例模型分析Table 1 Univariate COX proportional risk model analysis of factors affecting postoperative RFS in patients with prostate cancer
2.2 前列腺癌患者術后RFS 影響因素的多因素COX 風險比例模型分析 多因素COX 風險比例模型分析顯示,年齡≥75歲、合并高血壓、有飲酒史、TNMⅢ~Ⅳ期、術前PSA、術后切緣、NLR>4.77、LMR<2.83為術后RFS的獨立危險因素(P<0.05),見表2。
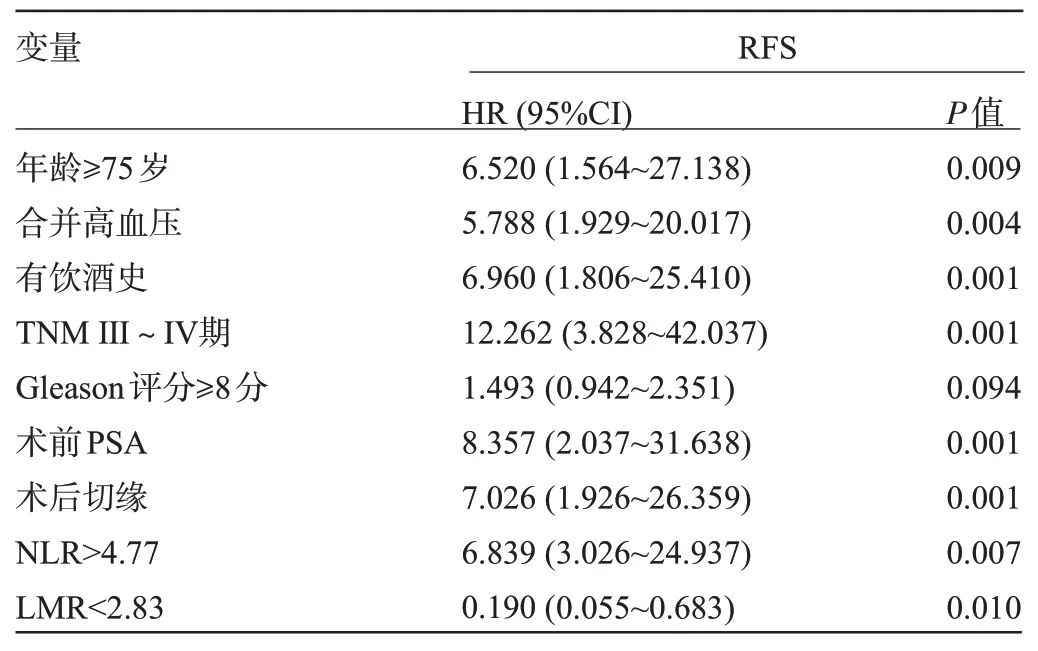
表2 前列腺癌患者術后RFS 影響因素的多因素COX 風險比例模型分析Table 2 Multivariate COX risk proportional model analysis of factors affecting postoperative RFS in patients with prostate cancer
2.3 高NLR組、低NL R組與高LMR組、低LMR組與RFS的關系 高NLR組及低LMR組患者的RFS明顯低于低NLR組與高LMR組患者,差異均有統(tǒng)計學意義(P<0.05),見圖1、圖2。
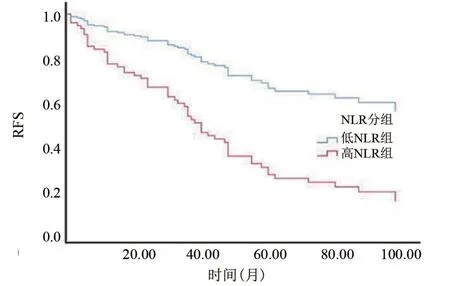
圖1 術前NLR與前列腺癌根治術后RFS的關系Figure 1 Relationship between preoperative NLR and RFS after radical resection of prostate cancer
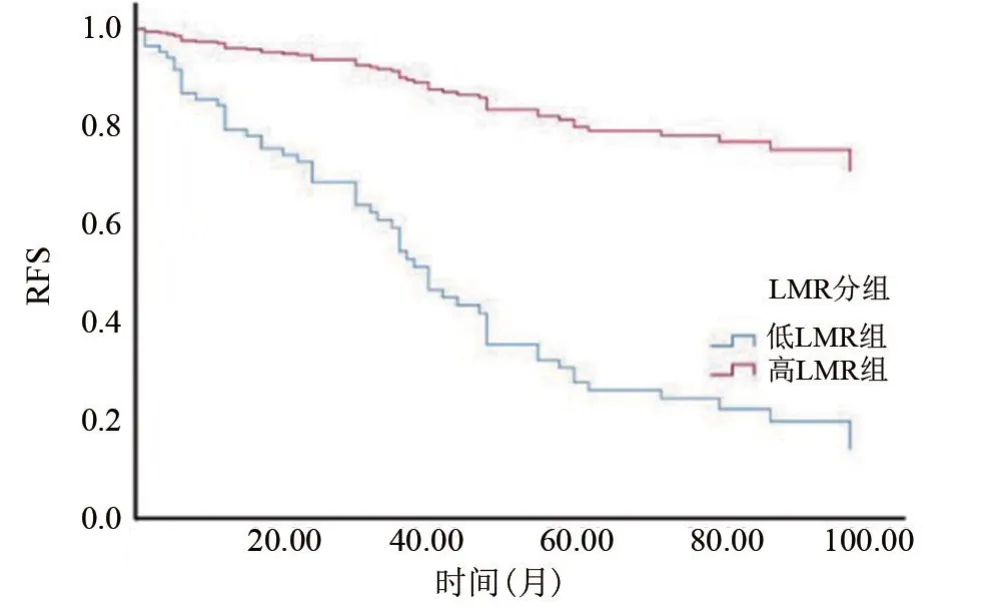
圖2 術前LMR與前列腺癌根治術后RFS的關系Figure 2 Relationship between preoperative LMR and RFS after radical resection of prostate cancer.
3 討論
腫瘤相關炎癥,即全身與(或)局部炎癥,是腫瘤遷移、侵襲、轉移的重要因素,遷移至局部的炎癥細胞會分泌活性氮及活性氧,進而造成上皮細胞正常DNA發(fā)生突變[10]。現(xiàn)在,腫瘤生物學已經由“以癌細胞為中心”逐漸轉變成更具包容性的觀念,把癌細胞放于由炎癥免疫細胞、血管細胞、成纖維細胞構成的基質細胞體系中,上述這些細胞一起組成腫瘤微環(huán)境。不管是處于慢性炎癥中,還是腫瘤導致的炎癥,對腫瘤微環(huán)境的構成,特別是腫瘤與基質細胞的可塑性均有重大影響,且能夠加快腫瘤生長、血管生成、侵襲與轉移的介質及細胞因子。諸多如中性粒細胞、血小板淋巴細胞、急性時相蛋白、白細胞等全身炎癥標志物,已經被證實在惡性腫瘤的治療反應及預后評估中具有重要作用[11]。
中性粒細胞與血小板能合成促血管生成因子,包括彈性蛋白酶、基質金屬蛋白酶、血管內皮生長因子等,這些因子均會參加腫瘤發(fā)展[12]。單核細胞為人體中較為重要的殺傷腫瘤的免疫細胞,會分化成腫瘤微環(huán)境內的腫瘤巨噬細胞,導致腫瘤增生及復發(fā),加快腫瘤組織血管生成,進而使腫瘤血行轉移與增殖加速[13]。因為淋巴細胞為人體抗腫瘤免疫的重要成員,會抑制人體中惡性細胞增殖,組成免疫屏障,淋巴細胞表達降低提示人體抗腫瘤能力衰退,從而干擾患者預后。此外,腫瘤可以加快機體出現(xiàn)炎性反應,且在加重期間,會使腫瘤細胞擴散、增殖。
NLR、LMR 屬于全身炎癥反應標志物,無需特殊程序就能獲得。相關文獻表明,NLR、LMR 在評估惡性腫瘤預后方面,有一定價值,其中NLR 于前列腺癌篩查中具有重要意義[14-15]。還有文獻顯示,術前NLR升高為小細胞肺癌患者預后不良的獨立危險因素,且NLR 同小細胞肺癌的治療方案也有一定關系[16]。NLR 同彌漫性大B 細胞淋巴瘤的預后也具有一定相關性,為彌漫性大B細胞淋巴瘤患者術后預后評估的簡便的標志物之一[17]。Hutterer 等[18]的文獻顯示,把LMR同食管鱗狀細胞癌、腎細胞癌的術后總生存率進行分析,提示LMR 是術后總生存率的預后重要指標。本次研究結果顯示,NLR、LMR 都與前列腺癌患者的RFS有關。
盡管治療前高NLR、低LMR 水平為前列腺癌患者預后的影響因素,然而NLR、LMR 于腫瘤中的作用機制還不明確,這可能是因為:(1)前列腺癌屬于消耗性的慢性疾病,長時間的惡性消耗會導致患者營養(yǎng)不良,造血功能下降,進而引發(fā)血常規(guī)參數(shù)改變;(2)腫瘤會產生細胞因子,同時分泌腫瘤降解產物,進而導致患者出現(xiàn)全身炎癥,進一步使NLR水平提升、LMR水平降低,但是具體的機制還要進一步探索。
綜上所述,治療前LMR能夠作為前列腺癌患者預后評估的指標,治療前高NLR、低LMR水平的前列腺癌患者的預后較差。

