含釓化合物的羥基磷灰石復合支架制備的實驗研究
申福國 孔維麗 孫文才 郭 浩 姜 鑫 修 姜 肖文龍 于政恩 金 松
(1.齊齊哈爾醫學院附屬第三醫院骨外科,黑龍江 齊齊哈爾, 161000;2.齊齊哈爾醫學院附屬第三醫院呼吸內科,黑龍江 齊齊哈爾, 161000)
隨著社會的發展,創傷、慢性炎性反應、老齡化等導致的關節軟骨損傷發病率越來越高[1-2]。軟骨組織為特殊的結締組織,其分化性較強且缺乏血管、神經及淋巴結構[3]。軟骨組織損傷后自我修復能力有一定局限性,如不能進行很好修復,將來可能發展成骨性關節炎。因此,采用有效的方法治療早期關節軟骨損傷,阻止或減緩軟骨損傷的發展,對降低骨性關節炎的發病率起到十分重要的作用。
目前,臨床中治療膝關節軟骨損傷主要為自體軟骨移植手術、關節鏡下微骨折手術、同種異體軟骨移植手術、生物支架移植手術等治療方法,但是臨床中各種治療方法均存在一定局限性,其臨床治療效果并不可觀[4-6]。臨床患者軟骨損傷后很難修復到正常軟骨組織,臨床通過各種方法只能促進軟骨修復及軟骨搬運移植,這也一直為骨科醫生面對的難題。隨著組織工程學發展,軟骨再生及支架材料的興起,給軟骨損傷患者帶來了福音[7]。組織工程學領域涵蓋了生命科學和材料工程學等相關學科,希望通過組織再生從根本上解決組織或器官損傷、缺失所引起的相關臨床疾病,在現今疾病治療中占有重要地位。種子細胞、生物材料和生物活性因子,是組織工程的三個重要部分[8]。
人骨組織是一種含有有機成分和無機成分的復雜結締組織,其中無機成分主要是羥基磷灰石(hydroxyapatite,HA),人骨中磷灰石的含量在60%~70%,而磷灰石作為人體的主要骨礦物質,具有良好的生物學性能,而被大量地應用在骨修復材料領域。目前在骨修復研究領域已經研究出各種羥基磷灰石復合材料,其中較為成熟的是納米級羥基磷灰石,因其空間立體結構為晶體結構、尺寸,與人體骨組織非常接近,且羥基磷灰石能夠很好地與正常骨組織相結合,形成穩定結構。羥基磷灰石具有良好的生物相容性與成骨活性,在生物體內可提供早期的骨強度和骨長入基石。
目前國內外羥基磷灰石已經在臨床骨缺損中得到很好運用。人骨中還存在微量的稀土元素,其中就包括含量較少的釓元素(Gadolinium,Gd),微量稀土元素化合物對細胞增殖及分化有“Hormesis”效應[9]。有研究表明稀土元素微量釋放對細胞有“高抑低促”的作用,也就是高濃度的稀土元素能抑制細胞增殖,低濃度的稀土元素能夠促進細胞的增殖,同樣作為鑭系中排名第8 的釓元素也具備對細胞“高抑低促”的作用[10-11]。本研究利用羥基磷灰石為基石和微量稀土化合物釓促進細胞增殖特性,設計出一種新型復合支架材料,有望為臨床軟骨缺損提供新的支架材料。
1 材料與方法
1.1 材料
主要試劑見表1,主要儀器見表2。
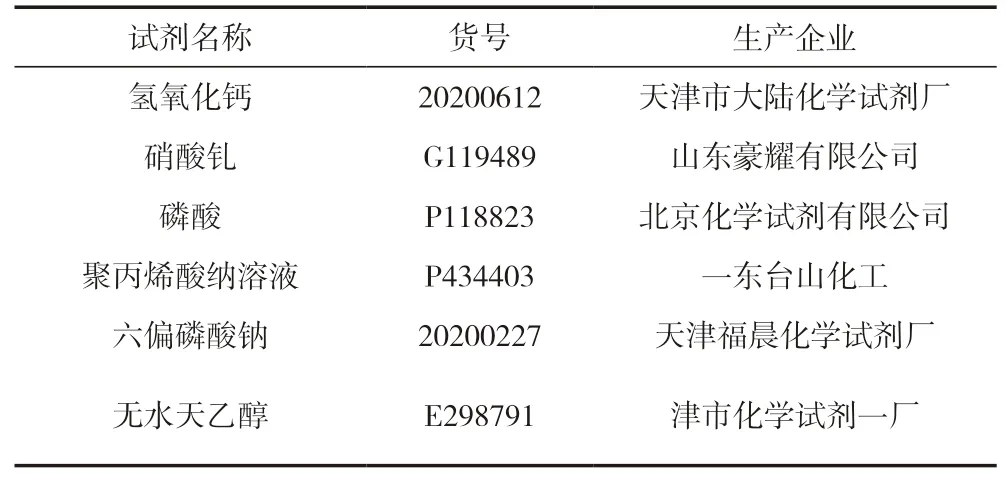
表1 主要試劑
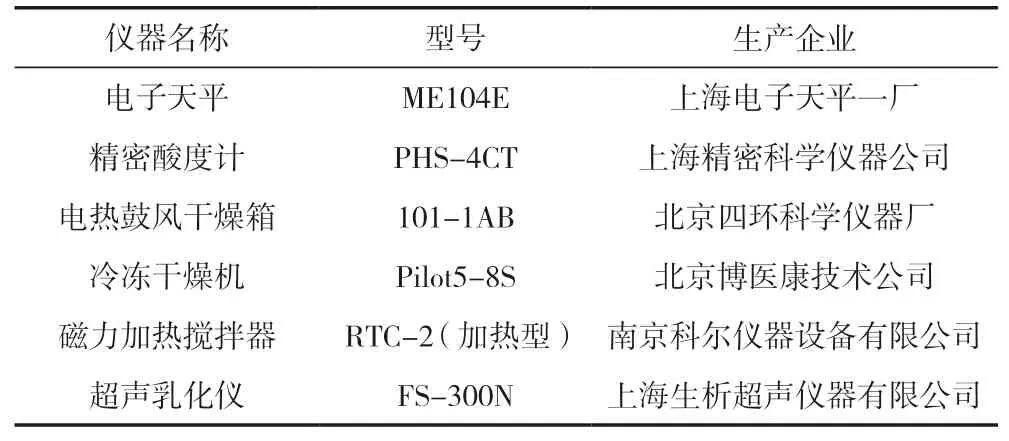
表2 主要儀器
1.2 主要方法
目前對于羥基磷灰石粉體的合成方法主要分為兩大類別,即液相合成法和高溫固相合成法,然而對于納米粉體的合成均為水液合成方法來完成。目前,化學材料方面液相合成法中主要有:水解法、水熱反應法、共沉淀法、溶膠-凝膠法、氣溶膠分解法、微乳液法及超聲波法等[12]。但是目前上述方法各有優缺點,為克服各種方法不足,采用多種方法組合進行制備,獲得很好效果。本研究查閱劉天健[13]研究參考過程通過均相沉淀法進行制備,具體如下。
1.2.1 制備Ca(H2P04)2·H20 晶體
取85%磷酸按照磷酸:水=4:1(體積比)稍加稀釋后緩慢滴入Ca(OH)2懸濁液,獲得澄清溶液后,在140 ℃烘箱中烘10~12 h,在85~95 ℃時結晶析出片狀無色晶體即Ca(H2P04)2·H20 晶體。
1.2.2 納米摻釓羥基磷灰石的制備過程
(1)取上述結晶溶解成Ca(H2P04)2·H20 溶液,穩定后加入飽和Ca(OH)2溶液,強力攪拌2 min,待溶液完全反應后進行下一步操作。
(2)根據不同的摻釓比例(本研究制備0%、1%、5%、10%和15%含釓化合物羥基磷灰石材料,以備后期實驗用),加入不同量的飽和的Ca(OH)2溶液,其配比條件是根據參考劉天健[13]研究,保證摩爾比(Ca+Gd)/P=1.67 的條件下,不同的Ca、Gd 含量與加入飽和的Ca(OH)2溶液量。
(3)取干燥無水的Gd(N03)3晶體,根據Ca、Gd 含量加入上述溶液后充分反應后靜止5 min,加入一定量的分散劑,檢測pH,加入NH3·H2O 調試,pH 為7 左右。
(4)取上述溶液用超聲處理10 min,1 h/次,連續5 個周期,最后靜置獲得膠凍狀備用。
(5)將溶膠狀液體低溫冷凍24 h,溫度設置為-20 ℃,干燥后再200 ℃煅燒獲得n-Gd/HAP 粉末
(6)取獲得的n-Gd/HAP 粉末研磨放置在圓柱形磨具內獲得含釓羥基磷灰石復合材料。
1.3 含釓化合物的羥基磷灰石復合支架的掃描電鏡觀察
將獲得的釓化合物的羥基磷灰石復合支架進行表面噴金過夜;待滿足要求后將噴金后的釓化合物的羥基磷灰石復合支架置于掃描電鏡下進行觀察。
2 結果
2.1 采用均相沉淀法獲得的含有釓化合物的羥基磷灰石外觀圖
獲得含釓化合物的羥基磷灰石粉末放置在圓柱形磨具內制備圓柱狀復合支架,獲得外觀支架形態約高5 mm 直徑為3 mm 大小圓柱形(為下一步體內植入試驗完整匹配骨缺損區域),大體形態觀察可見支架有大量空隙結構,空隙結構有利于細胞容納繁殖及骨組織長入。復合支架具有大量稀疏多孔結構也就具有大的表面積及高孔隙率,這樣有利于細胞粘附、營養物質輸送以及細胞代謝產物排出,更有助于細胞的充分滲透,見圖1。

圖1 含釓化合物的羥基磷灰石復合支架大體側面外觀

圖2 釓化合物的羥基磷灰石復合支架大體正面外觀
2.2 含釓化合物的羥基磷灰石復合支架掃描電鏡結果
對含釓化合物的羥基磷灰石復合支架進行電鏡掃描,可見支架內大量疏松交錯蜂窩樣空隙結構,空隙率高,連通性好;其電鏡下表面觀察可見含釓化合物的羥基磷灰石顆粒呈現不規則多邊形結構,排列錯綜復雜,相互交織形成三維立體微孔結構,見圖3。

圖3 含釓化合物的羥基磷灰石復合支架電鏡圖(1.00 μm)
3 討論
目前在組織工程研究領域,國內外已經取得了一定成果,但是由于材料性能及制備過程均存在諸多亟待解決的問題:人體關節骨軟骨復合組織是組分和結構較為復雜的功能組織,理想的構建策略不是將再造的軟骨和骨組織簡單地縫合或粘合在一起。設計仿生功能結構有望解決再造組織質量缺陷、移植物與宿主整合欠佳、易松動等問題,研發新型支架材料已成為目前骨科組織工程領域熱門課題。
羥基磷灰石(HA)是目前研究較多的活性生物材料之一,因其具有良好的生物相容性和一定的力學性能,近年來備受青睞。人骨中磷灰石的含量在60%~70%,而羥基磷灰石作為人體的主要骨礦物質,具有良好的生物學性能,而被大量地研究應用于骨修復材料領域,因此,目前在骨修復研究領域已經研究出各種羥基磷灰石復合材料,其中較為成熟的還是納米級羥基磷灰石,因其空間立體結構為晶體結構、尺寸,與人體骨組織非常接近,大量研究發現納米級羥基磷灰石具有無毒性、無刺激性、無免疫原性、無不良反應等優點,并且具有很好的生物相容性及優良的骨傳導性和誘導成骨性,且羥基磷灰石能夠很好地與正常骨組織相結合,形成穩定結構[14-16]。羥基磷灰石具有良好的生物相容性與成骨活性,在生物體內可提供早期的骨強度和骨長入基石。
近年來,隨著對稀有元素深入研究發現,高分散均勻的稀土納米粒子(NPs)的成功合成促使人們進一步探索含Gd的微/納米材料在生物醫學中的應用[17-19]。LARANJEIRA等[20]使用NaGdF4NPs 探針在體內進行腫瘤靶向MR 成像。XU 等[21]研究了NaGdF4 釋放了低水平的自由離子,所以它是無毒的。合成的羥基磷灰石納米粒子(HA NPs)在化學成分和結構上與天然骨相似。與HA 陶瓷相比,HA NPs 具有更大的納米尺寸和比表面積,因此具有更好的生物降解性和生物活性。GdPO4等稀土磷酸鹽具有毒性低、分子穩定性好等優點,目前在臨床給藥或腫瘤治療方面得到很好運用[22-24]。人骨中還存在微量的稀土元素,其中釓元素在臨床運用較多,目前安全性相對較好。本研究設想運用稀土元素釓對細胞的影響存在“Hormesis”效應,在體內少量釋放,促進細胞增殖。
獲得含釓化合物的羥基磷灰石形態大體滿意,空隙率較高,基本強度較好,已經滿足實驗基本需求,掃描電鏡中發現含釓化合物的羥基磷灰石復合支架緊密排列、相互連接的同時保持了相互之間微孔的存在。材料的微孔隙率一直不容易被支架材料研究中所重視,然而在組織工程支架材料評估方向,大孔隙和相互之間連通性良好的微孔隙共同存在,能夠更好地促進成骨細胞在支架上的粘附和生長,為支架材料在組織工程骨中發揮更大的作用,奠定了良好的基礎條件。本實驗獲得的含釓化合物的羥基磷灰石復合支架電鏡下掃描可見支架內大量疏松交錯蜂窩樣空隙結構,空隙率高,連通性好;對其電鏡下表面觀察可見含釓化合物的羥基磷灰石顆粒呈現不規則多邊形結構,排列錯綜復雜,相互交織形成三維立體微孔結構,為將來進行種子細胞的增殖、分化提供了前期基礎條件。支架復合材料需要一定強度、孔隙率等復雜結構,才能更加真實地模擬人體的微環境,本實驗中的含釓化合物的羥基磷灰石材料滿足了孔隙率及大孔徑共存的三維立體結構,其對細胞增殖的能力值得期待。
本實驗制備的含釓化合物的羥基磷灰石復合支架材料,其外觀及電鏡下已經具有很好的孔隙率及大孔徑的三維立體微孔結構,但是其支架的細胞毒性及共培養后細胞增殖能力的影響,仍需要我們進一步深入研究。

