聚焦中考化學“酸堿鹽”考查熱點
吳甫紅
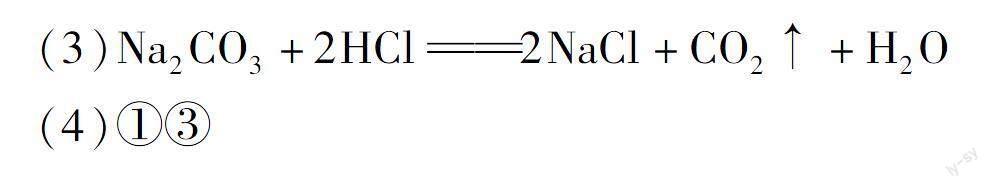
摘要:酸、堿、鹽知識內容豐富,是整個初中化學的核心,歷年來都是中考化學的命題熱點,試題體現理論聯系實際,體現學科間相互聯系.文章據此對中考化學中的酸堿鹽知識的考查內容及其常見熱點題型進行了分類和總結.
關鍵詞:題型;酸堿鹽;中考化學
中圖分類號:G632文獻標識碼:A文章編號:1008-0333(2023)32-0125-03
酸、堿、鹽是身邊化學物質中的重要化合物,一直是中考命題的熱點.不但考查有關酸、堿和鹽的基礎知識,同時也考查酸、堿和鹽在生產生活中的應用,常見題型為選擇題、填空題和探究題[1].
1 考查酸堿指示劑
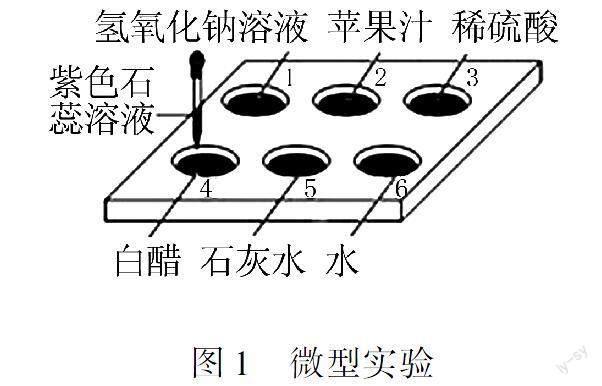
例1(2023·重慶B卷)微型化學實驗,因節能環保備受青睞.某化學興趣小組設計了如圖1所示的微型實驗,探究紫色石蕊溶液變色規律.據圖回答下列問題.
步驟1:向點滴板1~6號的孔穴中先加入如圖1所示的試劑,再分別滴入2滴紫色石蕊溶液.6號孔穴中水的作用是.
步驟2:將步驟1中所得的1號溶液和4號溶液互滴后溶液顏色發生明顯變化,選出下列組合中互滴后溶液顏色有明顯變化的是(填序號).
A.1號、5號B.1號、3號
C.3號、4號D.4號、5號
解析步驟1:1~5號的孔穴中分別是酸性、堿性溶液,水是中性溶液,測6號孔穴中水的作用是作對比.步驟2:將步驟1中所得的1號溶液和4號溶液互滴后溶液顏色發生明顯變化,即酸性、堿性溶液互滴后溶液顏色發生明顯變化,1號、5號都是堿性溶液,互滴后溶液顏色不會發生改變,A錯誤;1號、3號分別是堿性、酸性溶液,互滴后溶液顏色發生改變,B正確;3號、4號都是酸性溶液,互滴后溶液顏色不會發生改變,C錯誤;4號、5號分別是酸性、堿性溶液,互滴后溶液顏色發生改變,D正確.
答案:作對比BD
2 考查常見酸堿鹽的用途
例2(2023·遼寧丹東)下列物質在生活、生產中的應用不正確的是().
A.熟石灰用于食品干燥劑
B.火堿用于制取爐具清潔劑
C.氯化鈉用作食品調味劑
D.碳酸鈣用作補鈣劑
解析熟石灰不具有吸水性,不能用于食品干燥劑,A錯誤;火堿是氫氧化鈉的俗稱,能與油脂反應,可用于制取爐具清潔劑,B正確;氯化鈉可用作食品調味劑,C正確;碳酸鈣可用作補鈣劑,D正確.
答案:A
3 考查酸的化學性質
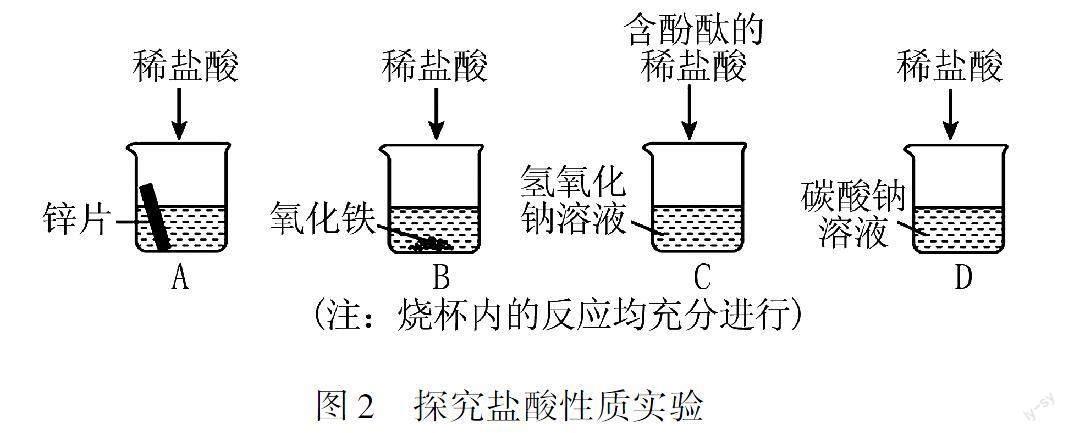
例3(2023·陜西)化學學習小組同學在探究鹽酸的化學性質時,進行了如圖2所示的實驗.
(1)A中看到的現象是.
(2)反應后溶液顏色為黃色的是(填字母).
(3)D中發生反應的化學方程式是.
(4)探究實驗結束后,用長滴管吸取C中的溶液逐滴加入B中,開始無沉淀生成,后生成紅褐色沉淀.則下列分析推理合理的是(填序號).
①長滴管中吸取的C中溶液為紅色
②滴加前,B中有固體剩余
③滴加后,B中溶液pH變大
解析(1)鋅與稀鹽酸反應生成氫氣,其反應的現象是產生大量氣泡;(2)A、D中均有氣體產生,B中氧化鐵與鹽酸反應生成黃色的氯化鐵溶液,C中無明顯現象或溶液變為紅色;(4)C中溶液逐滴滴入B中,開始無沉淀生成,后生成紅褐色沉淀,說明C中氫氧化鈉過量,B中鹽酸過量.由此可確定,C中溶液為紅色,B中的氧化鐵完全反應且稀鹽酸過量.滴加前,B溶液呈酸性,pH小于7,加入C中溶液后,酸堿中和,溶液的酸性減弱,pH增大.
答案:(1)鋅片表面產生無色氣泡(2)B
(3)Na2CO3+2HCl2NaCl+CO2↑+H2O
(4)①③
4 考查堿的化學性質
例4(2023·山西)以典型物質為核心進行問題的設置與整合,是我們全面認識物質性質及應用的有效途徑.小明同學在小組合作學習過程中,對氫氧化鈉的相關問題,以結構圖(如圖3所示)的形式進行了如下梳理,聯系實際,解決問題:
(1)氫氧化鈉在生活中可用來.
(2)氫氧化鈉在空氣中吸水后的熱量變化為.
(3)氫氧化鈉使用時必須十分小心,原因是.
(4)檢驗氫氧化鈉溶液的酸堿度,最簡單的方法是.
(5)向氫氧化鈉溶液中滴加硫酸銅溶液,發生反應的化學方程式為.
解析(1)氫氧化鈉可以與油脂發生反應,所以氫氧化鈉在生活中可用來去除油污;(2)氫氧化鈉溶于水放出熱量,所以氫氧化鈉在空氣中吸水后的熱量變化為放熱;(3)氫氧化鈉屬于堿,具有強腐蝕性,所以使用氫氧化鈉必須十分小心;(4)檢驗溶液的酸堿度最簡單的方法是使用pH試紙檢測;(5)向氫氧化鈉溶液中滴加硫酸銅溶液,氫氧化鈉與硫酸銅反應生成硫酸鈉和氫氧化銅沉淀,發生反應的化學方程式為2NaOH+CuSO4Na2SO4+ Cu(OH)2↓.
答案:(1)去除油污(合理即可)(2)放熱(3)有強腐蝕性(4)用pH試紙檢測(5)2NaOH+CuSO4Na2SO4+Cu(OH)2↓
5 考查pH及其應用
例5(2023·湖南株洲)健康人的體液必須維持在一定的酸堿度范圍內,如果出現異常,則可能導致疾病.表1是人體內的一些體液和排泄物的正常pH范圍.
下列有關說法正確的是().
A.當膽汁pH<7.1或pH>7.3時,人體可能導致疾病
B.胃液一定顯酸性,尿液一定顯堿性
C.可使用廣泛pH試紙測定血漿的pH是否在正常范圍內
D.膽汁、血漿都呈堿性且膽汁的堿性比血漿強
解析胃液的pH范圍小于7,一定顯酸性.尿液的pH范圍為4.7~8.4,有可能顯酸性,也可能顯堿性,還可能顯中性,B錯誤;廣泛pH試紙測得的pH是整數,不能精確到小數位,C錯誤;膽汁的pH范圍為7.1~7.3,大于7,呈堿性,血漿的pH范圍為7.35~7.45,大于7,呈堿性,膽汁的堿性比血漿弱,D錯誤.
答案:A
6 考查中和反應
例6(2023·江蘇蘇州)常溫下,將10 mL 5% NaOH溶液逐滴加入盛有5 mL 5%稀鹽酸(含2滴酚酞)的錐形瓶中,邊滴邊振蕩.下列有關說法正確的是().
A.滴加過程中,錐形瓶內溶液中Na+的數目不斷增加
B.滴加過程中,溶液恰好由無色變為紅色時,溶液pH為7
C.滴加過程中,錐形瓶內溶液溫度不斷升高
D.滴加結束后,取少量溶液蒸干,所得白色固體是NaCl
解析氫氧化鈉和鹽酸反應成氯化鈉和水,滴加過程中,錐形瓶內溶液中Na+的數目不斷增加,A正確;滴加過程中,溶液恰好由無色變為紅色時,溶液顯堿性,溶液pH大于7,B錯誤;中和反應屬于放熱反應,滴加過程中,錐形瓶內溶液溫度不一定不斷升高,若是恰好完全反應后,繼續滴加氫氧化鈉溶液,溶液的溫度會降低,C錯誤;滴加結束后,取少量溶液蒸干,所得白色固體不一定是NaCl,也可能是氯化鈉和氫氧化鈉的混合物,D錯誤.
答案:A
7 考查鹽的化學性質
例7(2023·山東濱州)某化學興趣小組的同學在預習了純堿的相關知識后,對純堿的制備和部分化學性質展開項目式學習,并對部分實驗廢液進行了拓展探究.
任務一:了解純堿的制備—“侯氏制堿法”
“侯氏制堿法”的主要過程是利用飽和食鹽水先后吸收兩種氣體,生成碳酸氫鈉和氯化銨,再加熱碳酸氫鈉即可制得純堿.
(1)“侯氏制堿法”中的“侯氏”指的是我國著名化學家.
(2)“侯氏制堿法”的主要過程中需要吸收的兩種氣體是(填字母序號).
A.Cl2B.NH3C.SO2D.CO2
任務二:探究純堿與酸、堿、鹽的反應
向盛有一定量純堿溶液的三支試管中分別加入稀鹽酸、澄清石灰水、氯化鋇溶液,實驗現象記錄見表2.
解析任務一:(1)“侯氏制堿法”中的“侯氏”指的是我國菩名化學家侯德榜;(2)我國化工先驅侯德榜發明的“侯氏制堿法”是利用飽和食鹽水依次吸收氨和二氧化碳最終制得碳酸鈉等產品,該法的主要反應為NaCl+CO2+NH3+H2ONaHCO3↓+NH4Cl,則“侯氏制堿法”的主要過程中需要吸收的兩種氣體是CO2和NH3.任務二:向盛有一定量純堿溶液中加入稀鹽酸,純堿是碳酸鈉的俗稱,碳酸鈉溶液與稀鹽酸反應生成氯化鈉、二氧化碳和水,則可觀察到的現象是有氣泡產生.
答案:任務一:(1)侯德榜(2)BD
任務二:產生氣泡
參考文獻:
[1] 人民教育出版社,課程教材研究所,化學課程教材研究開發中心.義務教育教科書·化學[M].北京:人民教育出版社,2015.
[責任編輯:季春陽]

