基于免疫組化和癌癥基因組圖譜數(shù)據(jù)分析SOD1在宮頸癌中的表達(dá)
林冰潔,王齊心,聶曉菁,2,張孜睿卓,史永華,2
(1.新疆醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院病理學(xué)教研室,新疆 烏魯木齊 830017;2.新疆醫(yī)科大學(xué)新疆地方病分子生物學(xué)重點(diǎn)實(shí)驗(yàn)室,新疆 烏魯木齊 830017)
宮頸癌(cervical cancer,CC)是威脅女性死亡的主要原因之一,2020年全球約有60萬(wàn)例新發(fā)病例和34萬(wàn)例死亡[1],是僅次于乳腺癌、結(jié)直腸癌、肺癌的第四常見(jiàn)腫瘤[2]。中國(guó)是宮頸癌發(fā)病率和死亡率最高的國(guó)家之一[3]。宮頸癌的一個(gè)重要臨床病理特點(diǎn)是常伴有慢性炎癥。微環(huán)境中持續(xù)存在的炎性刺激和缺氧致使活性氧簇(reactive oxygen species,ROS)顯著增多,局部代謝異常。為抵抗過(guò)量的ROS,癌細(xì)胞內(nèi)的抗氧化系統(tǒng)也相應(yīng)增強(qiáng),此時(shí)抗氧化途徑的激活被認(rèn)為是癌癥發(fā)生過(guò)程的一個(gè)關(guān)鍵事件[4]。
超氧化物歧化酶(superoxide dismutases,SOD)是一種催化超氧化物自由基脫位為過(guò)氧化氫和分子氧的抗氧化酶。SOD1(Cu/Zn-SOD)作為其中的一種異構(gòu)體,主要分布在細(xì)胞內(nèi),是一種內(nèi)源性蛋白[5]。SOD1作為一種抗氧化劑,除與衰老相關(guān)的氧化應(yīng)激有關(guān)外[6],還在調(diào)節(jié)細(xì)胞、保護(hù)基因組DNA穩(wěn)定方面發(fā)揮重要的作用[7]。由于SOD1能夠清除自由基,通常被認(rèn)為其具有抑癌作用。深入研究發(fā)現(xiàn),隨著癌細(xì)胞內(nèi)的ROS濃度升高,其引起的氧化應(yīng)激反應(yīng)隨之上調(diào),在肺腫瘤、乳腺腫瘤和鼻咽癌中均觀察到SOD1表達(dá)升高[8-11]。本次研究旨在探討SOD1在宮頸癌中的表達(dá)及其臨床意義。
1 資料與方法
1.1 一般資料
選擇新疆醫(yī)科大學(xué)附屬腫瘤醫(yī)院2016年11月至2019年8月手術(shù)切除標(biāo)本共150例,包括宮頸鱗癌、宮頸上皮內(nèi)瘤變(cervical intraepithelial neoplasia,CIN) II-III和正常宮頸組織各50例。納入標(biāo)準(zhǔn):宮頸鱗癌均經(jīng)病理確診;無(wú)嚴(yán)重并發(fā)癥;有完整的病理資料。所有研究對(duì)象均知情同意自愿參與研究。收集標(biāo)本相關(guān)的臨床病理信息,包括年齡、臨床分期、腫瘤直徑、病理分級(jí)、浸潤(rùn)深度、淋巴結(jié)轉(zhuǎn)移等。臨床分期根據(jù)國(guó)際婦產(chǎn)科聯(lián)盟(International Federation of Gynecology and Obstetrics,FIGO)的標(biāo)準(zhǔn)確定。
1.2 免疫組化
應(yīng)用免疫組化(immunohistochemistry,IHC)檢測(cè)SOD1在宮頸組織中的表達(dá)。按照免疫組化的常規(guī)操作進(jìn)行,即準(zhǔn)備好2μm厚的石蠟宮頸組織切片,脫蠟水化,抗原修復(fù)后滴加抗SOD1兔單克隆抗體(Priteintech,22206-1-AP) 4℃過(guò)夜,然后二抗室溫孵育(羊抗兔IgG,中國(guó)北京中杉金橋公司)30分鐘,3,3’-二氨基聯(lián)苯胺(3,3N-Diaminobenzidine,DAB)顯色,蘇木素復(fù)染,脫水,透明,封片。SOD1染色由兩名新疆醫(yī)科大學(xué)病理教研室的專(zhuān)家審閱評(píng)價(jià)。SOD1結(jié)果用Image Pro Plus6.0軟件進(jìn)行量化分析。
1.3 TCGA數(shù)據(jù)庫(kù)分析
本研究借助R2生物信息平臺(tái)(http://hgser-ver1.amc.nl/cgi-bin/R2/main.cgi)對(duì)TCGA-305-rsem-tcgars數(shù)據(jù)集宮頸鱗癌組織樣本中SOD1 mRNA的表達(dá)進(jìn)行了數(shù)據(jù)挖掘,并分析KIM數(shù)據(jù)庫(kù)中300例宮頸癌(包括宮頸鱗癌、腺癌和腺鱗癌)樣本中SOD1 mRNA的表達(dá)水平與組織學(xué)類(lèi)型的關(guān)系。
1.4 統(tǒng)計(jì)學(xué)方法
采用SPSS 22.0軟件進(jìn)行統(tǒng)計(jì)學(xué)分析。計(jì)數(shù)資料用例數(shù)(n)和百分比(%)表示,組間比較采用卡方檢驗(yàn)或方差分析。Kaplan-Meier法和Log-rank檢驗(yàn)分析SOD1表達(dá)與生存的關(guān)系。P<0.05表示差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 SOD1在宮頸組織中的定位和表達(dá)
免疫組化結(jié)果顯示,50例宮頸鱗癌中,38例(76%)SOD1表達(dá)陽(yáng)性;50例CIN中,26例(52%)SOD1表達(dá)陽(yáng)性;50例正常組織中,16例(32%)SOD1表達(dá)陽(yáng)性。SOD1在宮頸鱗癌中表達(dá)最高、CIN次之、正常組織中最低,差異有統(tǒng)計(jì)學(xué)意義(χ2=19.50,P<0.05)。正常宮頸組織中SOD1均在胞漿中表達(dá);CIN組織中,單純胞漿表達(dá)12例,單純胞核表達(dá)8例,胞漿和胞核均表達(dá)6例;宮頸鱗癌組織中,單純胞漿表達(dá)7例,單純胞核表達(dá)23例,胞漿和胞核均表達(dá)8例,見(jiàn)圖1。在正常宮頸組織、CIN與宮頸鱗癌組織中,隨著宮頸病變級(jí)別的升高,SOD1胞核陽(yáng)性表達(dá)率逐漸升高,其差異具有統(tǒng)計(jì)學(xué)意義(χ2=6.850,P<0.05)。
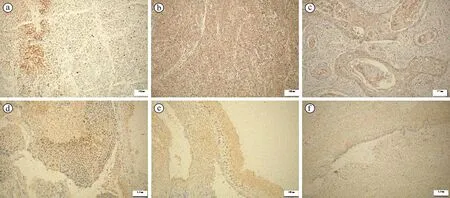
注:(a)宮頸鱗癌組織中SOD1的胞核表達(dá);(b)宮頸鱗癌組織中SOD1的胞漿表達(dá);(c)宮頸鱗癌組織中SOD1的胞核和胞漿共表達(dá);(d)CIN組織中SOD1的胞核表達(dá);(e)CIN組織中SOD1的胞漿表達(dá);(f)正常宮頸組織中SOD1在基底細(xì)胞的表達(dá)(SP×200)。
2.2 宮頸鱗癌組織SOD1表達(dá)與臨床病理參數(shù)的關(guān)系
在宮頸鱗癌中,SOD1的表達(dá)與組織浸潤(rùn)有關(guān),其陽(yáng)性表達(dá)組的宮頸癌浸潤(rùn)深度明顯高于陰性表達(dá)組,差異具有統(tǒng)計(jì)學(xué)意義(χ2=10.424,P=0.001);SOD1的表達(dá)與病理學(xué)分級(jí)、腫瘤大小、淋巴結(jié)轉(zhuǎn)移和臨床分期均無(wú)關(guān)(P>0.05),見(jiàn)表1。
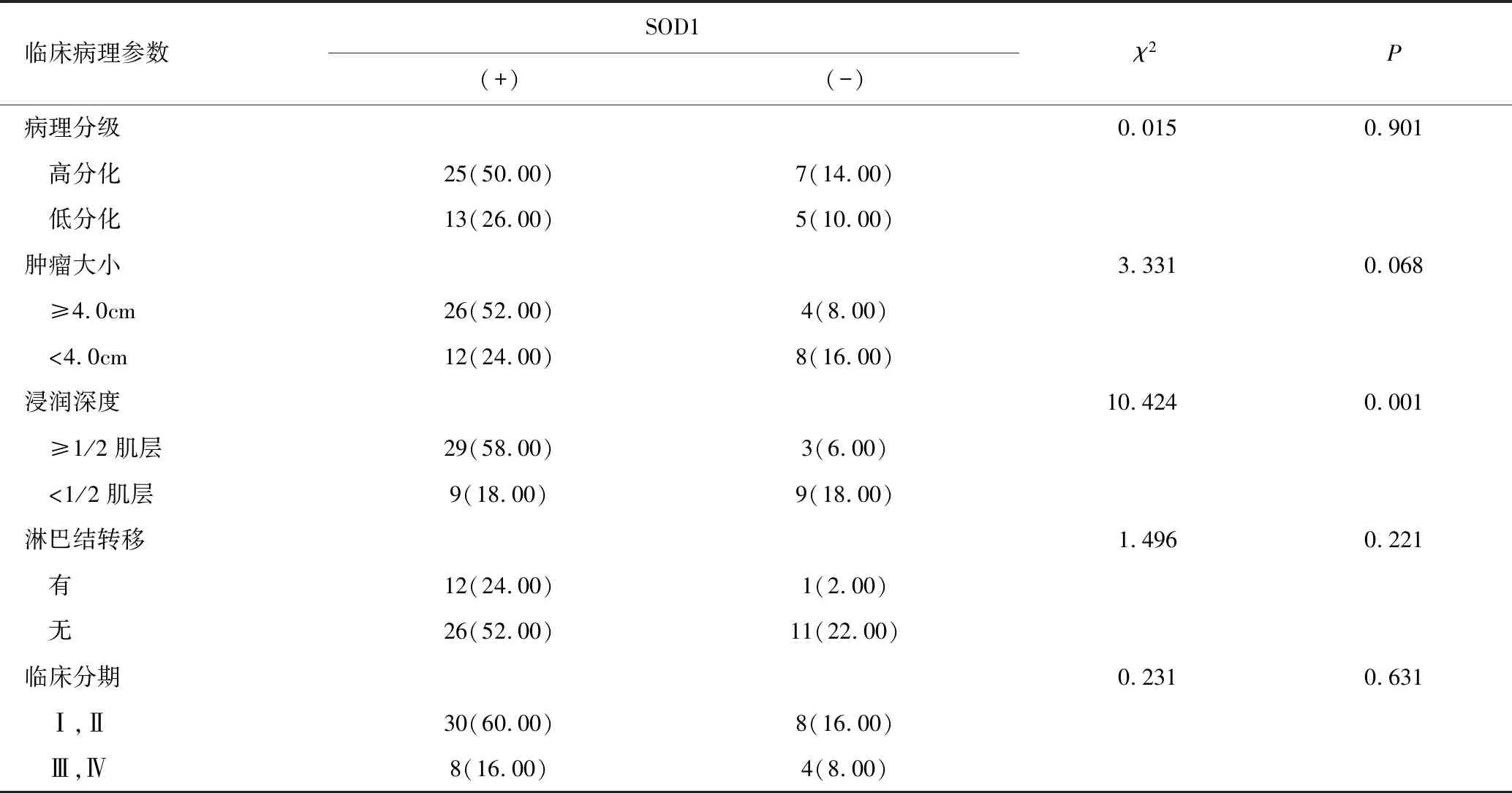
表1 宮頸鱗癌組織SOD1表達(dá)與臨床病理參數(shù)的關(guān)系 [n(%)]
2.3 R2生物信息平臺(tái)中SOD1表達(dá)分析
借助R2生物信息平臺(tái)對(duì)TCGA-305-rsem-tcgars數(shù)據(jù)集宮頸鱗癌組織樣本中SOD1 mRNA的表達(dá)進(jìn)行了數(shù)據(jù)挖掘和分析,結(jié)果顯示,SOD1 mRNA在宮頸癌所有臨床分期中均表達(dá),見(jiàn)圖2。Kaplan-Meier生存分析提示,SOD1高表達(dá)組患者(120例)較SOD1低表達(dá)組(172例)具有更好的預(yù)后(χ2=5.18,P=0.023),見(jiàn)圖3。對(duì)KIM-300-custom-ilmnht12v4數(shù)據(jù)集中宮頸癌組織樣本SOD1 mRNA的表達(dá)情況進(jìn)行分析,結(jié)果顯示,SOD1在不同組織學(xué)類(lèi)型宮頸癌中的表達(dá)差異具有統(tǒng)計(jì)學(xué)意義(F=4.84,P=0.009),見(jiàn)圖4。
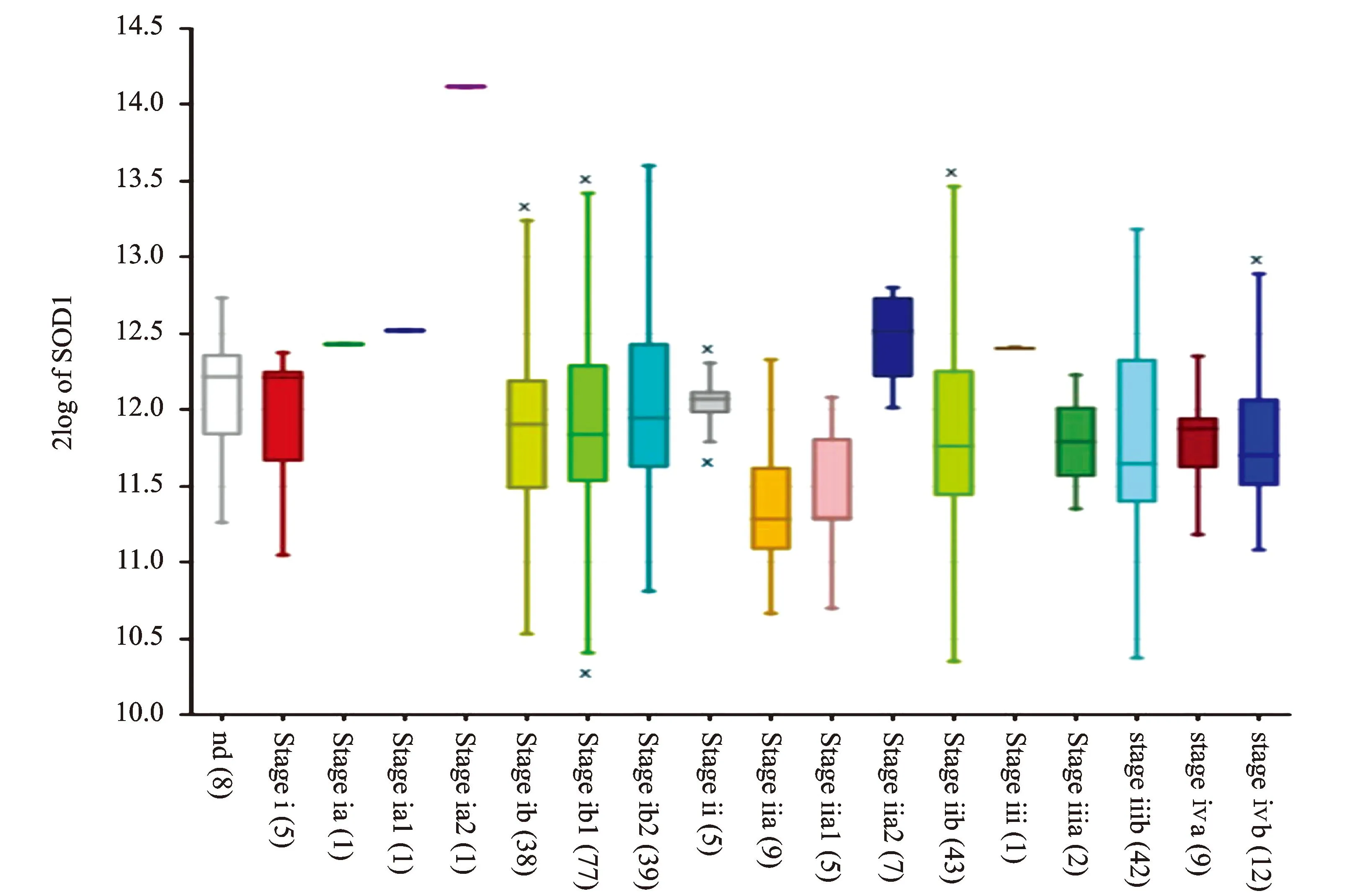
圖2 SOD1 mRNA在305例宮頸鱗癌中的表達(dá)
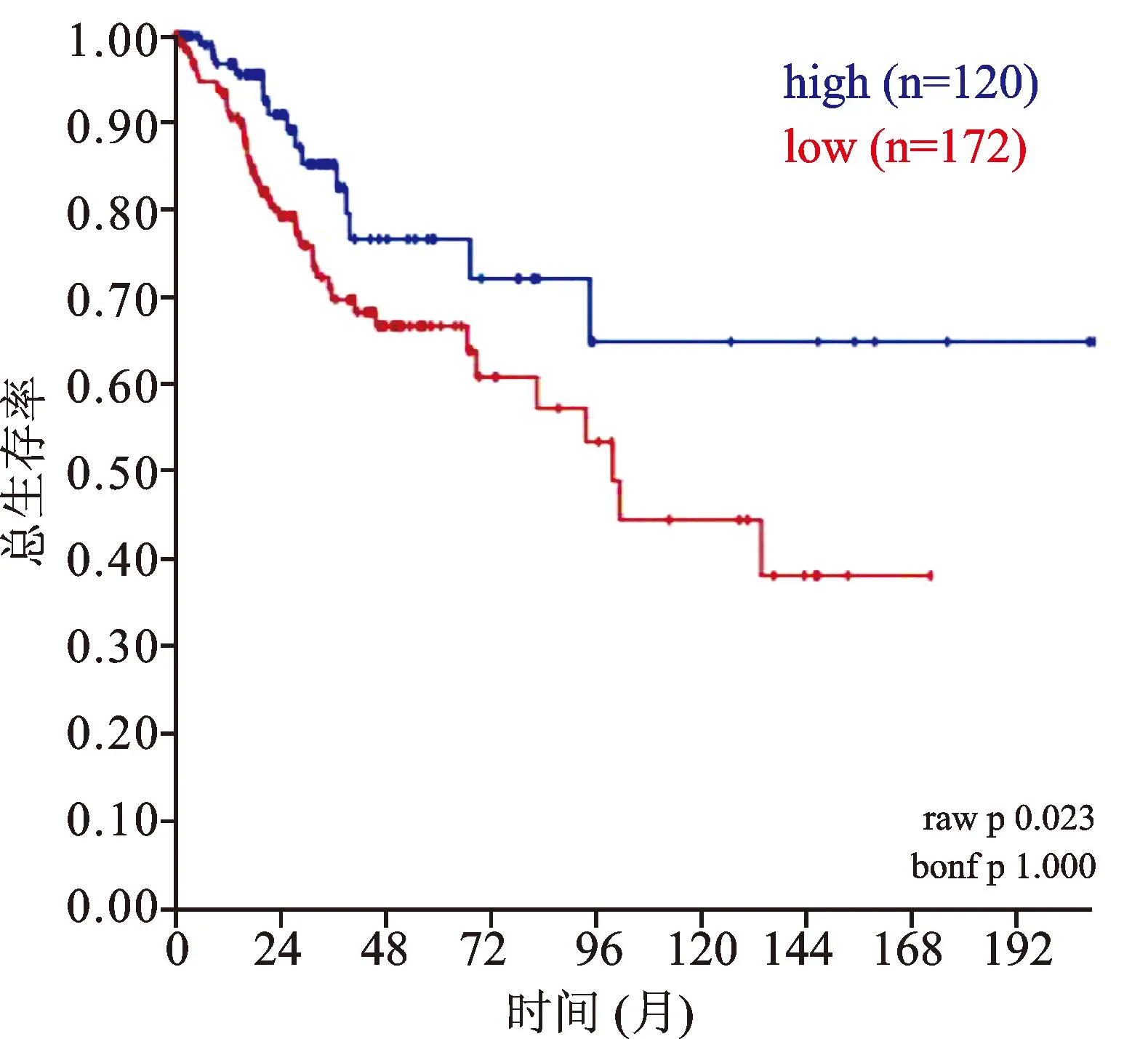
圖3 292例宮頸鱗癌中SOD1表達(dá)與生存的關(guān)系
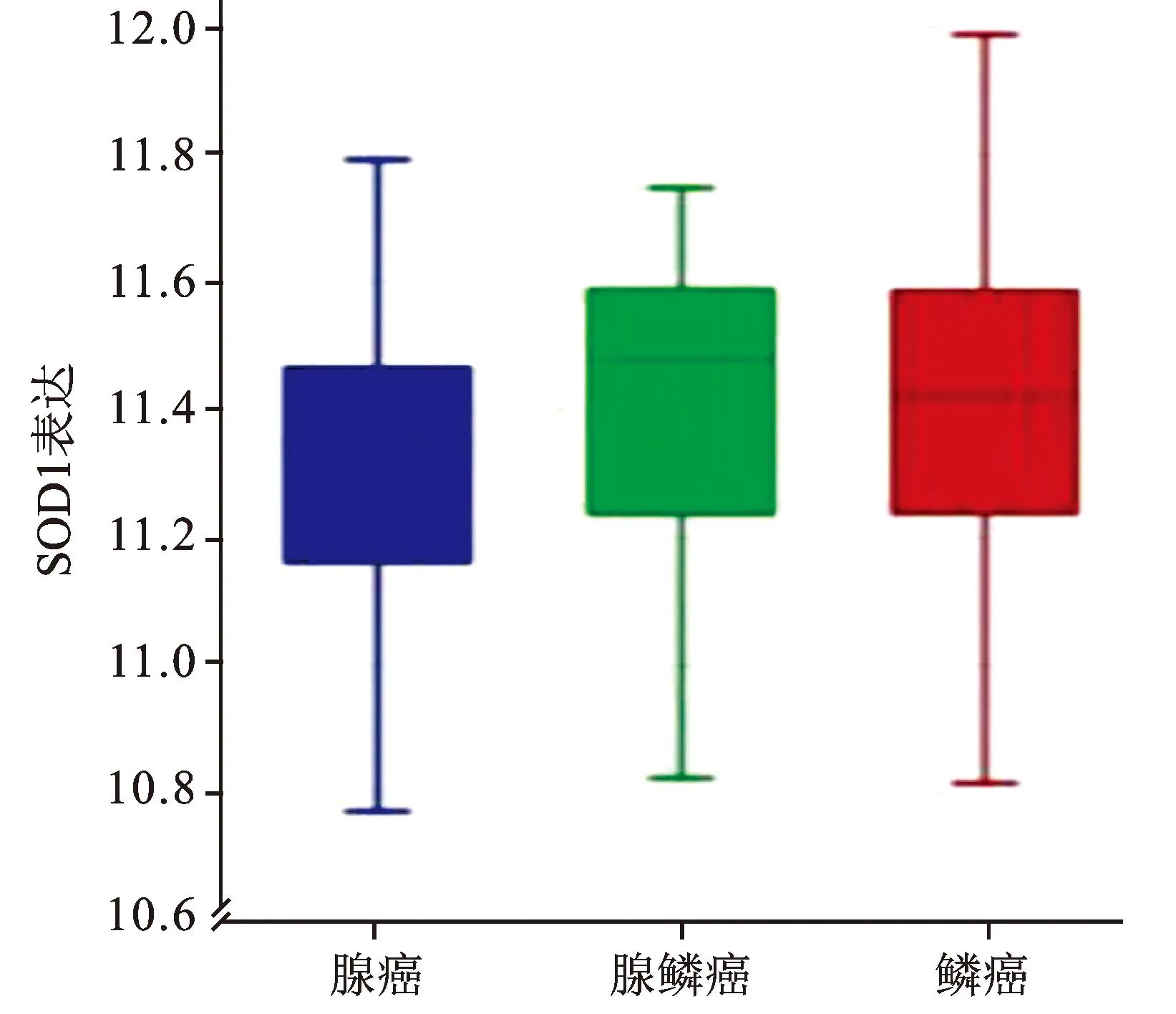
圖4 300例宮頸癌中SOD1表達(dá)與組織學(xué)類(lèi)型的關(guān)系
3 討論
3.1 病理狀態(tài)下SOD異常表達(dá)的生物學(xué)意義
SOD作為抗氧化系統(tǒng)的重要代表,其表達(dá)升高是慢性炎癥持續(xù)刺激的必然結(jié)果。慢性炎癥導(dǎo)致單核巨噬細(xì)胞系統(tǒng)的激活,產(chǎn)生高水平的ROS[12],ROS水平急劇增加至有毒濃度,氧化應(yīng)激將造成不可逆的損傷[13]。此時(shí),為抵抗過(guò)量的ROS,體內(nèi)的抗氧化酶SOD表達(dá)上升。氧化應(yīng)激和慢性炎癥過(guò)程是緊密耦合的,如果不能阻止這些過(guò)程,可能會(huì)導(dǎo)致驅(qū)動(dòng)癌變[14]。眾所周知,宮頸癌與人乳頭瘤病毒(human papilloma virus,HPV)持續(xù)感染密切相關(guān),是慢性炎癥相關(guān)癌癥的典型代表。與正常細(xì)胞相比,癌細(xì)胞通常含有更高水平的ROS和抗氧化酶,特別是在晚期,癌細(xì)胞非常依賴(lài)高活性的抗氧化系統(tǒng)來(lái)維持快速增殖和存活[15]。人體中有三種SOD同工酶:SOD1提供了80%的總細(xì)胞SOD活性[16],在調(diào)節(jié)氧化應(yīng)激反應(yīng)中作為轉(zhuǎn)錄因子,可防止細(xì)胞過(guò)度損傷和凋亡[17];SOD2在不同類(lèi)型的腫瘤中具有致癌和抑癌的雙向作用[18];SOD3作為主要的ROS防御因子,在對(duì)胰腺導(dǎo)管癌的研究中發(fā)現(xiàn)其表達(dá)量降低與不良預(yù)后密切相關(guān)[19]。
本研究中,我們借助R2生物信息平臺(tái)對(duì)TCGA-305-rsem-tcgars數(shù)據(jù)集305例宮頸鱗癌組織樣本中的SOD1 mRNA表達(dá)進(jìn)行了數(shù)據(jù)挖掘和分析,結(jié)果顯示,SOD1高表達(dá)組患者的預(yù)后較好。同時(shí)對(duì)KIM-300-custom-ilmnht12v4數(shù)據(jù)集300例宮頸癌組織樣本中的SOD1 mRNA表達(dá)分析提示,SOD1在宮頸腺鱗癌的表達(dá)高于其在鱗癌、腺癌中的表達(dá),提示SOD1表達(dá)與宮頸癌的不同組織學(xué)類(lèi)型相關(guān)。可見(jiàn)SOD在腫瘤發(fā)生發(fā)展中的生物學(xué)行為非常復(fù)雜,值得深入探討。
3.2 宮頸癌中SOD1表達(dá)及其細(xì)胞定位的分析和意義
在本研究中,我們檢測(cè)并分析了SOD1蛋白在宮頸病變內(nèi)的表達(dá),結(jié)果顯示在正常宮頸組織、癌前病變、宮頸鱗癌中,隨著宮頸病變級(jí)別的升高,SOD1的表達(dá)逐漸升高。有證據(jù)表明,SOD1是一種致癌基因,在體內(nèi)促進(jìn)癌細(xì)胞增殖,加速腫瘤發(fā)展,并在人類(lèi)許多癌癥中過(guò)表達(dá)。Li[20]等研究顯示,SOD1在鼻咽癌中的表達(dá)顯著增加,且高表達(dá)患者的生存時(shí)間較短。Gomez等[9]研究發(fā)現(xiàn),SOD1對(duì)癌基因介導(dǎo)的乳腺癌細(xì)胞增殖至關(guān)重要,且增殖的特異性與癌細(xì)胞中超氧化物的升高相關(guān),但在正常細(xì)胞中并沒(méi)有觀察到這些。此外,在所有分子亞型的乳腺癌內(nèi),SOD1表達(dá)升高與較低的生存率和轉(zhuǎn)移增加密切相關(guān)。另有研究發(fā)現(xiàn),SOD1也在多發(fā)性骨髓瘤中表達(dá),其作用發(fā)生在疾病進(jìn)展的較晚階段,表明SOD1的表達(dá)增加提示著不良預(yù)后[21]。然而,本研究生物信息學(xué)分析表明SOD1高表達(dá)組的宮頸癌患者預(yù)后較好,與我們的實(shí)驗(yàn)結(jié)論及以上文獻(xiàn)報(bào)道不一致,對(duì)此我們分析如下:生物信息學(xué)分析的結(jié)果是基于SOD1 mRNA的表達(dá)數(shù)據(jù),我們的實(shí)驗(yàn)結(jié)果是基于免疫組化SOD1的蛋白表達(dá)數(shù)據(jù),SOD1轉(zhuǎn)錄水平和翻譯水平表達(dá)意義的不一致可能反映出SOD1存在翻譯后調(diào)控或修飾。酶活性發(fā)揮的整體機(jī)制復(fù)雜,僅在轉(zhuǎn)錄或者翻譯水平并不能推斷酶最后的活性,此過(guò)程涉及翻譯后修飾,細(xì)胞定位及與其他蛋白之間的互作。但這還需要我們進(jìn)一步研究來(lái)佐證[22]。
SOD1作為轉(zhuǎn)錄因子參與到癌癥進(jìn)程中[23]。在HeLa細(xì)胞中,SOD1已被證明與癌基因和抑癌基因的啟動(dòng)子結(jié)合,通過(guò)下調(diào)抑癌基因、上調(diào)致癌基因促進(jìn)腫瘤的發(fā)生。此外,SOD1除了抗氧化酶的作用外,還作為一種響應(yīng)H2O2的調(diào)控蛋白,在許多哺乳動(dòng)物基因的表達(dá)中發(fā)揮作用[24]。研究表明在應(yīng)對(duì)高水平H2O2(0.4mM)的氧化應(yīng)激時(shí),SOD1會(huì)轉(zhuǎn)移到細(xì)胞核,從而通過(guò)轉(zhuǎn)錄上調(diào)抗氧化基因的表達(dá)[17]。文獻(xiàn)報(bào)道,核SOD1蛋白表達(dá)在多種人體組織中,尤其在睪丸、小腦、乳房、皮膚真皮層中表達(dá)豐富[23],并在乳腺癌和肺癌的細(xì)胞核中不斷富集[4,9]。這支持了本研究中免疫組化染色實(shí)驗(yàn)結(jié)果,SOD1除在正常宮頸組織的胞漿內(nèi)表達(dá)外,還表達(dá)于基底細(xì)胞胞核內(nèi)。在正常宮頸組織逐漸進(jìn)展為宮頸癌的過(guò)程中,SOD1在胞漿的表達(dá)逐漸減少,而在胞核的表達(dá)量逐漸增高。SOD1的表達(dá)與宮頸癌臨床病理參數(shù)關(guān)系的分析結(jié)果顯示,SOD1在胞核的表達(dá)與組織浸潤(rùn)有關(guān)。在對(duì)KRAS驅(qū)動(dòng)的非小細(xì)胞肺癌(non-small cell lung cancer,NSCLC)的研究中報(bào)道,SOD1定位于細(xì)胞核,通過(guò)與PeBoW蛋白相互作用,在癌細(xì)胞增殖中起著重要的作用,并與NSCLC腫瘤的預(yù)后相關(guān)[4],這與本研究結(jié)果一致。
綜上所述,在宮頸癌的發(fā)生、發(fā)展進(jìn)程中, SOD1的異常表達(dá)與宮頸癌的浸潤(rùn)深度、組織學(xué)類(lèi)型有關(guān),宮頸癌中SOD1胞核表達(dá)量的增高對(duì)宮頸癌患者的預(yù)后具有一定的參考價(jià)值,開(kāi)發(fā)其抑制劑用于聯(lián)合抗腫瘤治療具有潛在的可能性。
- 中國(guó)婦幼健康研究的其它文章
- 實(shí)時(shí)超聲彈性成像技術(shù)與DCE-MRI在乳腺結(jié)節(jié)良惡性鑒別診斷中的應(yīng)用價(jià)值
- 蒙脫石散與雙歧桿菌三聯(lián)活菌對(duì)腹瀉患兒胃腸道菌群、炎癥因子的影響
- 早發(fā)性卵巢功能不全患者焦慮和抑郁影響因素分析
- 哮喘兒童TLR4基因多態(tài)性與其外周血炎癥因子及肺功能水平的相關(guān)性研究
- 肝素結(jié)合蛋白、白介素-1β、丙二醛與新生兒化膿性腦膜炎病情嚴(yán)重程度與轉(zhuǎn)歸的關(guān)系
- 孤獨(dú)癥譜系障礙患兒血清甘丙肽、神經(jīng)絲輕鏈水平與病情嚴(yán)重程度的相關(guān)性研究

