銅脅迫對人參生理參數和品質的影響研究
代鳴濤 梁 佳 郝甜甜 丁萬博 楊 鶴 許永華
(人參新品種選育與開發國家地方聯合工程研究中心,吉林 長春 130118)
人參(PanaxginsengC.A.Meyer)為五加科人參屬多年生宿根性草本植物,具有固脫生津、補氣養血等多種功效,被稱為“百草之王”[1]。人參國內產地主要分布于我國東北地區,是吉林省重要經濟作物[2]。人參是藥食兩用產品,2020年版《中華人民共和國藥典》[1]規定人參銅含量不得超過20 mg·kg-1,GB 15199-94《食品中銅限量衛生標準》[3]規定食品中銅的含量應≤10 mg·kg-1,2014年,《全國土壤污染狀況調查公報》[4]顯示我國16.1%的土壤受到不同程度污染,其中銅污染物點位超標率達2.1%。特別是近些年來高銅農藥和肥料的大量使用和工業三廢排放導致部分農田土壤銅污染嚴重[5]。正常情況下植物體內銅含量為5~30 mg·kg-1[6]。有研究發現,過量銅會導致辣椒(Capsicum annuumLinn.)發育不良,表現為各器官鮮重下降[7]。外源施加銅濃度為100 mg·kg-1時,空心菜(Ipomoea aquaticaForssk.)株高最大,當銅濃度繼續增加至超過銅毒性閾值時,其根系最先受損,吸水能力變差,后伴隨植株干枯、新葉皺縮卷曲、生物量嚴重降低等現象[8]。因此,全面了解土壤與植物中的銅含量對植物生長發育的影響對解決全球作物產量問題有重大意義。
植物通過各種吸收、運輸和抗氧化防御過程來抵抗銅的損傷。重金屬脅迫下,植物通過啟動抗氧化系統來清除體內多余的活性氧(reactive oxygen species,ROS)。研究證明,銅能夠提高編碼不同抗氧化劑,如過氧化物酶(peroxidase,POD)、過氧化氫酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)的基因轉錄水平[9]。在不同濃度銅(0.5、1、1.5、2 mmol·L-1)處理下,葡萄根系中的POD、SOD 和CAT 活性均隨濃度的增加先上升后下降[10]。同時細胞壁也是響應重金屬脅迫信號分子和代謝所在的位點,也是銅積累的主要場所,并參與植物對重金屬脅迫的響應過程[11]。有報道指出,蘋果植株將所吸收的大部分Cu2+固定在根系細胞壁和液泡中,并將其轉化為難溶性磷酸鹽或草酸鹽態等低毒或無毒化合物從而緩解Cu2+毒害[12]。木質素是細胞壁的重要組成成分,有研究表明,在生物與非生物脅迫下,植物的普遍反應之一是活性氧的積累[13],并伴隨有木質素含量的增加[14]。本研究通過分析不同濃度銅處理后人參抗氧化系統和木質素含量及其酶活變化情況,旨在提高人參在生長發育期間的抗逆性,為今后人參栽培解除銅毒害提供依據。
1 材料與方法
1.1 試驗材料
試驗材料為三年生人參種苗,采于吉林農業大學藥園,在吉林農業大學溫室人工氣候室中進行水培試驗。
1.2 試驗設計
選擇大小、鮮重基本一致且無病害的三年生人參種苗,每個水培管中加入1.5 L 1/2 Hoagland 營養液,于2023年2月22日開始水培培養。培養10 d 后挑選長勢一致弓形幼苗進行銅脅迫處理,CuSO4濃度分別為0、50、150、300 和500 μmol·L-1,記為CK、A1、A2、A3和A4。處理期間每3 d更換一次營養液,每天通氧6 h,光照培養室中晝夜條件為14 h/10 h,溫度為20 ℃,于處理21 d時取樣,每個處理5次重復。
1.3 測定項目與方法
1.3.1 人參不同部位銅含量的測定及亞細胞定位銅含量采用iCAP Q 三重四極桿電感耦合等離子質譜儀(美國Thermo 公司)測定[15]。稱取0.4 g 在-80 ℃貯存的冷凍組織,用研缽研磨成粉末,并在預冷提取緩沖液(成分包括50 mmol·L-1Tris-HC1、250 mmol·L-1蔗糖、5 mmol·L-1抗壞血酸、1.0 mmol·L-1二硫赤蘚醇,pH值7.5)中均勻化。采用差速離心法將不同組織的亞細胞分離為細胞壁組分、可溶性組分(含液泡組分)和細胞器組分。將勻漿液于4 000 r·min-1離心15 min。第一批殘渣主要是細胞壁組分。上清液在16 000 r·min-1下進一步離心30 min。其殘渣為細胞器組分,上清液為可溶性組分。所有步驟均在4 ℃下進行。將不同組分在145 ℃下用HNO3∶HCIO4(V∶V,2∶1)的氧化酸混合物進行消解。待消解完畢,用去離子水定容至50 mL。最后使用三重四極桿電感耦合等離子體質譜儀測定不同亞細胞組分中的銅含量。
1.3.2 丙二醛含量的測定 丙二醛含量測定采用硫代巴比妥酸法[16]。
1.3.3 過氧化氫含量的測定 過氧化氫含量的測定采用苯酚-硫酸肽法[16]。
1.3.4 抗氧化酶活性的測定 超氧化物歧化酶(SOD)、過氧化氫酶(CAT)和過氧化物酶(POD)活性的測定參照《植物生理學實驗指導》[17]。
1.3.5 木質素含量的測定及木質素染色 木質素含量測定采用紫外分光光度法[18]、木質素染色采用間苯三酚法。
1.3.6 木質素合成途徑相關酶活性的測定 苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、肉桂醇脫氫酶(cinnamyl alcohol dehydrogenase,CAD)活性采用李孟園[19]的方法進行測定,漆酶(laccase,LAC)活性采用劉清泉[20]的方法進行測定。
1.3.7 總皂苷含量的測定 參照2020年版《中華人民共和國藥典》[1]測定總皂苷含量。
1.4 數據處理
采用Excel 2021 進行初步統計,再利用SPSS 23 軟件對數據進行單因素方差分析(ANOVA),采用Duncan’s 法進行多重比較,結果用平均值±標準差表示,P<0.05 表示差異顯著。采用Graphpad Pism9.5 軟件繪圖。
2 結果與分析
2.1 銅脅迫對人參生長的影響
由圖1 可知,隨著Cu2+脅迫程度的增強,地上地下部分干重和鮮重均出現下降趨勢,以500 μmol·L-1CuSO4處理(A4)降幅最大。與對照組(CK)相比,50 μmol·L-1CuSO4處理(A1)各指標及150 μmol·L-1CuSO4處理(A2)地下部分干重均無顯著差異;其余組地上部分鮮重分別顯著下降了11.60%、50.78%和63.00%,地下部分鮮重分別顯著下降7.13%、27.52%和45.43%,地上部分干重分別顯著下降12.03%、40.52%和53.53%;300(A3)和500 μmol·L-1CuSO4處理地下干重分別顯著下降了43.41%和47.67%。
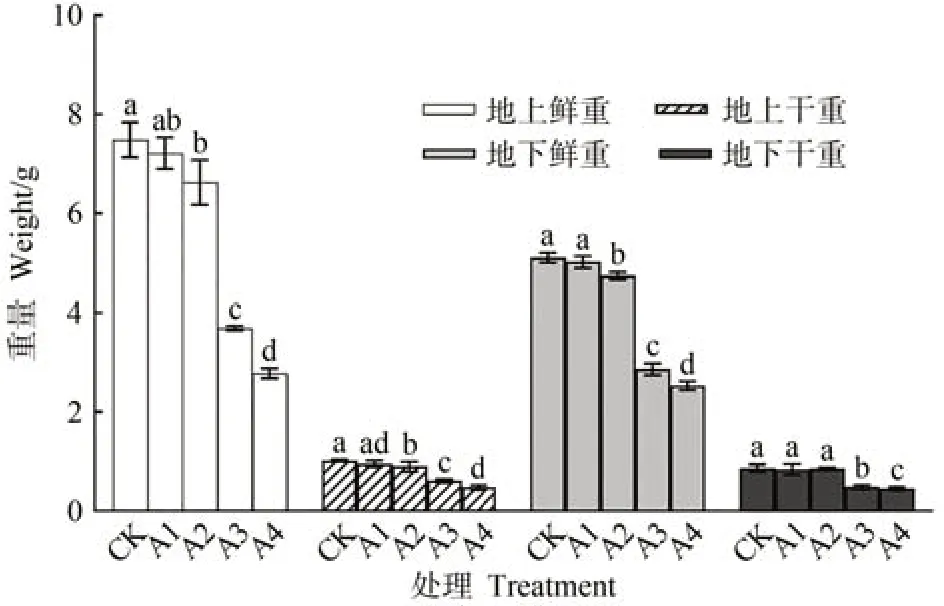
圖1 不同濃度銅脅迫對人參干重鮮重的影響Fig.1 Effect of different concentrations of copper stress on the dry and fresh weight of P.ginseng
Cu2+脅迫對人參生長的影響見圖2,對照組人參生長良好,葉片開展充分,葉面平滑,CuSO4處理濃度大于300 μmol·L-1時,人參生長受到明顯抑制。與CK 相比,300 和500 μmol·L-1CuSO4處理莖長縮短,葉片開始出現皺縮現象(圖2-A)。通過根部石蠟切片觀察發現,對照組人參根表皮細胞形態結構正常,表皮細胞和韌皮部細胞結構正常,界限分明,表皮細胞排列緊密(圖2-B)。但500 μmol·L-1CuSO4處理組人參根部細胞排列松散,部分薄壁細胞出現明顯被破壞情況(圖2-C)。
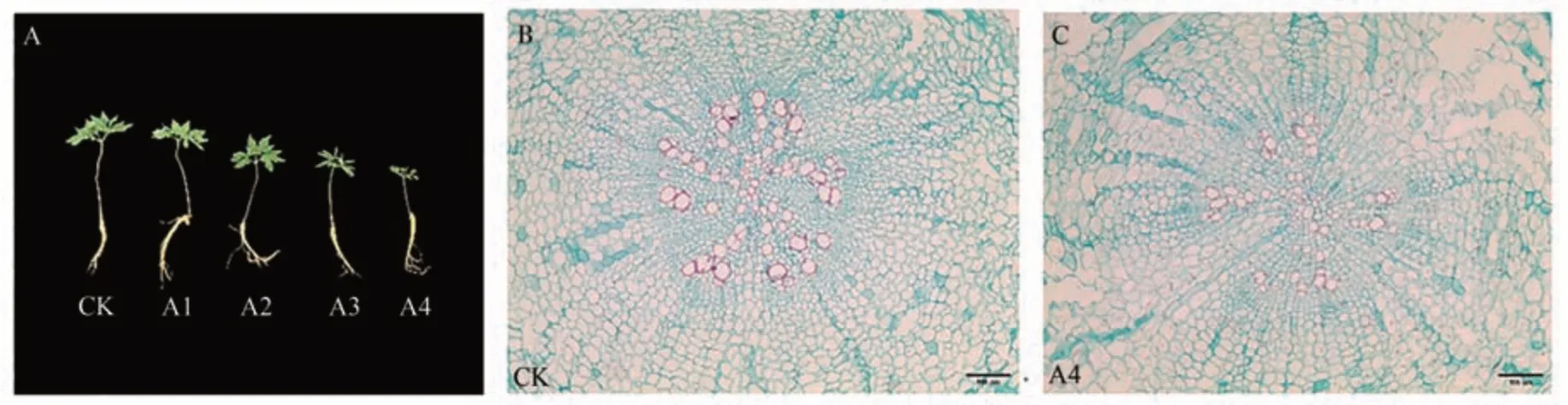
圖2 不同濃度銅脅迫對人參生長的影響Fig.2 Effects of copper stress at different concentrations on the growth of P.ginseng
2.2 人參不同部位銅含量及亞細胞定位
不同濃度銅處理21 d后人參各部位銅含量及細胞壁所富集銅含量見表1。結果表明,銅脅迫整體顯著增加了人參各部位銅含量,且人參根莖葉銅含量均與處理濃度呈正相關并存在濃度依賴性。隨著Cu2+濃度增加,人參根莖葉中銅含量均出現上升趨勢。其中人參根莖葉中銅含量在500 μmol·L-1CuSO4處理時較對照增幅高達784.66%、739.40%和1 103.06%。根部各處理細胞壁中銅含量占總銅含量的48.85%、55.27%、57.73%、38.44%和32.77%。莖部各處理細胞壁中銅含量占總銅含量的37.65%、30.18%、43.33%、25.15%和28.82%。葉部各處理細胞壁中銅含量占總銅含量的27.06%、38.30%、37.24%、21.47%和32.61%。
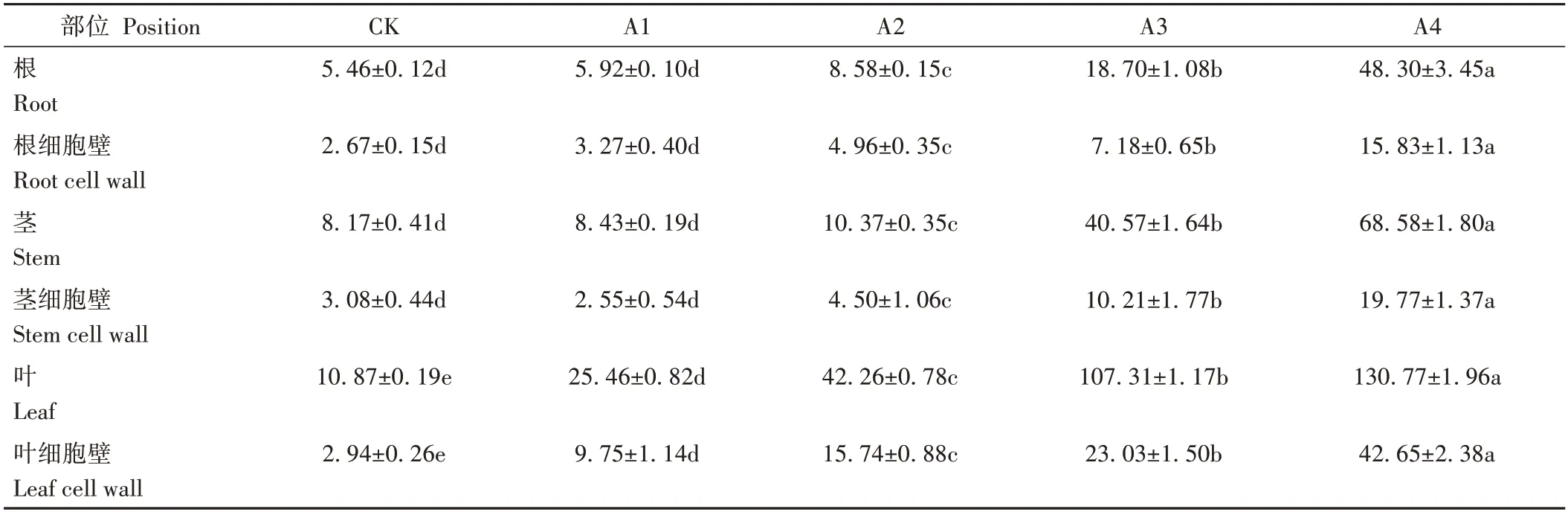
表1 人參不同部位銅含量及亞細胞定位Table 1 Determination of copper content and subcellular localization in different parts of P.ginseng
2.3 不同濃度銅處理對人參各部位丙二醛及過氧化氫含量的影響
由圖3可知,人參各部位MDA和過氧化氫含量均隨銅處理濃度的增加而上升,以500 μmol·L-1CuSO4處理最高。500 μmol·L-1CuSO4處理人參根和葉MDA含量分別是CK 的2.65 和1.96 倍;300 μmol·L-1CuSO4處理莖MDA含量是CK的2.18倍;根莖葉過氧化氫含量在500μmol·L-1CuSO4處理分別是CK的3.00、1.08和1.88倍。
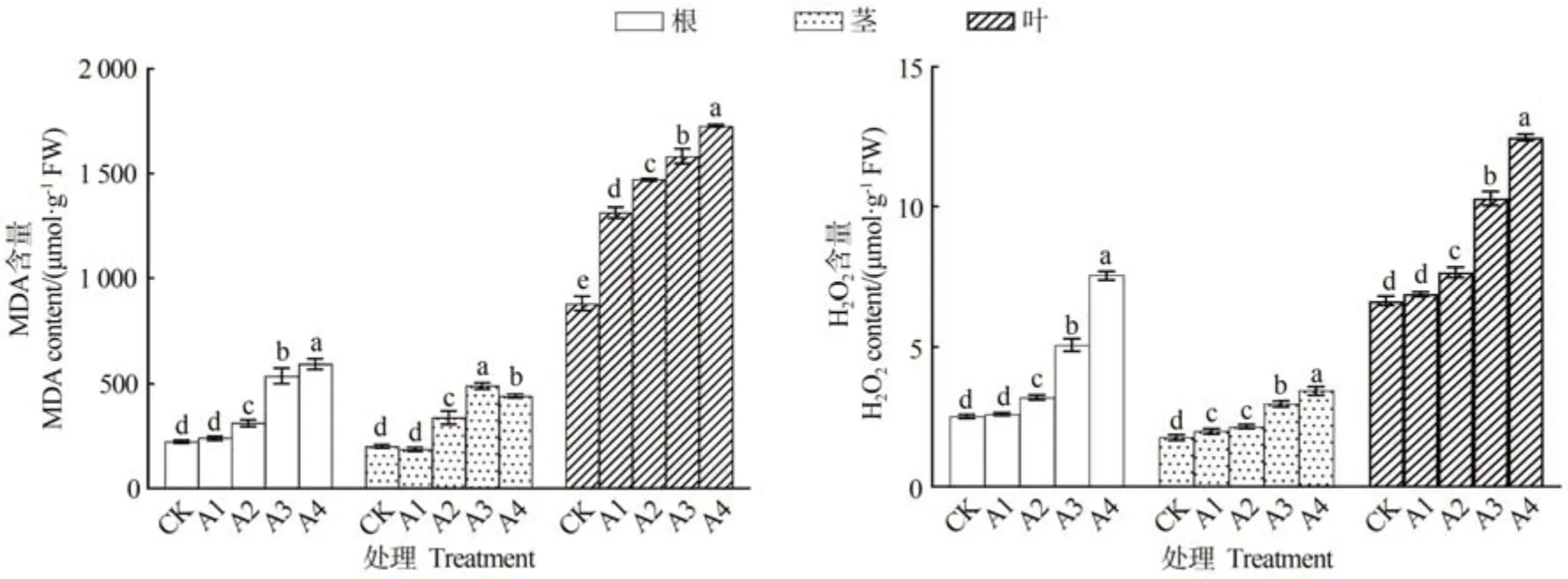
圖3 不同濃度銅處理對人參各部位丙二醛及過氧化氫含量影響Fig.3 Effects of copper treatment with different concentrations on malondialdehyde and hydrogen peroxide contents in different parts of P.ginseng
2.4 不同濃度銅處理對人參各部位抗氧化酶活性的影響
由圖4-A 可知,隨著銅脅迫程度的增加,SOD 活性呈現先升高后降低的趨勢,根和葉SOD 活性在150 μmol·L-1CuSO4處理最強,莖則在300 μmol·L-1CuSO4處理時活性最強。與對照組相比,150 μmol·L-1CuSO4處理根和葉SOD 活性較對照分別顯著上升了61.72% 和32.67%。300 μmol·L-1CuSO4處理莖部SOD 活性較對照顯著上升了16.42%,500 μmol·L-1CuSO4處理SOD活性則顯著下降了13.83%。

圖4 不同濃度銅處理對人參抗氧化酶活性的影響Fig.4 Effect of copper treatment with different concentrations on P.ginseng antioxidant enzymes
由圖4-B 可知,人參各部位POD 活性隨著銅脅迫程度的增大整體呈現先上升后下降趨勢,根和葉在300 μmol·L-1CuSO4處理時活性最強,莖在50 μmol·L-1CuSO4處理時活性最強。300 μmol·L-1CuSO4處理根和葉POD 活性分別較對照顯著上升19.39%和36.64%。50 μmol·L-1CuSO4處理莖POD 活性較對照顯著上升150.78%。
由圖4-C可知,各部位CAT活性均在300 μmol·L-1CuSO4處理時達到最高。人參根中CAT活性隨著銅脅迫程度的增大呈現先下降后上升再下降趨勢。500 μmol·L-1CuSO4處理根中CAT 活性較對照顯著下降24.39%,300 μmol·L-1CuSO4處理CAT 活性較對照顯著上升13.78%。人參莖中CAT 活性隨著銅脅迫程度的增大呈現先上升后下降趨勢,其中300 μmol·L-1CuSO4處理CAT 活性較對照顯著升高34.48%,500 μmol·L-1CuSO4處理CAT 活性較對照顯著下降15.88%。人參葉中CAT 活性隨著銅脅迫程度的增大呈現先降低后上升再下降的趨勢,其中500 μmol·L-1CuSO4處理CAT活性較對照顯著降低16.07%,300 mol·L-1CuSO4處理CAT活性較對照顯著上升17.78%。
2.5 不同濃度銅脅迫對人參各部位木質素含量的影響
由圖5-A、B 可知,人參根切片染色結果表明,500 μmol·L-1CuSO4處理人參根中木質素的積累量較CK 組增加。銅脅迫下中央大維管束(包括厚壁組織、木質部和維管柱)木質化組織的面積占比較對照組有所增加。說明銅脅迫處理可以誘導人參根部木質素含量的積累,同時木質化的區域也有明顯增加。
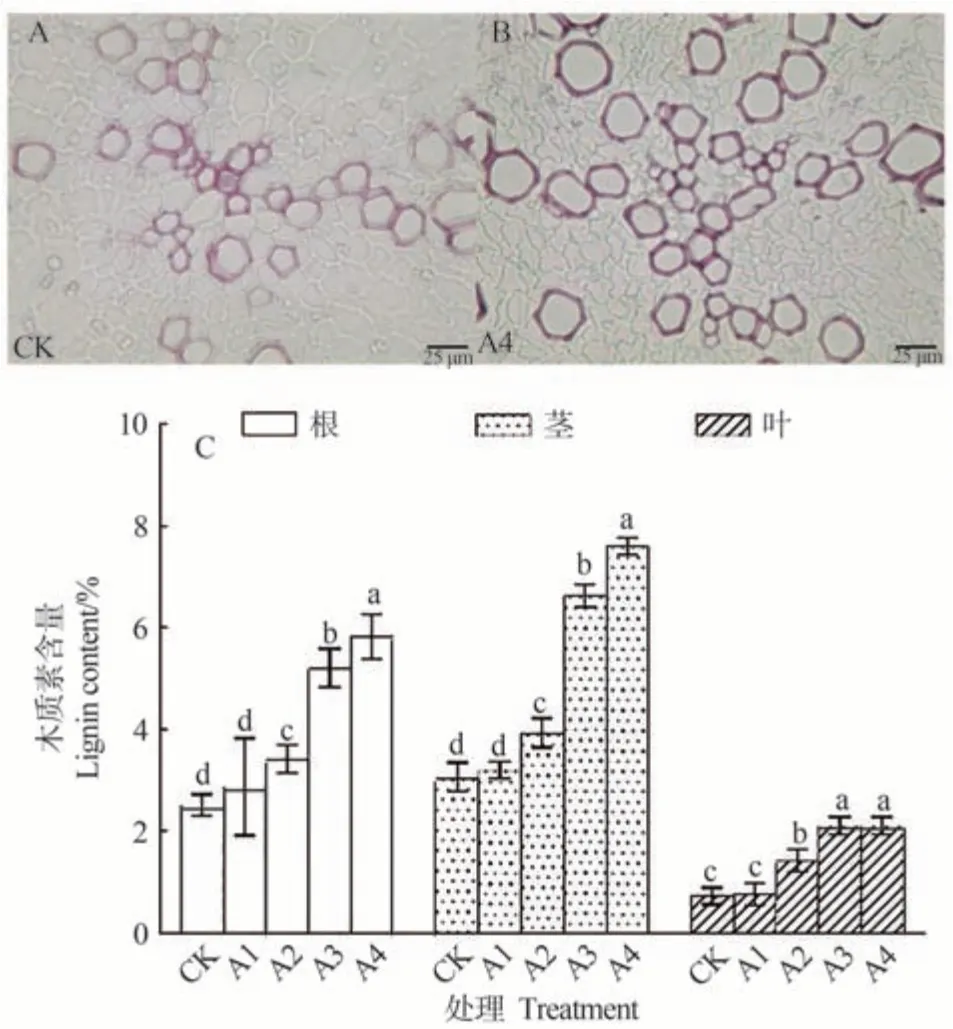
圖5 不同濃度銅處理對人參木質素含量的影響Fig.5 Effect of copper treatment with different concentrations on the lignin content of P.ginseng
由圖5-C 可知,人參各組織中木質素含量整體較對照顯著增加,均在500 μmol·L-1CuSO4處理時含量最高。500 μmol·L-1CuSO4處理根莖葉中木質素含量分別較對照顯著升高131.88%、131.88%和190.00%。同一濃度下,人參莖和根中的木質素含量高于葉,且在脅迫處理下表現出了更加大幅的沉積。
2.6 不同濃度銅處理對木質素相關合成酶活性的影響
由圖6-A 可知,與CK 相比,銅脅迫顯著提高了人參各部位PAL活性,各部位均以500 μmol·L-1CuSO4處理活性最強。500 μmol·L-1CuSO4處理根莖葉中PAL活性分別是CK 的3.07、4.55 和1.79 倍。葉片中PAL活性低于根和莖,可能與木質化程度有關。
由圖6-B 可知,銅脅迫可以提高人參各部位CAD活性,均以500 μmol·L-1CuSO4處理時的活性最強。500 μmol·L-1CuSO4處理根莖葉CAD 活性分別是CK的2.07、7.93和2.42倍。
由圖6-C 可知,銅脅迫可以提高人參各部位LAC活性,均以500 μmol·L-1CuSO4處理時的LAC 活性最強。50 μmol·L-1CuSO4處理根和莖LAC 活性與CK 無顯著差異。人參各部位LAC活性在50 μmol·L-1CuSO4處理時分別是CK 的1.32、1.16 和1.17 倍。此外,莖的LAC活性始終高于根部和葉片。
2.7 不同濃度銅處理對人參總皂苷含量的影響
由圖7 可知,隨著銅處理濃度的增加,人參根和葉總皂苷含量呈現先上升后下降的趨勢,低濃度時促進總皂苷合成,高濃度則抑制總皂苷合成。與對照相比,50、150 和300 μmol·L-1CuSO4處理葉總皂苷含量分別顯著上升了39.34%、57.28%和42.79%,500 μmol·L-1CuSO4處理顯著下降了23.95%;50 和150 μmol·L-1CuSO4處理根總皂苷含量分別顯著上升了28.27%和61.69%,300 和500 μmol·L-1CuSO4處理顯著下降了21.94%和43.70%。
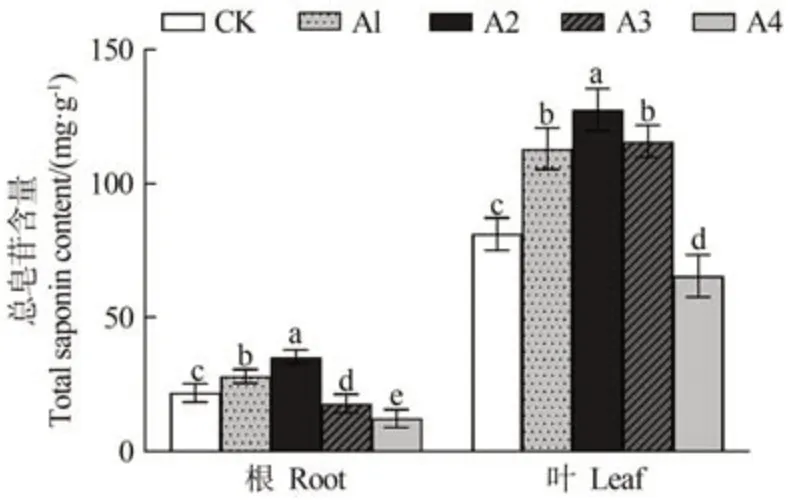
圖7 不同濃度銅處理對人參總皂苷含量的影響Fig.7 Effect of copper treatment with different concentrations on the total saponin P.ginseng
3 討論
3.1 不同水平銅脅迫對人參生長的影響
銅雖然是植物必需微量營養元素,對植物的生長發育至關重要,但在高濃度下對植物有毒害作用,銅離子的毒性主要是由Cu(Ⅰ)和Cu(Ⅱ)較易相互轉變引起的[21]。有研究表明,高濃度銅脅迫顯著抑制了小麥種子的萌發及幼苗的生物量、根長和葉綠素含量[22]。本研究結果表明,銅處理濃度增加使人參根莖葉中銅含量升高,銅脅迫對人參的毒害作用體現在高濃度會抑制人參的生長發育,表現為株高、地上部和地下部干重鮮重降低,且抑制程度隨銅濃度的增加而不斷加深。同時在光學顯微鏡下觀察人參根部切片發現,高濃度銅脅迫會造成人參根部薄壁細胞松散、數量減少甚至破碎現象,充分證明高濃度銅脅迫會造成人參幼苗生長發育緩慢甚至死亡。
3.2 不同水平銅脅迫對人參各部位銅含量、銅亞細胞分布的影響
細胞壁結合Cu2+,抑制Cu2+在細胞質中的積累,是銅脅迫下植物的重要防御機制。亞細胞定位表明,大部分Cu2+位于外質體,特別是細胞壁,只有少量的Cu2+存在于原生質體中[23]。也有研究證明許多類型的植物通過將重金屬結合到細胞壁上來減輕重金屬脅迫[11]。本研究發現,隨著銅離子濃度增加,人參各部位銅含量也隨之增加,人參根部細胞壁銅含量最多可占根部總銅含量的55.27%,這可能是由于細胞壁中木質素等成分可以提供羧基等官能團,這些官能團可以吸附固定Cu2+,致使大部分Cu2+停留在細胞壁,從而緩解銅對細胞造成的傷害。
3.3 不同水平銅脅迫對人參抗氧化酶活性的影響
銅脅迫可誘導細胞產生大量活性氧,導致膜脂質過氧化,質膜選擇透性降低,細胞內含物質外滲,丙二醛(MDA)含量升高,同時損傷光合細胞器,進而影響植物物質交換、光合作用等各種生理代謝過程的正常運行[23]。本研究顯示,隨著銅處理濃度的升高,人參根莖葉H2O2和MDA 含量整體顯著升高,SOD 和POD活性則整體呈現先上升后降低的趨勢,值得注意的是,莖和根中POD 活性高于葉,這可能是由于作為催化木質素生物合成最后一步反應的酶,過氧化物酶在此過程中起到的作用多樣化。CAT 雖然能特異清除H2O2,但其與H2O2的親和性并不高,因此CAT 活性在50μmol·L-1CuSO4處理反而下降,這與黃長干[24]的研究結果一致。
3.4 不同水平銅脅迫對人參木質素含量及其合成酶活性的影響
木質素作為細胞壁的組成部分,是植物組織和器官中最豐富的化合物[25]。木質素沉積為細胞壁提供了額外的強度和不透水性,可以保護植物組織免受損傷[26]。細胞壁木質化與植物對非生物脅迫的抵抗力有關[27]。本研究發現,銅脅迫在超過50 μmol·L-1CuSO4處理后顯著促進了人參根莖葉中木質素的積累,且呈濃度依賴性。此外,Kovac 等[28]研究證實細胞壁中的木質素沉積增強了植物對銅毒性的耐受性,同時發現銅誘導的蘿卜根尖中的木質素沉積可以防止木質部導管吸收外來有害物質。由此推測,在本試驗中,銅脅迫促進木質素合成有利于銅固定在細胞壁上,從而減輕銅對人參細胞的毒性。合成木質素的苯丙素代謝途徑對促進植物生長并增強其脅迫耐受性具有重要意義[29]。本研究發現,不同濃度銅脅迫促進了木質素合成,同時木質素合成途徑上的相關酶活性上升,這是由于銅脅迫條件下刺激相關基因如TaPAL、Ta4CL、TaCAD和TaLAC的表達[30]。有研究表明上述幾種酶活性的增加介導了銅脅迫小麥幼苗葉片和根細胞壁的木質化增強[14],與本試驗結果一致。
3.5 不同水平銅脅迫對人參總皂苷含量的影響
三萜人參皂苷是人參的重要次生代謝產物,當生長環境的光照、溫度、水分和營養等條件發生變化或受到外來侵害時,人參和西洋參等植物會通過調節體內的皂苷含量來應答這些環境脅迫[31]。有研究表明,銅和鎘復合脅迫降低了三七中總酚、黃酮和皂苷含量[32]。本研究中,在低濃銅脅迫時,根和葉總皂苷含量隨濃度增加呈上升趨勢,在150 μmol·L-1CuSO4處理達到最大值,隨后開始下降。最佳防御假說從植物生理學的角度很好地解釋了這一現象,即植物在脅迫環境下生長緩慢,植物受損的補償能力較差,而產生次生代謝產物的成本相對較低,次生代謝產物的防御收益增加,因此,植物在環境脅迫下將產生較多的次生代謝產物[33]。但因濃度過高時,細胞受損比較嚴重,總皂苷含量較空白組出現顯著下降。
4 結論
本研究結果表明,銅脅迫抑制了人參幼苗的生長,降低了人參干重鮮重,破壞了細胞正常結構,與對照相比,低濃度時總皂苷含量顯著上升,高濃度總皂苷含量顯著下降。另一方面,人參各部位銅含量隨著銅處理濃度的增加而顯著上升,且銅離子主要分布在細胞壁中。人參通過激活抗氧化酶活性、提高非抗氧化酶活性來清除ROS 并降低膜脂過氧化水平;由于銅主要分布在細胞壁中,導致人參各部位木質素含量上升,從而增加人參抗性。綜上,銅處理會增強人參抗氧化系統和增加木質素含量,同時生產上應限制高銅農藥和肥料的過度使用。

