毛竹對鈾脅迫的生理響應與富集特性研究
茍志坤 陳 鵬 徐 剛 樊 偉 龔小強 曹 穎 胡尚連
(西南科技大學生命科學與工程學院,植物細胞工程實驗室/四川省生物質資源利用與改性工程技術研究中心,四川 綿陽 621010)
在鈾尾礦治理過程中會產生大量難以處理的鈾廢水[1]。鈾廢水排放或流失到環境中會通過食物鏈進入人體,從而對人體健康產生嚴重危害[2-3]。處理鈾廢水的方法有化學法、物理法和生物法,其中生物法中的植物修復技術因成本低、操作方便、不易造成二次污染等優點而成為近年來的研究熱點[4-5]。目前,利用植物修復技術能夠將水體中的重金屬元素富集到植物地上部分,再通過收割地上部分進行處理,在一定程度上能夠達到減少或去除廢水中重金屬污染的效果[6-7]。Liu等[8]通過水培試驗研究了毛竹幼苗對鉛的積累和耐性,結果表明當鉛濃度達到400 mg·L-1時,毛竹幼苗生長受到明顯抑制,根、莖、葉中吸收鉛濃度分別為4 282.8、482.2和148.8 mg·kg-1。李松[9]研究水培條件下重金屬脅迫對毛竹幼苗生長的影響,結果表明鉛和鋅濃度分別為10~200和10~100 mg·L-1時,毛竹表現出較強的抗逆性,其植株生長茂盛;在受到重金屬鉛、鋅、銅污染水體的影響下,毛竹生物量隨著重金屬濃度的增加呈先上升后下降趨勢,在鎘污染下,毛竹生物量則呈下降趨勢。但目前有關毛竹應用于含鈾廢水治理中的相關報道較少。因此,本研究以毛竹為研究對象,采用水培試驗研究不同濃度鈾脅迫對毛竹生理生化指標及鈾富集特性的影響,旨在為植物應用于鈾廢水污染水體修復提供一定的實踐參考和理論依據。
1 材料與方法
1.1 試驗地概況與試驗材料
毛竹幼苗購自四川省眉山市,為一年生實生苗,株高12 cm,3~4 片真葉。試驗地點位于西南科技大學校內試驗基地智能溫室,時間為2022年夏季,溫室平均溫度24.7~27.3 ℃,相對濕度50%~60%。
1.2 水培試驗設計
選擇生長良好、長勢一致的毛竹幼苗,用離子水清洗后,將其移入裝有1/4 Hoagland’s 改良營養液[10]的黑色塑料小桶中(桶的規格為2 L),培養3 d 后對毛竹幼苗進行不同濃度鈾處理。將不同重量且穩定的乙酸雙氧鈾[UO2(CH3COO)2·2H2O]加入1/4 Hoagland’s 改良營養液(mg·L-1)[10],配置不同濃度鈾處理溶液,乙酸雙氧鈾濃度分別為0、10、25、50、100、200、400 mg·L-1,分別記為CK、U10、U25、U50、U100、U200、U400,每個處理3 次生物學重復,每桶6 株,每隔3 d 更換一次溶液,處理30 d 后收獲植株,并根據Wang 等[11]的方法進行取樣,其中每個處理取4 株,然后把根、莖、葉分開,根據不同測定指標進行樣品制備。
1.3 測定項目與方法
1.3.1 光合參數測定 采用Li-6400 便攜式光合測定儀(美國Li-COR 公司)直接測定毛竹葉片的光合參數。選取從上到下第3 片完全展開的成熟葉片,于上午9∶00—11∶00 光照強度800 μmol·m-2·s-1、葉室溫度24 ℃的條件下,測定毛竹葉片氣體交換參數,包括凈光合速率(net photosynthetic rate,Pn)、蒸騰速率(transpiration rate,Tr)、氣孔導度(stomatic conductance,Gs)和胞間CO2濃度(intercellular CO2concentration,Ci),每個樣本5次生物學重復。
1.3.2 葉綠素含量測定 參照《現代植物生理學》[12]的方法,稱取毛竹葉片0.1 g 用于提取葉綠素含量,使用U-3900 紫外分光光度計(日本日立公司)測定663和645 nm 處的吸光值A663和A645,3 次重復。按下列公式計算葉綠素a(chlorophyll a,Chl a)和葉綠素b(chlorophyll b,Chl b)含量[13]:
Chl a=12.21A663-2.81A645;
Chl b=20.13A645-5.03A663。
1.3.3 生長指標的測定 取不同濃度鈾處理的毛竹幼苗,用10 mmol·L-1乙二胺四乙酸二鈉(ethylene diamine tetra acetate,EDTA-2Na)溶液浸泡15 min,洗去附著在植株根系表面的重金屬,再用蒸餾水沖洗,吸干表面水分。然后分別對每個處理的單株根、莖、葉部位稱量鮮重,裝入信封袋中,于105 ℃烘箱中殺青30 min,75 ℃干燥至恒重,再稱取根、莖、葉的干重[14]。
1.3.4 抗氧化酶活性的測定 稱取0.1 g葉片樣本加入1 mL酶活提取液,冰浴中研磨成勻漿,在8 000 r·min-1下離心10 min,取0.2 mL 上清液用于酶活測定。選用北京索萊寶科技有限公司的抗氧化酶系列試劑盒分別測定超氧化物歧化酶(superoxide dismutase,SOD)、過氧化物酶(peroxidase,POD)、過氧化氫酶(catalase,CAT)、抗壞血酸過氧化物酶(ascorbate peroxidase,APX)活性和丙二醛(malondialdehyde,MDA)含量,每個處理5個生物學重復。
1.3.5 鈾含量分析 使用FW135 中草藥粉碎機(北京永光明醫療儀器有限公司)將烘干后的樣品材料根莖葉分別粉碎,稱取0.1 g,加入3 mL硝酸和1 mL鹽酸的混合液,在Synthos 3000 微波消解儀(奧地利安東帕公司)中消解樣本,每個部位重復消解3 次,稀硝酸定容至50 mL后,經0.45 μm濾膜過濾到10 mL的塑料離心管中;使用7700x ICP-MS 電感耦合等離子體質譜儀(美國安捷倫科技有限公司)測定鈾含量,并按以下公式計算鈾的生物轉移系數(transferfactor,TF)和富集系數(bioconcentrationfactor,BCF):
BCF=植物中重金屬濃度÷水體重金屬濃度;
TF=植物地上部重金屬濃度÷植物地下部重金屬濃度。
1.4 數據處理
使用SPSS 26 軟件對所有數據進行單因素方差分析,從而確定各處理組之間的差異,應用Origin 2022軟件繪圖。
2 結果與分析
2.1 鈾脅迫下毛竹生長狀況
生物量是揭示植物對逆境脅迫響應的常用指標。由圖1可知,隨著鈾濃度的增加,毛竹幼苗鮮重和干重呈先升高后降低的趨勢。其中50 mg·L-1鈾脅迫對毛竹生物量促進最明顯,該濃度下,毛竹地上部鮮重和干重分別比對照組提高了6.74%和12.08%,地下部鮮重和干重分別比對照組提高了7.82%和7.01%。200~400 mg·L-1鈾脅迫對毛竹生物量具有抑制作用,在400 mg·L-1鈾濃度下,毛竹地上和地下部鮮重及干重均較對照顯著降低,該濃度鈾脅迫對毛竹生長抑制程度最顯著。
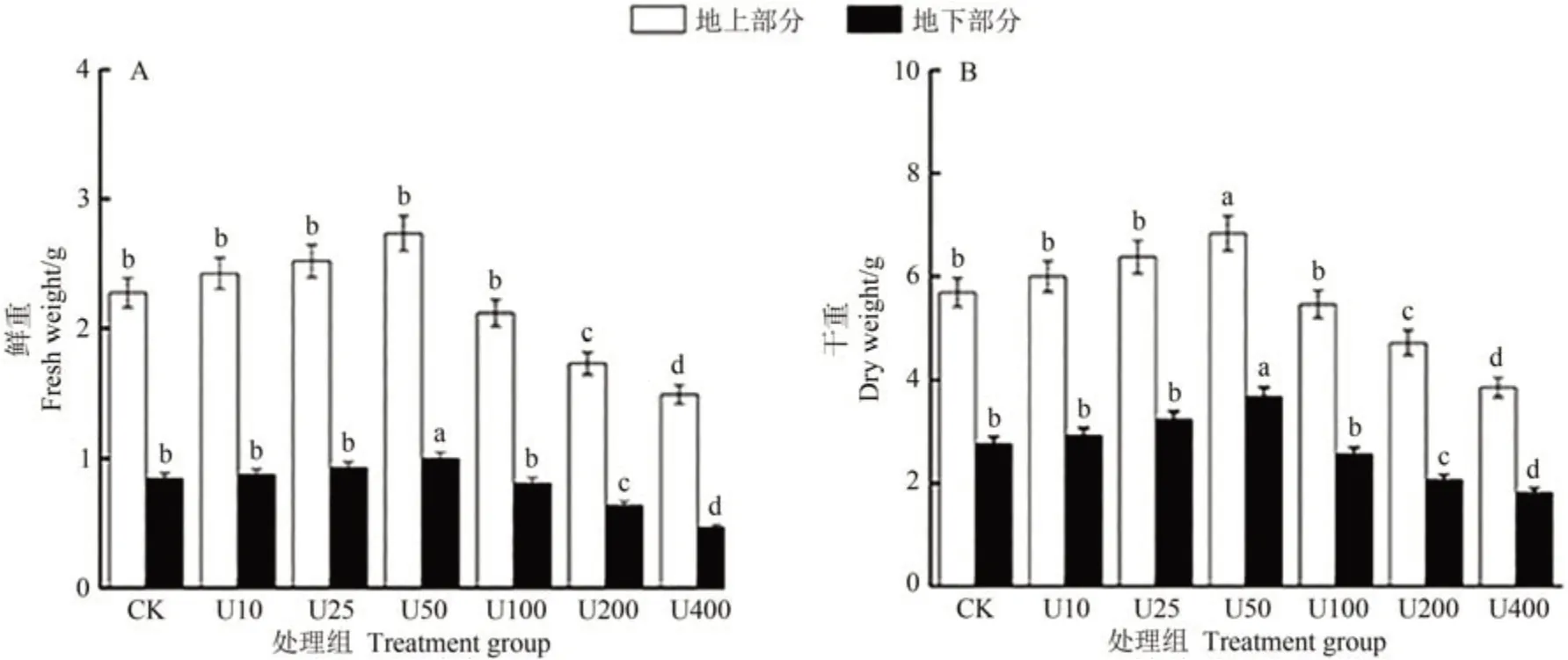
圖1 不同濃度鈾脅迫下毛竹鮮重(A)和干重(B)的變化Fig.1 Changes in fresh weight(A)and dry weight(B)of moso bamboo biomass under different concentrations of uranium stress
2.2 鈾脅迫下毛竹氣體交換參數
由圖2可知,毛竹葉片的凈光合速率(Pn)、蒸騰速率(Tr)、氣孔導度(Gs)均隨著鈾濃度的增加呈現出先升高后降低的趨勢。Pn、Tr 和Gs 在50 mg·L-1鈾濃度處理下達到最大值,并高于對照組,其中Tr 與其他處理組之間差異顯著。在400 mg·L-1鈾濃度時,Tr、Pn、Gs 分別較對照降低了18.81%、39.71%和36.25%,以Pn 下降幅度較大。胞間CO2濃度(Ci)隨著鈾濃度的增加而降低,處理間均無顯著差異。
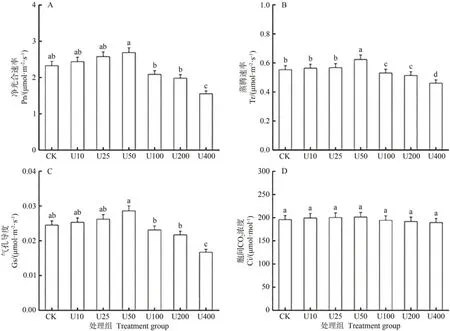
圖2 不同鈾濃度下毛竹葉片凈光合速率(A)、蒸騰速率(B)、氣孔導度(C)和胞間CO2濃度(D)參數的變化Fig.2 Changes in parameters of net photosynthetic rate(A),transpiration rate(B),stomatal conductance(C)and intercellular CO2 concentration(D)of moso bamboo leaves at different uranium concentrations
2.3 鈾脅迫下毛竹葉綠素含量
葉綠素含量通常可以反映植物的生長情況,同時也能夠反映植物光合作用的強弱。由圖3 可知,隨著鈾濃度的增加,毛竹幼苗葉片葉綠素a、b 及葉綠素總含量整體呈降低的趨勢。當鈾濃度為25 mg·L-1時,葉綠素a、b 及葉綠素總含量較對照組無顯著差異;當鈾濃度為100~200 mg·L-1時則顯著低于對照組;當鈾濃度為400 mg·L-1時,葉綠素a、葉綠素b、葉綠素總含量和Chl a/Chl b分別較對照組顯著下降42.02%、32.69%、35.21%和25.00%,葉綠素a 含量下降幅度大于葉綠素b含量下降幅度,說明鈾對毛竹葉綠素a的抑制作用明顯大于葉綠素b。
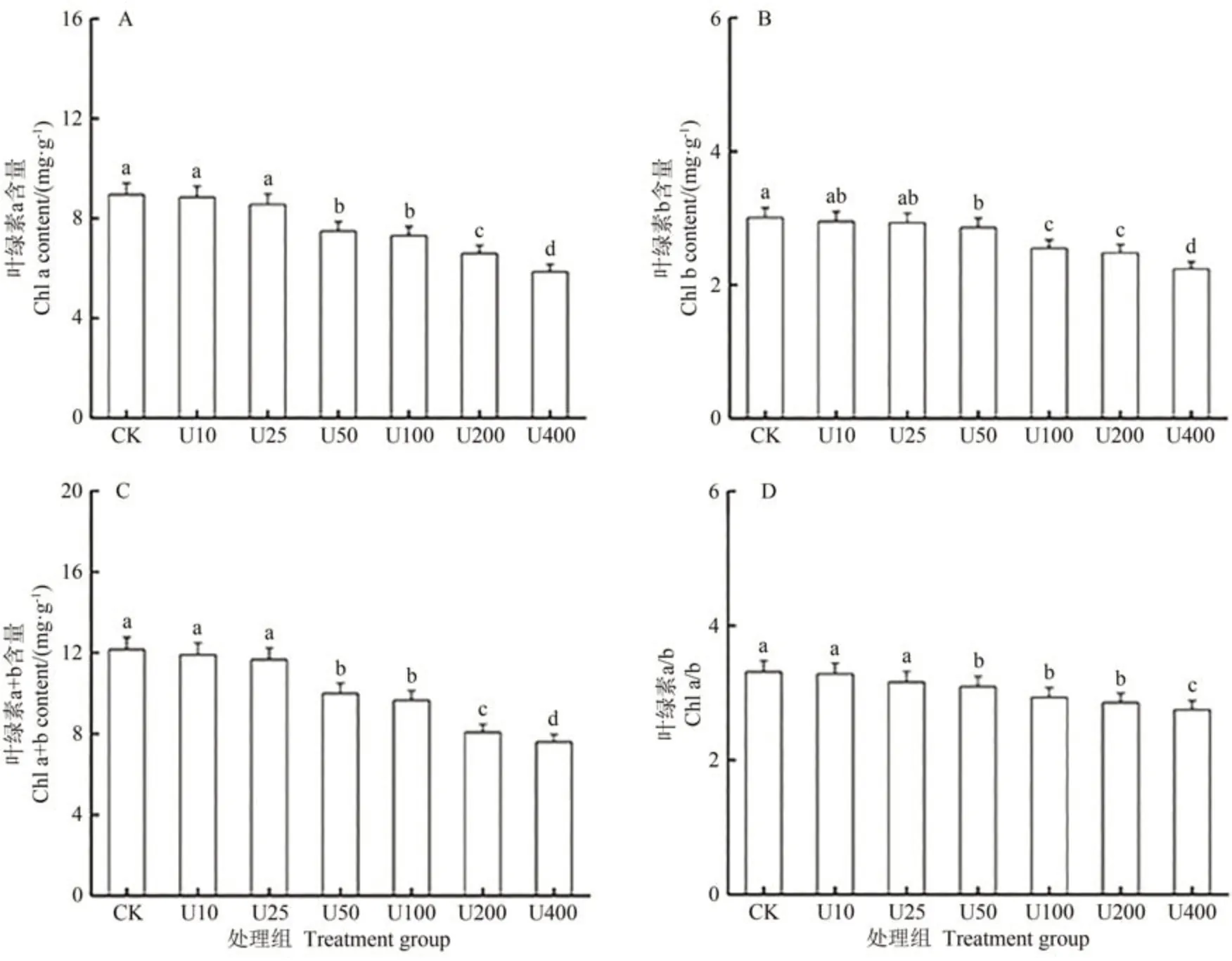
圖3 不同鈾濃度脅迫下對毛竹葉綠素a含量(A)、葉綠素b含量(B)、葉綠素(a+b)含量(C)和葉綠素a/b(D)變化的影響Fig.3 Effects of different uranium concentration stress on the changes of chlorophyll a content(A),chlorophyll b content(B),chlorophyll(a+b)content(C)and chlorophyll a/b(D)in moso bamboo
2.4 鈾脅迫對毛竹抗氧化酶活性和丙二醛含量的影響
當植物遭受逆境脅迫時,其抗氧化物酶起到了關鍵性的調控作用。在不同濃度鈾脅迫下,毛竹的抗氧化酶活性和MDA含量測定結果見圖4。各濃度鈾處理下,SOD、POD、CAT 和APX 活性均呈現出低濃度促進、高濃度抑制的變化趨勢,且在鈾濃度為50 mg·L-1時達到最大值,分別較對照組增加了33.02%、38.75%、27.36%和22.25%;當濃度大于100 mg·L-1后,隨著濃度的增加,毛竹葉片四種抗氧化酶活性逐漸降低,在400 mg·L-1濃度下分別較對照下降了33.02%、38.75%、27.36%和22.25%。MDA 含量隨著鈾濃度的增加而逐漸增加,且在鈾濃度為100~400 mg·L-1處理下差異顯著(P<0.05),以400 mg·L-1鈾濃度脅迫下的MDA 含量最高,較對照組增加40.78%。
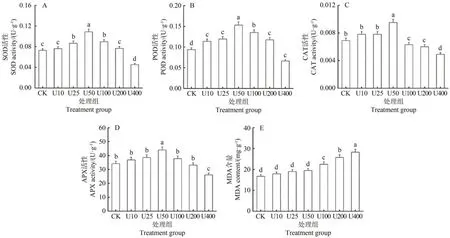
圖4 不同鈾濃度脅迫下毛竹的SOD(A)、POD(B)、CAT(C)、APX活性(D)和MDA含量(E)變化Fig.4 Changes in SOD(A),POD(B),CAT(C),APX activity(D)and MDA content(E)of moso bamboo under different uranium concentration stresses
2.5 鈾在毛竹幼苗體內的累積、分布和遷移特性
評價植物富集重金屬能力的重要指標是植物體各器官所吸收重金屬的含量。由表1 可知,毛竹幼苗對鈾具有一定的富集能力,隨著培養基中鈾濃度的增加,毛竹植株各器官的鈾富集濃度均表現為根>莖>葉。當鈾濃度為400 mg·L-1時,毛竹根、莖、葉鈾富集濃度別為9 089、519和276 mg·kg-1。BCF 和TF 分別用于評價植物對鈾的積累和轉移作用,在不同鈾濃度處理下,毛竹富集系數均表現為根/莖>莖/莖>葉/莖,轉移系數表現為葉/根>莖/根。當鈾濃度為10 mg·L-1時,毛竹總富集系數達到最大值,為10.838;總轉移系數在鈾濃度為50 mg·L-1時達到最大值,為0.238。說明在上述兩個濃度下,毛竹吸收和轉移鈾的能力較強。
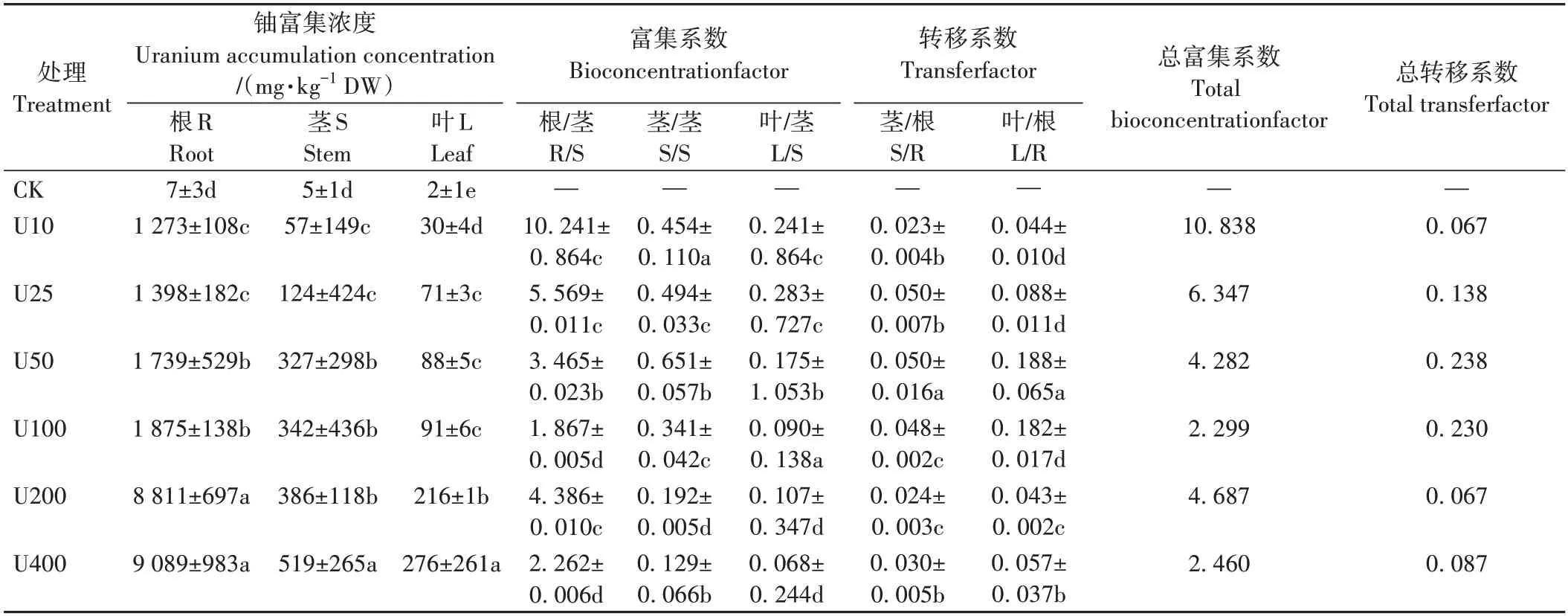
表1 不同濃度鈾處理毛竹30 d時鈾的富集與分布情況Table 1 Uranium enrichment and distribution in moso bamboo treated for 30 days with various enriched uranium sources
2.6 鈾脅迫下毛竹生理指標和富集系數、轉移系數的相關性
不同濃度鈾脅迫下毛竹生理指標和富集系數、轉移系數的相關性分析結果表明(表2),Pn 和Tr、Ci呈顯著或極顯著正相關,Tr與Ci呈極顯著正相關,Ci與MDA、Chl a、Chl b含量和TF呈顯著正相關,SOD活性和POD、CAT、APX 活性呈顯著或極顯著正相關,POD 活性與APX活性呈極顯著正相關,CAT活性和APX活性、MDA含量呈顯著或極顯著正相關,APX 活性和Chl a含量呈顯著正相關,MDA 與Chl a 含量呈極顯著正相關,BCF和TF呈極顯著正相關。
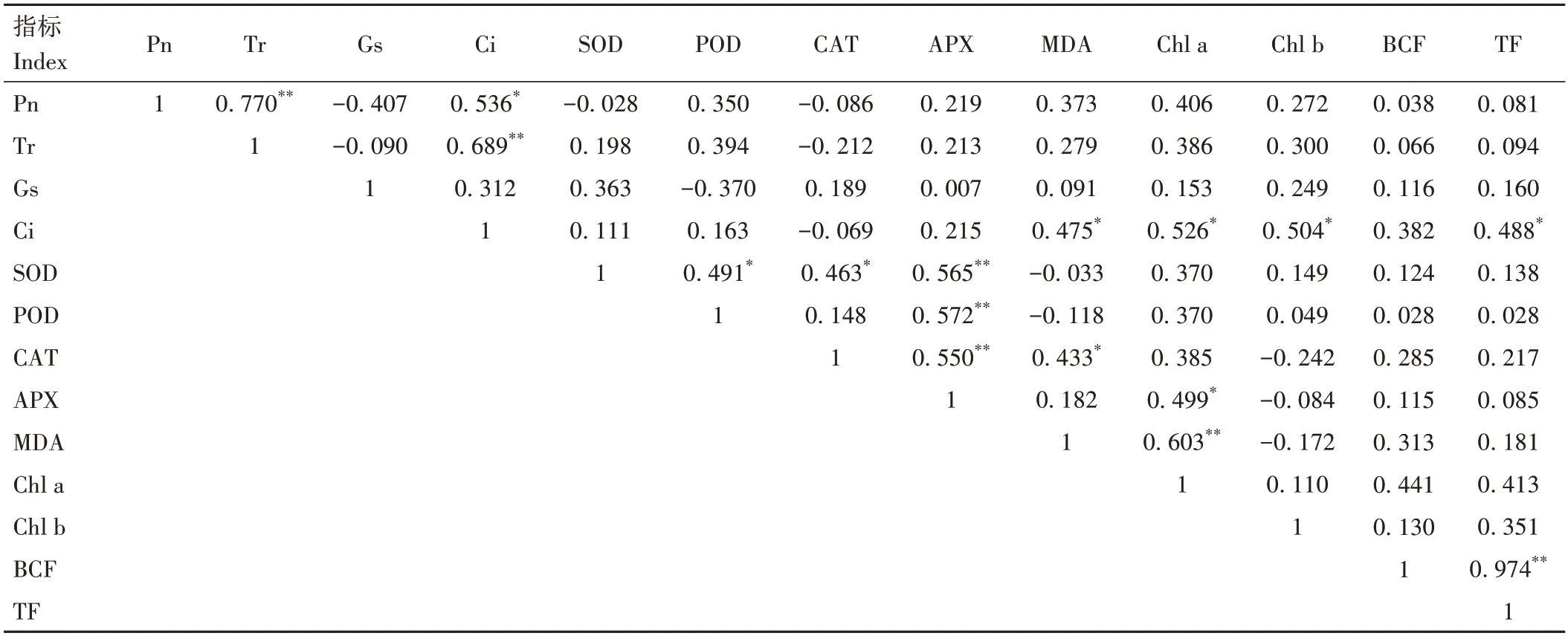
表2 鈾脅迫下毛竹生理指標和富集系數、轉移系數的相關性分析Table 2 Analysis of the relationships between uranium-stressed moso bamboo’s enrichment and transfer coefficients and physiological markers
3 討論
重金屬污染土壤會嚴重影響植物生長,當濃度超過臨界值時,會出現植株生長狀況不良、葉片褪綠變黃及葉片枯萎、生物量明顯減少及植株死亡等毒害癥狀[14-16]。植物遭受重金屬毒害癥狀最直觀的表現是生物量,同時生物量也是評估植物抗逆能力的重要指標。本研究中,毛竹生物量(鮮重和干重)隨著鈾濃度的增加呈現先增加后降低趨勢,低濃度(10~50 mg·L-1)鈾脅迫對毛竹幼苗生物量有促進作用。當鈾濃度大于50 mg·L-1時,隨著鈾濃度的升高,毛竹鮮重和干重呈顯著下降趨勢,鈾對地上部的抑制作用大于地下部,這與趙奇等[17]的研究結果類似。
植物在遭受脅迫時,光合速率會受到氣孔限制和非氣孔限制兩方面影響[18]。有研究表明,當Pn 下降時,若植物Ci 和Gs 反而升高,說明葉片光合速率降低的主要限制因素是非氣孔因素,即葉肉細胞光合活性的下降;當Pn 下降時,若植物Ci 和Gs 同樣下降,說明氣孔是限制葉片光合速率的主要因素[19-20]。本研究發現,當鈾濃度為50 mg·L-1時,毛竹氣孔導度和蒸騰速率達到最大,這有利于植物維持自身正常的葉溫,同時也利于植物營養物質的運輸,對于促進植物生長起到很大的作用[14]。在高濃度鈾(100~400 mg·L-1)處理時,毛竹凈光合速率、氣孔導度和蒸騰速率較對照明顯降低,胞間CO2濃度變化不顯著,說明凈光合速率下降的內在原因主要是受非氣孔因素影響,即葉肉細胞光合活性的下降[21];同時高濃度鈾處理造成毛竹膜脂過氧化、細胞損傷,光合作用受到抑制[14]。
當植物遭受重金屬脅迫時會產生大量的自由基[22],這些自由基將會嚴重造成植物生長緩慢、抑制正常的代謝活動。因此,植物本身將會啟動一系列抗氧化酶系統來減少自由基,以保證其正常生長,其中起主要作用的是SOD、POD 和CAT[23]。本研究發現,重金屬對植物的抗氧化酶系統產生了影響,但植物的SOD、POD和CAT 活性均隨鈾濃度的增加呈現出先升高后降低的趨勢,這表明植物具有一定的抗逆能力,但其保護作用有一定限度[14,24]。同時,SOD、POD、CAT、APX 活性均在鈾濃度為50 mg·L-1處理下達到最大值,表明該濃度下毛竹體內抗氧化酶系統的響應最為積極,能夠有效清除植株體內過量的活性氧物質。在最高濃度(400 mg·L-1)處理下抗氧化酶活性較對照顯著下降,可能是由于植物體內防御系統對活性氧的清除能力減弱,已不能阻止自由基在植物細胞內的累積,導致細胞膜脂過氧化,引起細胞的衰老和死亡,最終使抗氧化酶活性下降。丙二醛是植物細胞發生膜脂過氧化后的最終產物,從而用來衡量植物受脅迫程度[14,25]。隨著鈾濃度的升高,毛竹的MDA 含量逐漸升高,說明在高濃度鈾脅迫下植物產生了大量活性氧,抗氧化酶系統無法清除大量的活性氧,從而造成嚴重的膜脂過氧化,對細胞膜系統造成損傷。
重金屬對植物的毒害作用主要表現在植物對重金屬的吸收和運輸上,與重金屬在植物不同器官之間的分配,以及植物體內重金屬的結合形態等因素有關[26]。植物吸收鈾的主要器官是根系,并逐漸向莖、葉等器官轉移[27]。Ding 等[28]對鉻脅迫下紅麻體內鉻含量的研究及陳小米等[29]對鎘和鋅復合污染條件下竹柳重金屬含量的研究結果均顯示,植物體內重金屬含量隨著環境重金屬濃度的增加而增加。本研究同樣發現,在鈾濃度為400 mg·L-1時,毛竹根、莖、葉的鈾富集濃度分別為9 089、519 和276 mg·kg-1,由此可見,根部對鈾的積累量遠大于莖和葉部。有關毛竹對鈾的轉運機制還有待深入研究。
本研究結果表明,Pn 和Tr、Ci 呈顯著或極顯著正相關,Tr 與Ci 呈極顯著正相關,Ci 與MDA、Chl a、Chl b含量和TF 呈顯著或極顯著正相關,SOD 活性和POD、CAT、APX活性呈顯著正相關,POD活性與APX活性呈顯著或極顯著正相關,CAT 活性和APX 活性、MDA 含量呈顯著或極顯著正相關,APX 活性和Chl a含量呈顯著正相關,MDA 與Chl a 含量呈極顯著正相關,BCF 和TF 呈極顯著正相關。隨著鈾濃度的增大,光合作用受到了明顯抑制,胞間二氧化碳濃度對氣孔導度的影響不大,抗氧化酶活性不斷增大,以此來抵抗逆境,表明毛竹具有較強的耐受性,從而導致丙二醛含量逐漸增加,引起細胞內離子平衡失調,代謝紊亂,生長受到抑制。這與王一峰等[30]有關鉛脅迫對污染區與非污染區烏蘇里風毛菊MDA 含量影響的結果相似。從富集系數和轉移系數來看,隨著鈾濃度的增加,二者整體呈下降趨勢,其中在10 和50 mg·L-1處理時,毛竹吸收和轉移鈾的能力最強,這是因為低濃度脅迫下,水體中的鈾含量基數相對較小,更有利于植物吸收和轉移鈾。在高濃度鈾處理下,BCF和TF整體呈下降趨勢,說明毛竹對鈾的富集和轉移能力相對較高,從而導致了植物向地上部分富集和轉移重金屬的能力減弱[31-32]。有研究表明,富集系數與轉移系數可以很好地反映植物對重金屬的富集和轉移能力[33]。富集系數和轉移系數均大于1的植物為超富集植物,二者均小于1則為富集植物,后續需進一步研究如何使植物地上部從地下部吸收較多的鈾,進一步證明毛竹對鈾污染水體具有潛在的修復能力。
4 結論
本研究結果表明,在乙酸雙氧鈾濃度為10~50 mg·L-1時,SOD、POD、CAT 和APX 活性隨鈾濃度的增加而上升,可以緩解鈾對毛竹造成的氧化損傷,對毛竹生長發育無明顯影響;而在400 mg·L-1高濃度鈾脅迫下,毛竹幼苗體內抗氧化酶活性降低,膜系統受到破壞,導致毛竹細胞受到嚴重傷害,對毛竹生長發育具有抑制作用。當鈾濃度為400 mg L-1時,毛竹根、莖、葉對鈾的積累量達到最大值,根部富集量明顯大于地上部,且向莖葉轉移鈾的能力較弱。綜上,毛竹并非理想的鈾超富集植物,但其較強的耐受力和根部較強的富集能力使其有望成為鈾污染水體治理的潛在植物之一。

