基于腎小球?yàn)V過率的腎上腺醛固酮瘤列線圖預(yù)測(cè)模型的建立與驗(yàn)證研究
常鈺朋 耿茜茜 火睿 孫侃 常向云 李軍 朱凌云 董玉潔 羅麗娜

【摘要】 背景 醛固酮瘤(APA)是原發(fā)性醛固酮增多癥的常見類型。對(duì)于單側(cè)腎上腺腺瘤者,雖然共識(shí)推薦血漿醛固酮與腎素比值(ARR)作為APA的篩查指標(biāo),由于缺乏統(tǒng)一的檢測(cè)方法和診斷流程,ARR切點(diǎn)值范圍變化大。因此臨床需要一種可靠、快捷的預(yù)測(cè)模型協(xié)助鑒別APA。目的 探討腎小球?yàn)V過率(GFR)與APA的相關(guān)性,基于此構(gòu)建APA的列線圖預(yù)測(cè)模型并驗(yàn)證。方法 收集2012—2022年石河子大學(xué)第一附屬醫(yī)院經(jīng)腎上腺內(nèi)分泌激素評(píng)估后行手術(shù)治療病理回報(bào)為單側(cè)腎上腺腫物患者493例,根據(jù)APA和腎上腺無功能腺瘤的診斷標(biāo)準(zhǔn),最終納入APA組155例,無功能腺瘤合并原發(fā)性高血壓組113例。收集患者的病史資料、生化資料等。按照GFR四分位數(shù)水平將患者分組,分析GFR與APA的相關(guān)性。通過多因素Logistic回歸分析篩選APA的危險(xiǎn)因素并構(gòu)建列線圖預(yù)測(cè)模型。采用受試者工作特征(ROC)曲線分析預(yù)測(cè)模型的區(qū)分度,一致性指數(shù)(C-index)評(píng)價(jià)模型的預(yù)測(cè)精準(zhǔn)度,Hosmer-Lemeshow檢測(cè)模型的擬合度,運(yùn)用決策曲線與臨床獲益曲線評(píng)價(jià)模型的診斷效能。結(jié)果 按照GFR四分位數(shù)進(jìn)行分組(Q1~Q4組),Q1組:≥107.4 mL·min-1·(1.73 m2)-1(n=67),Q2組:99.7~107.3 mL·min-1·(1.73 m2)-1(n=67),Q3組:88.6~99.6 mL·min-1·(1.73 m2)-1(n=67),Q4組:≤88.5 mL·min-1·(1.73 m2)-1(n=67),各組APA發(fā)生率分別為47.8%(32/67)、53.7%(36/67)、58.2%(39/67)、71.6%(48/67)。Logistic回歸趨勢(shì)性檢驗(yàn)提示隨著GFR水平降低,APA患病風(fēng)險(xiǎn)呈趨勢(shì)性升高(P<0.05)。多因素Logistic回歸分析結(jié)果顯示:收縮壓>160 mmHg(OR=5.209,95%CI=2.531~10.720)、高血壓病程≥59個(gè)月(OR=4.326,95%CI=1.950~9.595)、血鉀<3.25 mmol/L(OR=4.714,95%CI=2.046~10.860)、GFR[Q4組:≤88.5 mL·min-1·(1.73 m2)-1](OR=4.106,95%CI=1.492~11.300)、基礎(chǔ)血漿醛固酮>13.42 ng/dL(OR=8.756,95%CI=4.320~17.749)為APA發(fā)生的獨(dú)立危險(xiǎn)因素(P<0.050)。根據(jù)多因素篩選的變量構(gòu)建列線圖預(yù)測(cè)模型,該模型ROC曲線下面積為0.898(95%CI=0.859~0.936),以此建立的列線圖預(yù)測(cè)模型C-index為0.898,模型有較好的預(yù)測(cè)精度。Hosmer-Lemeshow檢驗(yàn)顯示該模型有較好的擬合度(χ2=14.059,P=0.080)。預(yù)測(cè)概率閾值在0.10~0.90時(shí)該模型具有顯著的預(yù)測(cè)效能。結(jié)論 隨著GFR水平降低,APA患病風(fēng)險(xiǎn)呈趨勢(shì)性升高。基于收縮壓、高血壓病程、血鉀、GFR四分位分組、基礎(chǔ)血漿醛固酮5種因素構(gòu)建的APA預(yù)測(cè)模型具有較好的預(yù)測(cè)性、一致性和臨床實(shí)用性,可幫助識(shí)別APA,有助于臨床決策。
【關(guān)鍵詞】 原發(fā)性醛固酮增多癥;醛固酮瘤;腎小球?yàn)V過率;列線圖;預(yù)測(cè)模型
【中圖分類號(hào)】 R 586.24 【文獻(xiàn)標(biāo)識(shí)碼】 A DOI:10.12114/j.issn.1007-9572.2023.0436
Construction and Verification the Nomogram Prediction Model for Primary Aldosteronism Based on Glomerular Filtration Rate
CHANG Yupeng1,GENG Xixi1,HUO Rui1*,SUN Kan1,CHANG Xiangyun1,LI Jun1,ZHU Lingyun1,DONG Yujie1,LUO Lina2
1.Department of Endocrinology,F(xiàn)irst Affiliated Hospital,Shihezi University,Shihezi 832000,China
2.The School of Medicine,Shihezi University,Shihezi 832000,China
*Corresponding author:HUO Rui,Associate professor;E-mail:huodoctor@163.com
【Abstract】 Background Aldosterone-producing adenoma(APA) is a common type of primary aldosteronism. For those with unilateral adrenocortical adenoma,although expert consensus recommends plasma aldosterone-to-renin ratio(ARR) as a screening indicator for APA,the range of ARR cut-off values varies widely due to the lack of unified detection method and diagnostic process. Therefore,there is a clinical need for a reliable and rapid predictive model to assist in identifying APA. Objective To explore the correlation between glomerular filtration rate(GFR) and APA,construct and validate the nomogram prediction model of APA. Methods A total of 493 patients with with pathologic results of unilateral adrenal mass who underwent surgical treatment after evaluation of adrenal endocrine hormones in the first affiliated hospital of Shihezi University from 2012 to 2022 were collected,155 patients were ultimately included in the APA group and 113 patients in nonfunctioning adrenal adenoma combined with essential hypertension group according to the diagnostic criteria of APA and nonfunctioning adrenal adenoma. The patients' clinical data and biochemical data were collected. The patients were grouped according to GFR quartiles,and the correlation between GFR and APA was analyzed. The risk factors for APA were screened by multivariate Logistic regression analysis and a nomogram prediction model was constructed. Receiver operating characteristic(ROC) curve was used to analyze the discrimination of the prediction model,a consistency index(C-index) was used to evaluate the predictive accuracy of the model,Hosmer Lemeshow test was used to verify the fit of model,and the diagnostic efficacy of the model was evaluated using decision curve and clinical benefit curve. Results The patients were grouped according to GFR quartiles (Q1 to Q4 groups),Q1 group:≥107.4 mL·min-1·(1.73 m2)-1(n=67),Q2 group:99.7-107.3 mL·min-1·(1.73 m2)-1(n=67),Q3 group:88.6-99.6 mL·min-1·(1.73 m2)-1(n=67) and Q4 group:≤88.5 mL·min-1·(1.73 m2)-1(n=67),and the proportion of APA in each group was 47.8%(32/67),53.7%(36/67),58.2%(39/67) and 71.6%(48/67). Logistic regression trend test suggested that the risk of APA tended to increase as GFR levels decreased(P<0.05). Multivariate Logistic regression analysis showed that systolic blood pressure >160 mmHg(OR=5.209,95%CI=2.531-10.720),hypertension duration≥59 months(OR=4.326,95%CI=1.950-9.595),blood potassium<3.25mmol/L(OR=4.714,95%CI=2.046-10.860),GFR[Q4 gourp:≤88.5 mL·min-1·(1.73 m2)-1](OR=4.106,95%CI=1.492-11.300),basal aldosterone>13.42 ng/dL(OR=8.756,95%CI=4.320-17.749) were independent risk factors for the occurrence of APA(P<0.050). The Nomogram prediction model was constructed based on the above variables of multivariate regression with an AUC of 0.898(95%CI=0.859-0.936) and a C-index of 0.898,indicating a good prediction accuracy. The Hosmer-Lemeshow test showed that the model had a good fit(χ2=14.059,P=0.080). The model had a significant predictive efficacy at prediction probability thresholds of 0.10 to 0.90. Conclusion The risk of APA prevalence tends to increase with decreasing GFR levels. The APA prediction model constructed based on five factors,including systolic blood pressure,hypertension course,blood potassium,GFR quartile grouping and basal aldosterone,has good predictability,consistency and clinical practicality,which can help identify APA and contribute to clinical decision making.
【Key words】 Primary hyperaldosteronism;Aldosterone-producing adenoma;Glomerular filtration rate;Nomogram;Predictive model
原發(fā)性醛固酮增多癥(primary aldosteronism,PA)是繼發(fā)性高血壓最常見的病因[1],而醛固酮瘤(aldosterone-producing adenoma,APA)是PA常見的類型,約占PA的35%[2]。對(duì)于單側(cè)腎上腺腺瘤患者,《原發(fā)性醛固酮增多癥診斷治療的專家共識(shí)(2020版)》推薦血漿醛固酮與腎素比值(aldosterone to rennin ratio,ARR)作為APA的篩查指標(biāo)[2],由于缺乏統(tǒng)一的檢測(cè)方法和診斷流程,導(dǎo)致ARR最佳截?cái)嘀底兓秶浅4螅蔀榕R床實(shí)際應(yīng)用中較棘手的問題。該共識(shí)也指出單純影像學(xué)檢查不能區(qū)分腎上腺無功能腺瘤和APA,腎上腺靜脈采血(adrenal venous sampling,AVS)是明確PA最可靠、最準(zhǔn)確的方法[2-3],但AVS為有創(chuàng)檢查且價(jià)格昂貴,耗時(shí)、費(fèi)力且技術(shù)要求高,目前國內(nèi)常規(guī)開展AVS的醫(yī)院或機(jī)構(gòu)為數(shù)不多[4]。因此需要一種簡(jiǎn)便、快捷的臨床應(yīng)用模型協(xié)助區(qū)分APA與無功能腺瘤。臨床中部分APA患者存在腎小球?yàn)V過率(glomerular filtration rate,GFR)降低的情況,APA患者的腎臟損害程度比原發(fā)性高血壓更嚴(yán)重[2]。本研究通過對(duì)APA與GFR的相關(guān)性進(jìn)行探索,構(gòu)建基于GFR和臨床資料的APA列線圖預(yù)測(cè)模型,進(jìn)而幫助臨床診治。
1 對(duì)象與方法
1.1 研究對(duì)象
收集2012—2022年石河子大學(xué)第一附屬醫(yī)院經(jīng)腎上腺內(nèi)分泌激素評(píng)估后行手術(shù)治療病理回報(bào)為單側(cè)腎上腺腫物患者493例,排除庫欣綜合征65例、嗜鉻細(xì)胞瘤58例、腎上腺轉(zhuǎn)移癌16例、腎上腺皮質(zhì)癌2例、腎上腺囊腫33例、髓性脂肪瘤8例、節(jié)細(xì)胞神經(jīng)瘤6例、腎上腺海綿狀血管瘤8例、淋巴瘤1例、資料不全者21例,最終納入APA 155例,無功能腺瘤120例,其中無功能腺瘤合并原發(fā)性高血壓者113例。APA的診斷標(biāo)準(zhǔn)參照《原發(fā)性醛固酮增多癥診斷治療的專家共識(shí)(2020版)》[2]:(1)篩查試驗(yàn)陽性判定:醛固酮單位為ng/dL,腎素濃度單位為mU/L時(shí)ARR截?cái)嘀禐?.7,腎素活性單位為ng·mL-1·h-1時(shí)ARR截?cái)嘀禐?0;(2)確診試驗(yàn)判定:生理鹽水試驗(yàn)后血醛固酮>10 ng/dL或卡托普利試驗(yàn)后血醛固酮濃度下降<30%;(3)CT檢查顯示單側(cè)腎上腺結(jié)節(jié)且對(duì)側(cè)腎上腺無異常;(4)術(shù)后病理診斷為腎上腺皮質(zhì)腺瘤,術(shù)后血鉀、血壓改善,使用降壓藥物的種類或劑量減少。腎上腺無功能腺瘤診斷標(biāo)準(zhǔn):經(jīng)術(shù)后病理回報(bào)為腎上腺皮質(zhì)腺瘤,同時(shí)排除其他功能性腺瘤。本研究經(jīng)石河子大學(xué)第一附屬醫(yī)院倫理委員會(huì)審批(審批號(hào):KJX-2021-055-01)。所有患者已簽署知情同意書。
1.2 研究方法
收集患者性別、年齡、BMI、收縮壓(SBP)、舒張壓(DBP)、糖尿病等病史資料;電解質(zhì)、CO2結(jié)合力(CO2CP)、血清葡萄糖(GLU)、GFR等生化指標(biāo),計(jì)算血清鈣與血清磷乘積(Ca-P產(chǎn)物)[5];基礎(chǔ)血漿醛固酮和基礎(chǔ)血漿腎素濃度;平掃及動(dòng)脈期CT值、腫瘤直徑(CT下最大橫斷面上的最大直徑)等。
1.3 統(tǒng)計(jì)學(xué)分析
運(yùn)用SPSS 26.0、R語言(4.22版)及R studio統(tǒng)計(jì)軟件對(duì)數(shù)據(jù)進(jìn)行分析。符合正態(tài)分布的計(jì)量資料以(x-±s)表示,兩組間比較采用獨(dú)立樣本t檢驗(yàn);非正態(tài)分布的計(jì)量資料以M(P25,P75)表示,兩組間比較采用秩和檢驗(yàn);計(jì)數(shù)資料的分析采用χ2檢驗(yàn)。按照GFR四分位數(shù)水平將患者分組,并采用Logistic回歸分析探討GFR與APA的相關(guān)性。將單變量分析中有統(tǒng)計(jì)學(xué)意義的臨床資料以最優(yōu)分箱和最佳截?cái)嘀档姆绞睫D(zhuǎn)換分類變量,經(jīng)單因素Logistic回歸分析后,用向后逐步回歸法行多因素Logistic回歸分析篩選APA發(fā)生的危險(xiǎn)因素并繪制列線圖預(yù)測(cè)模型。利用受試者工作特征(ROC)曲線分析預(yù)測(cè)模型的區(qū)分度,一致性指數(shù)(C-index)評(píng)價(jià)模型的預(yù)測(cè)精度,Hosmer-Lemeshow和校準(zhǔn)曲線分別驗(yàn)證模型的擬合度及校準(zhǔn)度。采用Bootstrap進(jìn)行內(nèi)部數(shù)據(jù)抽樣驗(yàn)證,最后以決策曲線和臨床影響曲線分析評(píng)估模型臨床凈收益。以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 APA者與無功能腺瘤合并原發(fā)性高血壓者基線資料比較
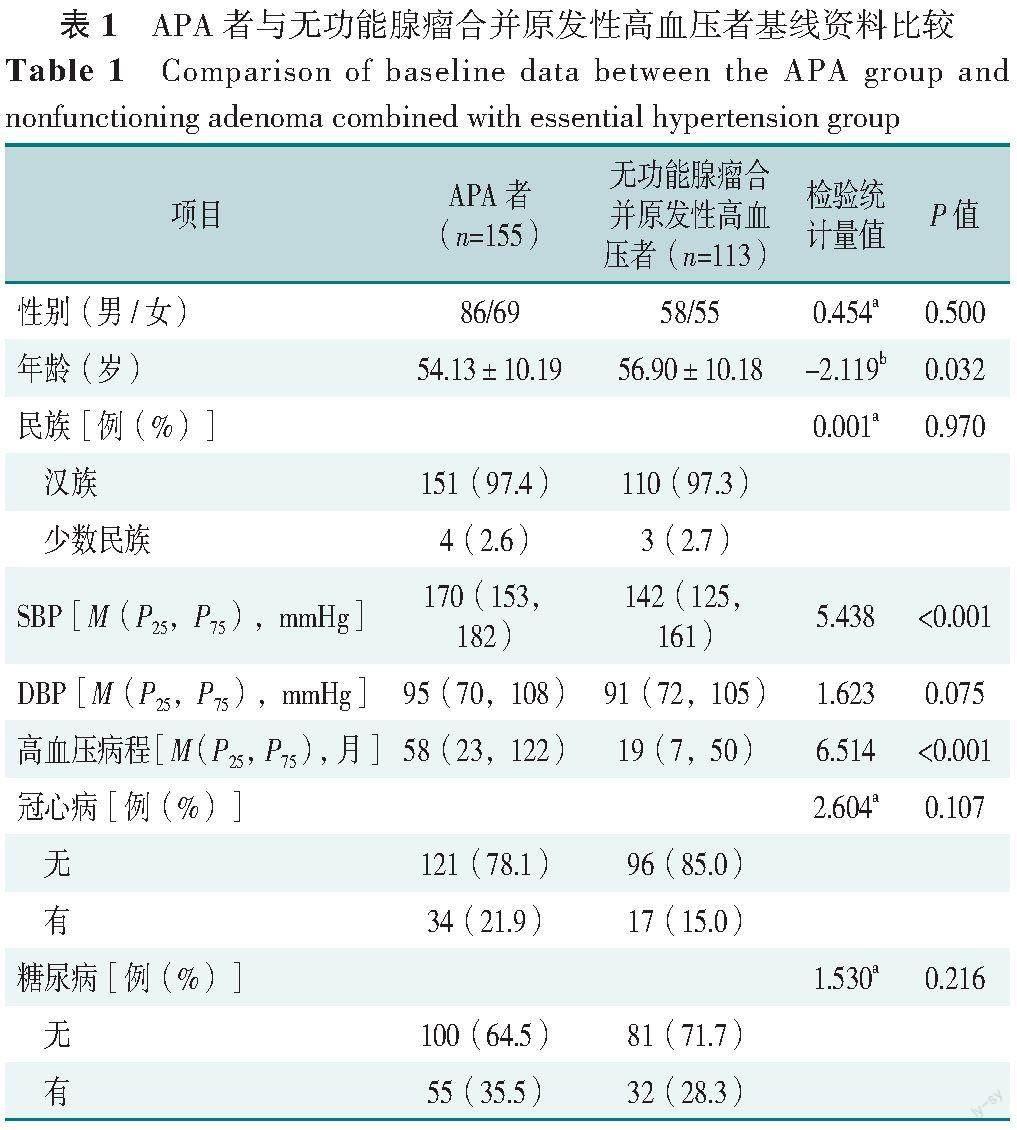
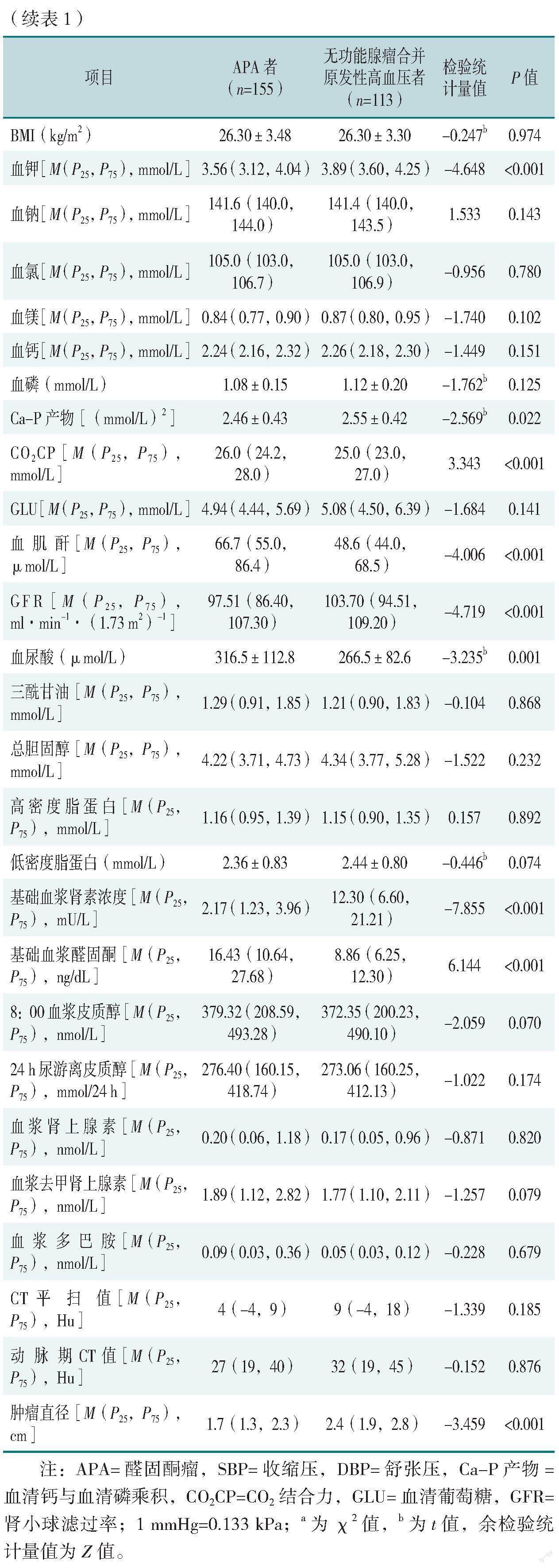
APA者與無功能腺瘤合并原發(fā)性高血壓者性別、民族、DBP、冠心病、糖尿病、BMI、血鈉、血氯、血鎂、血鈣、血磷、GLU、三酰甘油、總膽固醇、高密度脂蛋白、低密度脂蛋白、8:00血漿皮質(zhì)醇、24 h尿游離皮質(zhì)醇、血漿腎上腺素、血漿去甲腎上腺素、血漿多巴胺、CT平掃值、動(dòng)脈期CT值比較,差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),見表1。
APA者SBP、高血壓病程、CO2CP、血肌酐、血尿酸、基礎(chǔ)血漿醛固酮水平高于無功能腺瘤合并原發(fā)性高血壓者,年齡、GFR、血鉀、Ca-P產(chǎn)物、基礎(chǔ)血漿腎素濃度、腫瘤直徑低于無功能腺瘤合并原發(fā)性高血壓者,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),見表1。
2.2 GFR與APA的相關(guān)分析
根據(jù)GFR的四分位數(shù)將患者分為4組,Q1組:≥107.4 mL·min-1·(1.73 m2)-1(n=67),Q2組:99.7~107.3 mL·min-1·(1.73 m2)-1(n=67),Q3組:88.6~99.6 mL·min-1·(1.73 m2)-1(n=67),Q4組:≤88.5 mL·min-1·(1.73 m2)-1(n=67),各組APA發(fā)生率分別為47.8%(32/67)、53.7%(36/67)、58.2%(39/67)、71.6%(48/67)。以是否發(fā)生APA為因變量(賦值:是=1,否=0),以GFR水平四分位分組為自變量行Logistic回歸分析,Logistic回歸趨勢(shì)性檢驗(yàn)提示隨著GFR水平降低,APA患病風(fēng)險(xiǎn)呈趨勢(shì)性升高(P=0.007);在較正年齡(賦值:實(shí)測(cè)值)、SBP(賦值:實(shí)測(cè)值)、高血壓病程(賦值:實(shí)測(cè)值)、血鉀(賦值:實(shí)測(cè)值)、Ca-P產(chǎn)物(賦值:實(shí)測(cè)值)、CO2CP(賦值:實(shí)測(cè)值)、血肌酐(賦值:實(shí)測(cè)值)、血尿酸(賦值:實(shí)測(cè)值)、基礎(chǔ)血漿腎素濃度(賦值:實(shí)測(cè)值)、基礎(chǔ)血漿醛固酮(賦值:實(shí)測(cè)值)和腫瘤直徑(賦值:實(shí)測(cè)值)后,該趨勢(shì)依舊存在(P=0.017),見表2。
2.3 APA相關(guān)預(yù)測(cè)因素的Logistic回歸分析
將單因素分析中有統(tǒng)計(jì)學(xué)意義的項(xiàng)目進(jìn)行最優(yōu)分箱處理,無法最優(yōu)分箱的項(xiàng)目以最佳截?cái)嘀颠M(jìn)行分組處理。結(jié)果示:血鉀以3.25 mmol/L分箱,模型熵為0.930;CO2CP以29 mmol/L分箱,模型熵為0.931;模型熵提示兩者分箱化變量預(yù)測(cè)準(zhǔn)確度較高。年齡、SBP、高血壓病程、Ca-P產(chǎn)物、血肌酐、血尿酸、血漿醛固酮、血漿腎素濃度、腫瘤直徑的最佳截?cái)嘀捣謩e為55歲、160 mmHg(1 mmHg=0.133 kPa)、59個(gè)月、2.63(mmol/L)2、
60.2 μmol/L、282.5 μmol/L、13.42 ng/dL、2.07 mU/L、2.01 cm。以是否發(fā)生APA為因變量(賦值:是=1,否=0),以單因素分析中有統(tǒng)計(jì)學(xué)意義的項(xiàng)目為自變量行多因素Logistic回歸分析,結(jié)果顯示:SBP>160 mmHg、高血壓病程≥59個(gè)月、血鉀<3.25 mmol/L、GFR Q4組、基礎(chǔ)血漿醛固酮>13.42 ng/dL是APA發(fā)生的獨(dú)立危險(xiǎn)因素(P<0.05),見表3。
2.4 列線圖模型的構(gòu)建
基于多因素Logistic回歸篩選的5項(xiàng)因素,構(gòu)建列線圖模型(圖1),通過將相應(yīng)預(yù)測(cè)因子的得分相加得出總分,總分對(duì)應(yīng)的概率即預(yù)測(cè)APA發(fā)生風(fēng)險(xiǎn)的概率。
2.5 列線圖模型的驗(yàn)證
APA的列線圖預(yù)測(cè)模型ROC曲線結(jié)果顯示:AUC為0.898(95%CI=0.859~0.936),最大約登指數(shù)為0.694,預(yù)測(cè)APA的靈敏度為88.5%,特異度為91.7%。模型C-index為0.898,有較好的預(yù)測(cè)精度。Hosmer-Lemeshow擬合度檢驗(yàn)結(jié)果顯示χ2=14.059,P=0.080,該模型有較好的擬合度。使用Bootstrap 1 000次自主抽樣進(jìn)行內(nèi)部驗(yàn)證,結(jié)果示模型平均絕對(duì)誤差=0.015,校準(zhǔn)曲線與理想曲線吻合度高,預(yù)測(cè)模型準(zhǔn)確性高(圖2)。
2.6 列線圖模型的臨床應(yīng)用
決策曲線顯示該模型預(yù)測(cè)APA較單一因素預(yù)測(cè)APA閾值范圍廣,提供的標(biāo)準(zhǔn)化凈獲益率較單一預(yù)測(cè)因素高,當(dāng)模型預(yù)測(cè)APA發(fā)生風(fēng)險(xiǎn)概率閾值在0.10~0.90時(shí),可提供積極標(biāo)準(zhǔn)化凈收益(圖3)。臨床影響曲線顯示當(dāng)閾概率>0.77時(shí),該預(yù)測(cè)模型判定為APA高風(fēng)險(xiǎn)人群與實(shí)際發(fā)生APA人群高度匹配,臨床有效率高(圖4)。
3 討論
既往認(rèn)為PA是少見病,其發(fā)生率在高血壓人群中<1%,現(xiàn)研究表明PA是繼發(fā)性高血壓最常見的原因,高血壓中PA的患病率達(dá)10%~20%[6],國內(nèi)有研究提出中國高血壓人群中PA的預(yù)測(cè)模型[7-9],但沒有進(jìn)一步對(duì)PA常見的類型APA構(gòu)建預(yù)測(cè)模型。本研究在探討GFR與APA相關(guān)性的同時(shí),構(gòu)建了具有一定實(shí)用性的APA列線圖預(yù)測(cè)模型,且獲得途徑簡(jiǎn)易,在門診即可完成。
本研究中APA者高血壓3級(jí)占比最高[75例(48.3%)],2級(jí)占比次之[50例(32.3%)],1級(jí)占比最低[30例(19.4%)],與國內(nèi)李南方等[10]報(bào)道的PA高血壓占比研究結(jié)果相近。與無功能腺瘤合并原發(fā)性高血壓者相比,APA者SBP較高,考慮與醛固酮通過參與水、鹽平衡的調(diào)節(jié),從而引起血壓升高有關(guān)[11];有研究表明,高血壓病程越長(zhǎng),導(dǎo)致動(dòng)脈粥樣硬化和腎臟等靶器官損害的可能性越大,不利于患者術(shù)后的轉(zhuǎn)歸[12],本研究中APA者高血壓病程明顯長(zhǎng)于無功能腺瘤合并原發(fā)性高血壓者,GFR水平也較無功能腺瘤者低,進(jìn)一步證實(shí)了在高血壓人群中篩查PA的重要性。
KAWASHIMA等[13]研究表明醛固酮與PA患者的腎功能損害密切相關(guān)。本研究顯示,APA者基礎(chǔ)血漿醛固酮明顯偏高,基礎(chǔ)血漿腎素濃度明顯偏低,且APA患病風(fēng)險(xiǎn)隨著GFR水平降低呈趨勢(shì)性升高,與上述報(bào)道相似。APA在GFR Q1組、Q2組和Q3組中占比接近,考慮為早期鈉重吸收增加和腎灌注壓增加,使得腎小球處于高濾過狀態(tài),腎臟出現(xiàn)功能性適應(yīng),此階段結(jié)構(gòu)性腎損傷并不明顯[14]。過量的醛固酮可促進(jìn)腎外髓質(zhì)鉀通道活性,從而增加鈉氯協(xié)同轉(zhuǎn)運(yùn)蛋白,導(dǎo)致鉀離子的外排增加[15]。本研究中APA者血鉀水平明顯低于無功能腺瘤合并原發(fā)性高血壓者,且低鉀血癥在APA者中占比為47.1%,無功能腺瘤合并原發(fā)性高血壓者中為15.0%,與上述報(bào)道相符。此外,APA組CO2CP水平明顯高于無功能腺瘤組,考慮主要與堿血癥相關(guān),低鉀血癥時(shí),細(xì)胞內(nèi)鉀離子丟失,細(xì)胞外液的鈉、氫離子進(jìn)入細(xì)胞內(nèi),細(xì)胞外液氫離子減少,pH上升,加之腎小管對(duì)碳酸氫根重吸收增加,從而導(dǎo)致堿血癥[16]。
有關(guān)APA風(fēng)險(xiǎn)模型,各種評(píng)分系統(tǒng)的發(fā)展及應(yīng)用為臨床決策的制訂提供了依據(jù)。2012年國外學(xué)者K?PERS等[17]提出了聯(lián)合典型腺瘤影像學(xué)表現(xiàn)、血鉀<3.5 mmol/L、估算腎小球?yàn)V過率的評(píng)分,建議≥5分的患者直接行手術(shù)治療;2017年國內(nèi)專家指出K?PERS評(píng)分的不適應(yīng)性并做出修改,提出了聯(lián)合尿醛固酮、低血鉀與腎上腺瘤體大小的預(yù)測(cè)模型[18]。本研究基于最優(yōu)分箱和最佳截?cái)嘀捣ㄗ罱K篩選出SBP、高血壓病程、血鉀、GFR和基礎(chǔ)血漿醛固酮5項(xiàng)指標(biāo)構(gòu)建了APA的列線圖預(yù)測(cè)模型,該方法避免了廣義線性模型的表達(dá)受限,模型會(huì)更穩(wěn)定,降低了模型過擬合的風(fēng)險(xiǎn)。
綜上所述,基于上述研究構(gòu)建的APA預(yù)測(cè)模型可幫助區(qū)分影像學(xué)CT檢查腎上腺無功能腺瘤與APA鑒別困難的問題,且具有良好的預(yù)測(cè)效果和臨床實(shí)用性,對(duì)臨床醫(yī)師評(píng)判患者病情、合理制訂臨床治療方案和醫(yī)療資源的合理配置具有重要的臨床實(shí)踐意義。本研究存在一定的局限性:首先,本研究時(shí)間跨度長(zhǎng),可能包括一些未知的混雜因素影響;其次,本研究樣預(yù)測(cè)模型適用范圍有限,關(guān)注重點(diǎn)是APA與腎上腺無功能腺瘤合并原發(fā)性高血壓的鑒別,后續(xù)會(huì)進(jìn)一步增加樣本量、完善適用范圍更廣、更具實(shí)用性的模型;最后,本研究為單中心、病例對(duì)照研究,且僅采用內(nèi)部驗(yàn)證方法驗(yàn)證。后續(xù)還需進(jìn)一步開展多中心、前瞻性臨床研究,并采用外部驗(yàn)證的方法進(jìn)一步優(yōu)化模型,為臨床診療決策提供更多幫助。
作者貢獻(xiàn):常鈺朋、耿茜茜進(jìn)行論文撰寫、數(shù)據(jù)整理、統(tǒng)計(jì)學(xué)分析;火睿進(jìn)行研究指導(dǎo)、論文修改、經(jīng)費(fèi)支持;孫侃、常向云、李軍、朱凌云做出支持性貢獻(xiàn);董玉潔、羅麗娜采集數(shù)據(jù);所有作者確認(rèn)了論文的最終稿。
本文無利益沖突。
參考文獻(xiàn)
MONTICONE S,BURRELLO J,TIZZANI D,et al. Prevalence and clinical manifestations of primary aldosteronism encountered in primary care practice[J]. J Am Coll Cardiol,2017,69(14):1811-1820. DOI:10.1016/j.jacc.2017.01.052.
中華醫(yī)學(xué)會(huì)內(nèi)分泌學(xué)分會(huì). 原發(fā)性醛固酮增多癥診斷治療的專家共識(shí)(2020版)[J]. 中華內(nèi)分泌代謝雜志,2020,36(9):727-736. DOI:10.3760/cma.j.cn311282-20200615-00444.
LUPI A,BATTISTEL M,BARBIERO G,et al. Simultaneous bilateral adrenal vein sampling for primary aldosteronism:useful tips to make it simple and safe[J]. Eur Radiol,2019,29(11):6330-6335. DOI:10.1007/s00330-019-06209-5.
杜志鵬,楊淑敏,李啟富. 原發(fā)性醛固酮增多癥的無創(chuàng)分型:撥云睹日[J]. 中華內(nèi)科雜志,2023,62(3):237-241.
王夢(mèng)卉,張瑋瑋,彩麗,等. 血清鈣磷乘積與原發(fā)性醛固酮增多癥的相關(guān)性[J]. 臨床心血管病雜志,2022,38(1):68-72. DOI:10.13201/j.issn.1001-1439.2022.01.014.
蔣怡然,王衛(wèi)慶. 原發(fā)性醛固酮增多癥在中國的診治現(xiàn)狀及研究進(jìn)展[J]. 中華內(nèi)分泌代謝雜志,2018,34(9):717-720. DOI:10.3760/cma.j.issn.1000-6699.2018.09.001.
LIN W B,GAN W J,F(xiàn)ENG P N,et al. Online prediction model for primary aldosteronism in patients with hypertension in Chinese population:a two-center retrospective study[J]. Front Endocrinol,2022,13:882148. DOI:10.3389/fendo.2022.882148.
CHEN P T,CHANG D W,LIU K L,et al. Radiomics utilization to differentiate nonfunctional adenoma in essential hypertension and functional adenoma in primary aldosteronism[J]. Sci Rep,2022,12(1):8892. DOI:10.1038/s41598-022-12835-9.
ZHANG M,BIAN G,TIAN J Y,et al. Assessment of biochemical outcomes in patients with primary aldosteronism after adrenalectomy based on CT scan diagnosis of unilateral adenoma without adrenal vein sampling[J]. Front Oncol,2022,12:944035. DOI:10.3389/fonc.2022.944035.
李南方,李紅建,王紅梅,等. 330例原發(fā)性醛固酮增多癥患者的臨床分析[J]. 中華內(nèi)分泌代謝雜志,2011,27(9):752-754. DOI:10.3760/cma.j.issn.1000-6699.2011.09.013.
MARTINEZ M F,MARTINI A G,SEQUEIRA-LOPEZ M L S,et al. Ctcf is required for renin expression and maintenance of the structural integrity of the kidney[J]. Clin Sci,2020,134(13):1763-1774. DOI:10.1042/CS20200184.
何小群,楊珊,吳玨蒞,等. 預(yù)測(cè)原發(fā)性醛固酮增多癥術(shù)后血壓的轉(zhuǎn)歸:Fisher判別模型[J]. 中華醫(yī)學(xué)雜志,2016,96(42):3379-3383.
KAWASHIMA A,SONE M,INAGAKI N,et al. Renal impairment is closely associated with plasma aldosterone concentration in patients with primary aldosteronism[J]. Eur J Endocrinol,2019,181(3):339-350. DOI:10.1530/EJE-19-0047.
KOBAYASHI H,ABE M,NAKAMURA Y,et al. Association between acute fall in estimated glomerular filtration rate after treatment for primary aldosteronism and long-term decline in renal function[J]. Hypertension,2019,74(3):630-638. DOI:10.1161/HYPERTENSIONAHA.119.13131.
LIN X,ULLAH M H E,WU X,et al. Cerebro-cardiovascular risk,target organ damage,and treatment outcomes in primary aldosteronism[J]. Front Cardiovasc Med,2021,8:798364. DOI:10.3389/fcvm.2021.798364.
GENNARI F J. Hypokalemia[J]. N Engl J Med,1998,339(7):451-458. DOI:10.1056/nejm199808133390707.
K?PERS E M,AMAR L,RAYNAUD A,et al. A clinical prediction score to diagnose unilateral primary aldosteronism[J]. J Clin Endocrinol Metab,2012,97(10):3530-3537. DOI:10.1210/jc.2012-1917.
ZHANG Y,NIU W Q,ZHENG F F,et al. Identifying unilateral disease in Chinese patients with primary aldosteronism by using a modified prediction score[J]. J Hypertens,2017,35(12):2486-2492. DOI:10.1097/HJH.0000000000001488.
- 中國全科醫(yī)學(xué)的其它文章
- 基于文獻(xiàn)計(jì)量分析的我國異地就醫(yī)研究現(xiàn)狀與展望
- 成人血清骨鈣素水平與非酒精性脂肪性肝病發(fā)生風(fēng)險(xiǎn)的Meta分析
- 音樂治療對(duì)阿爾茨海默病患者干預(yù)效果的Meta分析
- 活血通絡(luò)法對(duì)激素性股骨頭壞死囊性變患者血清骨吸收/成血管/成骨蛋白調(diào)節(jié)作用的研究
- 左慈丸的化學(xué)成分及治療圍絕經(jīng)期聽力損失的作用機(jī)制研究:基于網(wǎng)絡(luò)藥理學(xué)與分子對(duì)接技術(shù)
- 調(diào)中益氣湯治療老年氣虛型慢傳輸便秘的療效研究

