蘿卜絲核菌根腐病病原鑒定及其對殺菌劑的敏感性
楊利娟 高葦 李海燕 薛濤 張春祥 霍建飛 王勇
摘要 為明確蘿卜絲核菌根腐病的病原種類及篩選防治絲核菌根腐病的有效殺菌劑,基于形態學、致病性測定和rDNA-ITS的序列分析,明確天津地區的蘿卜絲核菌根腐病的病原為立枯絲核菌(Rhizoctonia solani),屬于融合群AG-2-1。采用菌絲生長速率法評價病原對5種殺菌劑的敏感性,結果表明:病原對咯菌腈、吡唑醚菌酯、氟啶胺和噻呋酰胺均具有較高的敏感性,EC為0.018 1~0.996 6 μg/mL,可作為生產上防治蘿卜絲核菌根腐病的候選藥劑使用;而病原對咪鮮胺的敏感性較差,EC為10.882 8 μg/mL,在生產上不推薦使用。
關鍵詞 蘿卜根腐病;絲核菌;殺菌劑
中圖分類號 S436.3 文獻標識碼 A
文章編號 0517-6611(2024)02-0117-04
doi:10.3969/j.issn.0517-6611.2024.02.025
開放科學(資源服務)標識碼(OSID):
Identification of Rhizoctonia Species Causing Radish Root Rot and Pathogen Sensitivity to Fungicides
YANG Li-juan,GAO Wei,LI Hai-yan et al
(1.Institute of Plant Protection,Tianjin Academy of Agricultural Sciences,Tianjin 300192; 2.Tianjin Agricultural Development Service Center,Tianjin 300061)
Abstract This study aims to identify the Rhizoctonia species causing radish root rot and select efficient fungicides for controlling this disease.The pathogen of the diseased samples from Tianjin was isolated and identified as Rhizoctonia solani AG-2-1 based on morphology,pathogenicity test,and rDNA-ITS sequence analysis.The sensitivity of Rhizoctonia solani AG-2-1 to 5 fungicides was conducted by mycelial growth rate method.The results indicated Rhizoctonia solani AG-2-1 was sensitive to fludioxonil,pyraclostrobin,fluazinam and thifluzamide with EC of 0.018 1-0.996 6 μg/mL,and these four fungicides can be used as candidate agents to control radish root rot in production;while Rhizoctonia solani AG-2-1 was poorly sensitive to prochloraz with EC of 10.882 8 μg/mL and prochloraz was not recommend in radish production.
Key words Radish root rot;Rhizoctonia;Fungicides
基金項目 天津市農業科學院財政種業創新研究項目(2022ZYCX017)。
作者簡介 楊利娟(1988—),女,河南信陽人,助理研究員,博士,從事種苗病害檢測及處理技術研究。*通信作者,研究員,碩士,從事植物病理學研究。
收稿日期 2023-02-03
蘿卜(Raphanus sativus L.)是一種十字花科蘿卜屬植物,在我國各地廣泛栽培,兼具營養價值和藥用價值,在我國民間有“小人參”的美稱。近年來,受連作等栽培模式的影響,設施蘿卜根部土傳病害頻繁發生,嚴重影響蘿卜的產量和品質。已報道的蘿卜根部腐爛病的致病菌主要有野油菜黃單胞桿菌致病變種(Xanthomonas campestris pv.campestris)、胡蘿卜軟腐歐氏桿菌軟腐病亞種(Erwinia carotovora subsp.carotovora)、鐮刀菌(Fusarium sp.)、大麗輪枝菌(Verticillium dahliae)、絲核菌(Rhizoctonia sp.)等。其中,由絲核菌引起的蘿卜根腐病是影響蘿卜生產的重要病害之一,嚴重威脅蘿卜的生產。絲核菌是一類形態變異很大的復合種,在地理位置、形態、寄主特性和致病性方面存在多樣性,加重了該病害的防治難度。不同融合型的絲核菌具有優勢寄主的特點,如AG-1主要侵染水稻和玉米引起紋枯病;AG-3PT侵染馬鈴薯塊根,造成黑痣病;AG-4 HGI侵染甘藍根部,造成黑根病;AG2-1侵染甘藍近地面菜幫,造成葉柄基部腐爛,進而導致立枯或猝倒,或者侵染包菜葉片,造成葉腐病或球腐病。目前國內對蘿卜絲核菌根腐病的研究比較有限,王朵報道了引起北京蘿卜根腐病的絲核菌種類為融合群AG-2-1,天津地區引起蘿卜根腐病的絲核菌種類未知,在防治中缺乏登記藥劑,而專門針對引起蘿卜根腐病的絲核菌進行殺菌劑的活性測定鮮有報道。鑒對此,筆者對天津地區蘿卜絲核菌根腐病病原進行了分離和鑒定,并測定了致病病原對5種殺菌劑的敏感性,旨在為蘿卜絲核菌根腐病的有效防治提供科學依據和指導。
1 材料與方法
1.1 病樣來源
2020年從天津市寶坻區蘿卜種植棚采集蘿卜根腐病病樣。
1.2 供試藥劑
98%氟啶胺原藥,河北興柏農業科技有限公司;98%咯菌腈原藥,上海禾本藥業股份有限公司;98%吡唑醚菌酯原藥,江蘇禾裕泰化學有限公司;95%咪鮮胺,美國富美實公司;96%噻呋酰胺原藥,浙江禾本科技股份有限公司。
1.3 試驗方法
1.3.1 病原分離與純化。
在蘿卜病樣組織的病健交界處,切取3 mm×3 mm的組織塊,放入盛有75%乙醇培養皿中消毒30 s,然后用滅菌蒸餾水漂洗3次,每次30 s,再放置于干凈塑料皿中晾干,并將晾干的病組織轉移至PDA平板(含50 μg/mL硫酸鏈霉素),于25 ℃恒溫培養箱中黑暗培養3 d。當病組織塊周圍長出菌絲后,用滅菌牙簽在其邊緣挑取菌絲至新的PDA中純化培養。
1.3.2 病原形態學鑒定。
將純化得到的菌株接種到PDA培養基上,在25 ℃培養3 d,于菌落邊緣打取直徑5 mm的菌餅,置于直徑9 cm PDA培養基平板上,25 ℃暗培養,觀察并記錄菌落顏色,以及有無菌核產生等培養性狀,十字交叉法逐日測量菌落直徑。
1.3.3 病原致病性測定。
按照Koch’s法則進行病原致病性測定。將純化得到的菌株接種到PDA培養基上,25 ℃培養3 d,于菌落邊緣打取直徑5 mm的菌餅,并將菌餅接種到健康的蘿卜肉質根橫切面上,置于25 ℃、相對濕度75%條件下培養,觀察蘿卜肉質根上根腐病的發生情況,并從接種發病的蘿卜肉質根再次分離鑒定致病菌株。
1.3.4 分子生物學鑒定及系統發育樹構建。
用無菌牙簽在菌落邊緣挑取少量菌絲,采用TSINGKE TSE011 T5 Direct PCR Kit (Plant)提取基因組DNA,采用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTC CGCTTATTGATATGC-3′)進行ITS序列的PCR擴增,將擴增獲得的產物送至北京擎科生物科技有限公司進行測序,并將所得序列與NCBI數據庫進行BLAST序列比對分析。參考絲核菌各融合群序列,以羅爾阿太菌Athelia rolfsii(AY684917)為外群,用MEGA 5.2以最大似然法(maximum likelihood method)構建系統發育樹,Bootstrap設為1 000。
1.3.5 病原對殺菌劑的敏感性測定。
選擇代表性菌株進行采用菌絲生長速率法評價病原對供試殺菌劑的敏感性,分別稱取50 mg(有效成分量)原藥,加入5 mL DMSO 溶解原藥,得到濃度為10 μg/mL工作液,然后將各藥劑分別加入馬鈴薯葡萄糖瓊脂(PDA)培養基中制成含藥PDA培養基。供試藥劑在PDA培養基中的終濃度為0、0.01、0.05、0.25、1.25、6.25和31.25 μg/mL,其中含吡唑醚菌酯的處理中均加入50 μg/mL水楊基羥肟酸,設置不含藥劑的處理為空白對照,每個處理重復3次。將培養好的病菌菌餅接種到上述含藥PDA上,置于25 ℃霉菌培養箱中培養3 d,采用十字交叉法測定菌落直徑,使用DPS 7.05軟件計算藥劑的抑制終濃度(EC值)。
2 結果與分析
2.1 病原形態學鑒定
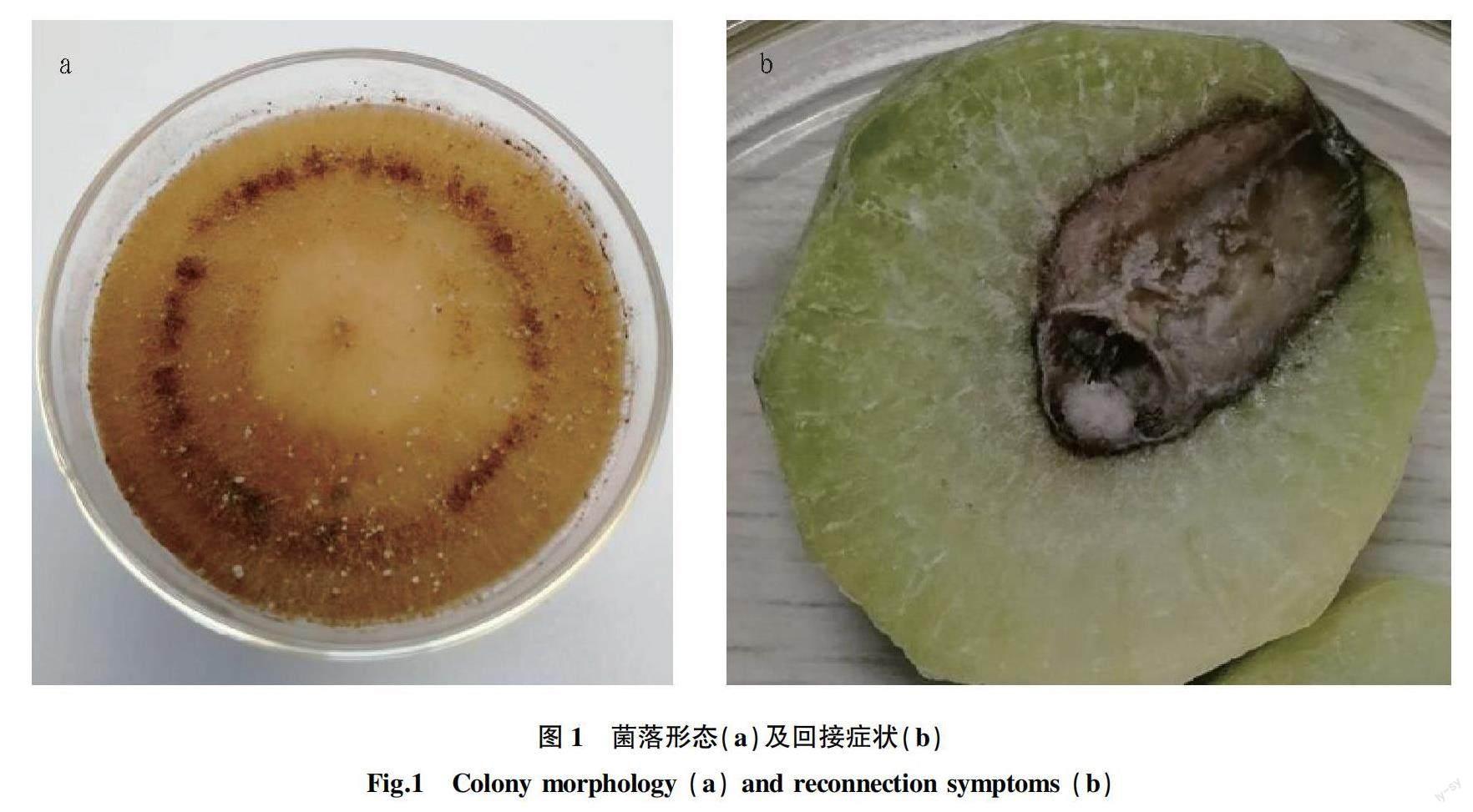
從采集的蘿卜根腐病組織中分離獲得4株菌株,編號為RS1、RS2、RS3和RS4,均為絲狀真菌。病原在PDA上呈輻射狀生長,菌落較疏松,菌絲為褐色,棉絮狀,表面粗糙,顯微鏡下觀察發現菌絲呈直角或近直角分枝,分支處縊縮,近分支處有隔膜,符合絲核菌屬的特征。菌絲生長快,平均生長速率為31 mm/d,隨著生長的進行菌絲開始交織顏色變深,培養4 d形成深褐色菌核(圖1a)。
2.2 病原致病力鑒定
病原接種3 d后,在接種處蘿卜組織開始變黑,接種6 d后,接種處進一步變黑,凹陷,并長出白色菌絲(圖1b),與田間癥狀一致,從接種處發病部位分離的菌株與接種菌株的菌落特征相同,而接種無菌水的對照未見任何癥狀。
2.3 分子生物學分析
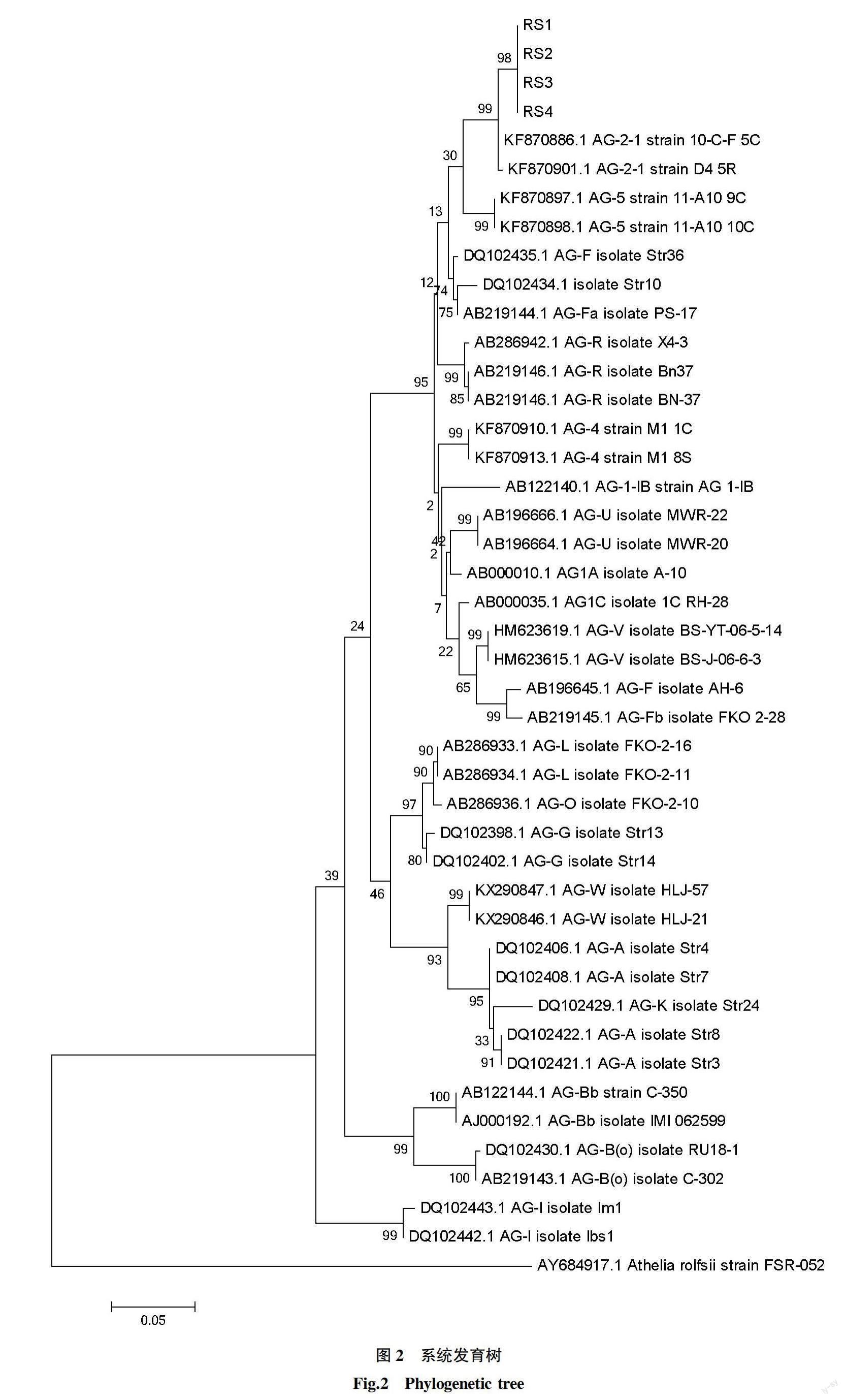
將測序結果與NCBI數據庫中序列進行BLAST比對分析,發現4株分離菌株RS1、RS2、RS3和RS4與立枯絲核菌(Rhizoctonia solani)相似性均為99%。系統發育樹顯示,4個菌株與Rhizoctonia solani AG-2-1聚為1支,支持率為99%(圖2)。結合形態學特征和分子生物學鑒定結果,明確蘿卜絲核菌根腐病病原為立枯絲核菌(Rhizoctonia solani),屬于融合群AG-2-1。
2.4 病原對供試藥劑的敏感性分析
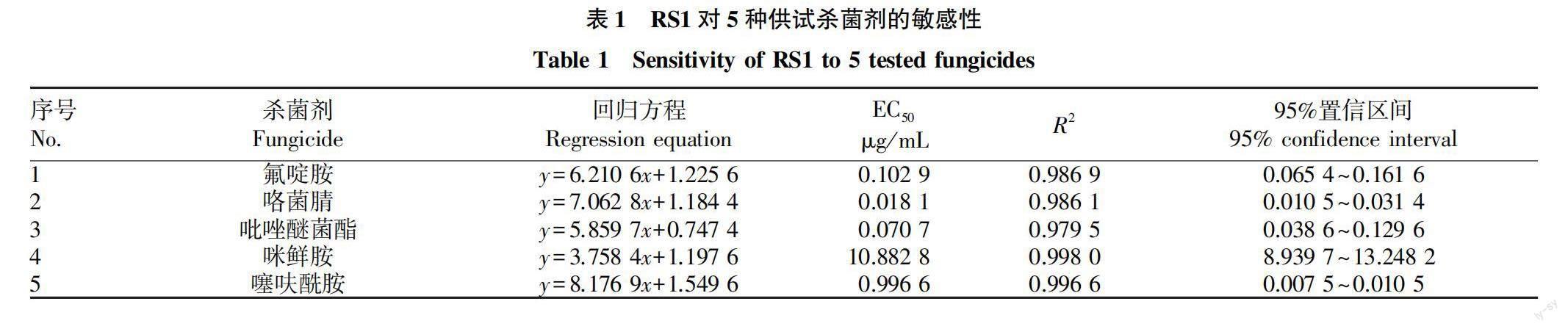
由表1可知,RS1對5種供試殺菌劑有不同程度的敏感性,其中RS1對咯菌腈和吡唑醚菌酯敏感性高,EC分別為0.018 1和0.070 7 μg/mL;其次是氟啶胺和噻呋酰胺,EC分別為0.102 9和0.996 6 μg/mL;RS1對咪鮮胺的敏感性最差,EC達到10.882 8 μg/mL。
3 結論與討論
該研究結果表明,分離自天津市寶坻區的蘿卜根腐病的絲狀真菌病原,經過形態觀察、致病性測定和rDNA-ITS序列分析,明確病原為立枯絲核菌(Rhizoctonia solani),屬于融合群AG-2-1,這與王朵的研究結果一致。國內外研究表明,AG-2-1是侵染蘿卜等十字花科蔬菜的絲核菌的優勢融合群,是十字花科蔬菜主要致病因子之一。此外,Tsai等研究報道了AG-4和AG-4 HGI可侵染蘿卜引起猝倒病。該研究鑒定出天津地區蘿卜絲核菌根腐病的病原為AG-2-1,其他蘿卜產區是否存在絲核菌的其他種類以及融合群還有待進一步檢測和研究。
AG-2-1除了對蘿卜等十字花科蔬菜根和葉有致病性外,對葫蘆科、茄科、藜科、豆科、菊科多種寄主根或葉有不同程度的致病性,加之絲核菌是一類土壤習居真菌,在自然界廣泛存在,因此篩選防治絲核菌根腐病的有效殺菌劑對蘿卜生產具有重要意義。該研究中AG-2-1對5種殺菌劑均有不同程度的敏感性,敏感性大小表現為咯菌腈>吡唑醚菌酯>氟啶胺>噻呋酰胺>咪鮮胺,其中咯菌腈、吡唑醚菌酯、氟啶胺和噻呋酰胺的EC值在0.018 1~0.996 6 μg/mL,可作為生產上防治蘿卜絲核菌根腐病的候選藥劑使用;咪鮮胺的EC為10.882 8 μg/mL,可能是天津地區蘿卜根腐病菌AG-2-1對咪鮮胺存在一定抗性,在生產上不推薦使用。該研究只進行了室內生物活性測定,可以為田間防治提供理論基礎,今后仍需要進一步開展田間藥劑驗證試驗,以確定其科學使用技術,保障蘿卜的安全生產。
參考文獻
[1]孫久偉.施魯西復合肥,助農蘿卜獲豐收[J].中國農資,2017(49):21.
[2]孟雪嬌,馮一新,徐健,等.蘿卜黑腐病研究進展[J].長江蔬菜,2022(10):33-36.
[3]吳仁鋒,楊紹麗,蔡翔,等.蘿卜軟腐病的識別與防治[J].長江蔬菜,2021(7):47-48.
[4]李盼亮.我國蔬菜根部病原鐮孢菌鑒定和新病害發現[D].北京:中國農業科學院,2017.
[5]閆文雪.我國三種蔬菜鐮孢菌專化型的鑒定及新病害的發現[D].北京:中國農業科學院,2019.
[6]王朵.十字花科蔬菜絲核菌根腐病的病原生物學及檢測技術研究[D].北京:中國農業科學院,2020.
[7]ANDERSON N A.The genetics and pathology of Rhizoctonia solani[J].Annual review of phytopathology,1982,20:329-347.
[8]SNEH B,JABAJI-HARE S,NEATE S,et al.Rhizoctonia species:Taxonomy,molecular biology,ecology,pathology and disease control[M].Dordrecht:Springer Netherlands,1996.
[9]段海明,余利,申仕惠,等.玉米紋枯病菌Rhizoctonia solani拮抗菌gfj-4的鑒定及其發酵上清液抑菌特性[J].浙江農業學報,2018,30(1):106-116.
[10]張俊華,沃三超,楊明秀,等.東北地區水稻紋枯病菌致病性及遺傳多樣性分析[J].東北農業大學學報,2019,50(11):1-10.
[11]WOODHALL J W,ADAMS I P,PETERS J C,et al.A new quantitative real-time PCR assay for Rhizoctonia solani AG3-PT and the detection of AGs of Rhizoctonia solani associated with potato in soil and tuber samples in Great Britain[J].European journal of plant pathology,2013,136(2):273-280.
[12]鮮澤軒.哈爾濱地區甘藍黑根病病原菌鑒定及抗源篩選[D].哈爾濱:東北農業大學,2020.
[13]李華榮,黃險峰.溫度、pH對甘藍底腐病菌(Rhizoctionia solani AG-2-1)生長發育影響的研究[J].云南農業大學學報(自然科學版),1993,8(8):293-294.
[14]張麗.包菜立枯絲核菌球腐病的病原學研究[D].武漢:華中農業大學,2008.
[15]BABIKER E M,HULBERT S H,SCHROEDER K L,et al.Evaluation of Brassica species for resistance to Rhizoctonia solani and binucleate Rhizoctonia (Ceratobasidum spp.) under controlled environment conditions[J].European journal of plant pathology,2013,136(4):763-772.
[16]JAYAWEERA D P,BEECH D J,TAIT M,et al.Yield loss and control of soil-borne Rhizoctonia solani AG2-1 in oilseed rape[J].Aspects of applied biology,2018,141:19-22.
[17]TSAI Y N,LIN M J,KO W H.A simple method for production of uniform inoculum of Rhizoctonia solani with strong pathogenicity[J].Biocatalysis & agricultural biotechnology,2012,1(1):85-88.
[18]MOUSSA T A A,KHALIL M S,GOMAA N M,et al.Biodiversity of Rhizoctonia solani AG3 and AG2-1 associated with potato diseases[J].Life science journal,2014,11(8):407-417.

