仿刺參南移養殖溫度耐受性相關基因的差異表達分析
朱志煌,林 琪,吳建紹,楊求華
(福建省水產研究所,福建省海洋生物增養殖與高值化利用重點實驗室,福建 廈門 361013)
仿刺參(Apostichopusjaponicus)是棘皮動物門海參綱刺參科動物的統稱,具有較高的營養、藥用和經濟價值。仿刺參屬于溫帶種類,自然分布區域北起俄羅斯遠東地區,經朝鮮、韓國、日本,南至中國北部,雖然在福建的自然海區無分布,但其所具有的巨大經濟價值推動該品種養殖業從北往南擴張[1]。自2005年以來,福建省從遼寧等地引進仿刺參,并大力開展“北參南養”實驗。2022年福建海參產量達到45 636t,占全國總產量的18.36%,穩居全國第三位。
仿刺參為淺海底棲生物。水溫是影響仿刺參生長、生理性能和免疫反應等功能的重要環境因素,并且在水溫升高到一定范圍后,其立即進入攝食停止、活動減少的“夏眠”狀態。福建地區夏季的高溫會導致養殖仿刺參發生大規模死亡,這給養殖業造成巨大的損失。目前,缺乏仿刺參耐高溫良種是制約該產業進一步發展的重要因素。選擇育種是獲得水生動物新品系的重要方法[2-4]。研究證明,熱脅迫刺激能夠一定程度地提高動物耐高溫的能力[5-7]。熱休克蛋白(Heat shock proteins,HSPs)和小熱休克蛋白(Small heat shock proteins,sHSPs)作為細胞內的分子伴侶,能夠防止蛋白質在細胞內聚集,提高細胞的耐熱能力[8-13]。以往研究表明,HSPs是誘導耐熱的主要介質,其表達模式與生物體的耐熱水平直接相關[14-18]。此外,致死必需蛋白 [Protein lethal (2)essential for life,Protein l(2)efl]基因也是一種小熱休克蛋白的同源基因,其表現出與sHSPs類似的功能,主要與生物的耐熱能力有關,并在一定程度上保護細胞免于凋亡。HSP26、gp96、HSP70、HSP90a和proteinl(2)efl基因均屬于熱休克蛋白家族的成員,其表達的水平可用于評估高溫誘導下仿刺參的熱耐受力。
目前,國內外對北方仿刺參的研究較為系統,眾多學者在組織形態學、生態學、生理學、免疫學及分子生物學等方面展開大量研究并取得了豐碩的研究成果[19-22]。有研究指出,在高溫脅迫下,仿刺參的HSP70、proteinl(2)efl、HSP90和HSP26等熱休克蛋白基因的表達量會上調[23-24]。針對北方仿刺參夏眠前、后展開轉錄組測序的分析研究,發現溫度波動會對其熱休克蛋白的表達產生顯著的影響[25]。還有研究表明,仿刺參的耐熱性是可塑的,預先的熱沖擊實驗能夠提高其耐熱能力[26-27]。因此,將北方仿刺參轉移到南方來進行養殖適應,能在一定程度上提高其耐熱性能。
本研究從山東青島購入仿刺參幼苗,將其飼養于溫度較高的福建漳州戶外淺池塘中,使其經歷長期的高溫海水刺激,以此作為南移福建養殖的仿刺參實驗組,并以北方相同苗齡的仿刺參作為對照組,比較兩組間的抗熱性能,以期為仿刺參耐高溫品系的培育提供理論參考。
在道路橋梁路線設計階段,設計單位應該綜合自身掌握的地形地質條件、周邊自然環境資料等對工程投入運營后可能會出現的問題進行分析預測,在此基礎上制定科學合理的維護養護和檢測維護計劃,促進道路橋梁工程使用壽命的提升。
1 材料與方法
1.1 實驗動物和馴化
2016年冬季從山東省青島市即墨養殖場(36°30′43.5″N、120°50′59.0″E)購買仿刺參幼苗,并將其分至兩地養殖,一部分放在原養殖場養殖,另一部分轉移到福建省漳州市東山養殖場室外飼養淺池塘進行養殖(23°34′34.1″N、117°23′28.8″E),兩地養殖的仿刺參均在自然光周期和水溫下飼養一年。海水經砂濾過濾,鹽度約為30,以流水模式進行養殖。仿刺參幼苗每天投喂飼料一次,每次喂足人工海參飼料(金派生物,中國威海),并定期對池塘吸污。同時,每天記錄水溫情況,每月測定仿刺參幼苗的生長情況。2017年冬季,分別將青島市即墨養殖場和漳州市東山養殖場養殖的仿刺參運至廈門市進行實驗,此時仿刺參均為20月齡(600日齡)。為了方便后續區分,將兩地運回的仿刺參分別簡易命名為青島本地群體(Qingdao local sea cucumber populations,Qls)和南方養殖群體(South aquaculture sea cucumbers populations,Sas)。實驗開始前,將兩地運來的仿刺參分別移入溫度為16 °C的養殖水槽中,暫養14 d,每天換掉1/3~1/2的等溫海水,其他飼養條件均相同。
1.2 實驗設計
1.2.1 仿刺參溫度耐受范圍實驗
為研究給定處理時間的仿刺參溫度耐受范圍,急性溫度實驗設計的刺激溫度超過仿刺參養殖過程中海水的自然溫度。將不同仿刺參群體分別放入預先調好海水溫度的40 L透明塑料桶,每個塑料桶放入10頭仿刺參,每個實驗溫度設置3個重復。將兩個群體的仿刺參分別同時放入水溫為28、29、30、31、32、33、34 °C的塑料桶中,經過2 h的溫度刺激后,轉移至16 °C養殖水槽中暫養7 d,觀察記錄其存活情況,以確定兩個仿刺參群體的亞致死溫度、致死溫度和半致死溫度。實驗水溫由溫控器控制調節,實驗期間每2 min用精度為±0.2 °C的水銀溫度計監測水溫情況。在實驗期間,仿刺參的飼養條件與馴化期間相似。
1.2.2 仿刺參溫度耐受性相關基因的差異表達實驗
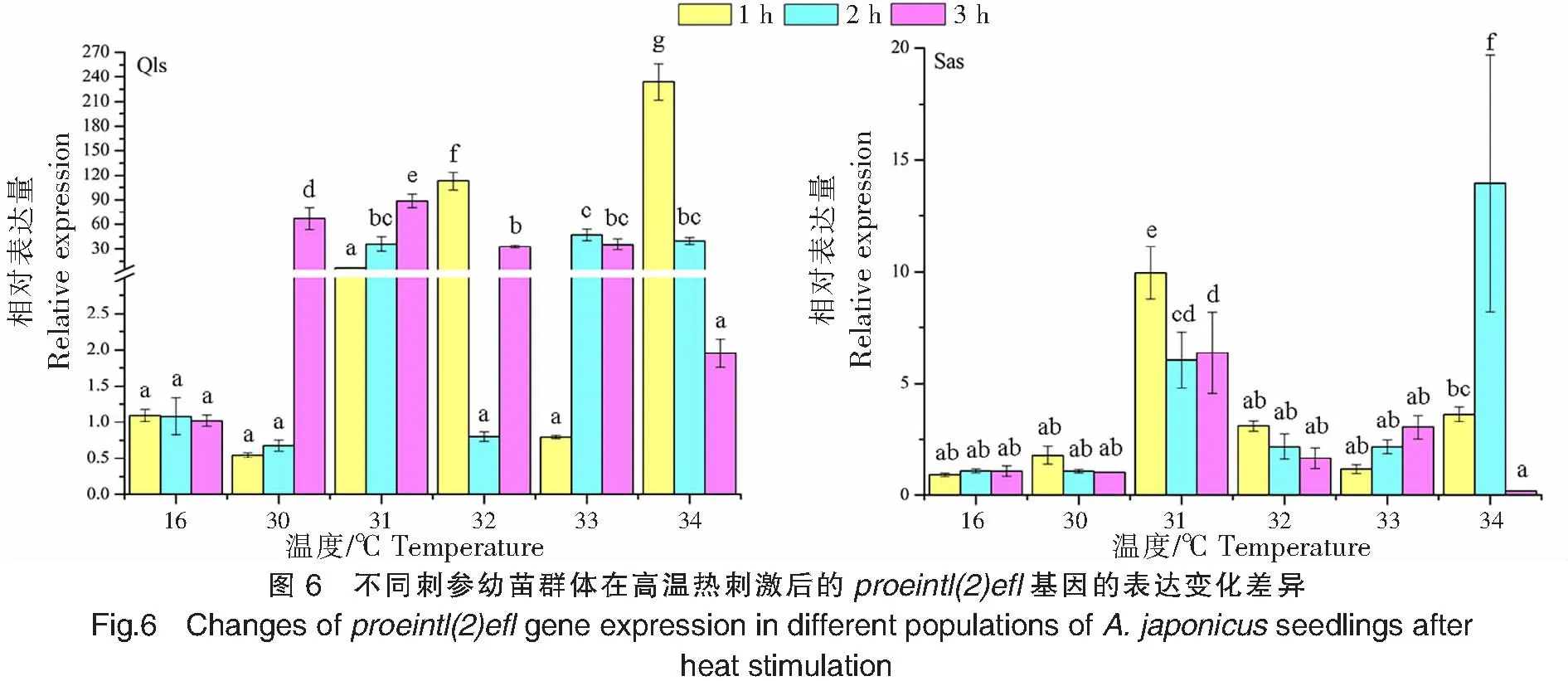
不同刺參幼苗群體在高溫熱刺激后的proeintl(2)efl基因的表達變化差異如圖6所示。青島本地群體經過30、31 ℃的高溫刺激后,proeintl(2)efl基因的表達量峰值出現在3 h處,分別為(67.230±13.512)、(88.897±8.242);在32、34 ℃高溫刺激下,proeintl(2)efl基因的表達量峰值均出現在1 h處,表達量的最高值出現在34 ℃刺激1 h處(234.167±22.130);而在33 ℃高溫刺激下,proeintl(2)efl基因的表達量峰值出現在高溫刺激2 h處。南方養殖群體經過30、31、32℃高溫刺激后,proeintl(2)efl基因的表達峰值均出現在1 h處;而33、34 ℃高溫刺激下,proeintl(2)efl基因的表達量峰值則分別出現在3、2 h處,表達量的最高值出現在34 ℃刺激2 h處(13.948±5.740)。青島本地群體在高溫刺激1、2、3 h后,proeintl(2)efl基因的表達峰值分別出現在34、33、31 ℃;而南方養殖群體則分別出現在31、34、31℃。
1.3 RNA提取和cDNA的合成
將整頭仿刺參置于裝有液氮的研缽中碾碎。取約80 mg樣品,放入1 mL Trizol試劑(Qiagen)中進行勻漿,再使用 Invitrogen 公司的 Trizol 試劑盒,按照說明書提取樣本組織的總RNA。利用QuantScript RT Kit,按照說明書合成cDNA,提取的樣品保存在-80 ℃冰箱中,備用待測。
1.4 引物設計和熒光定量實驗
根據NCBI(http://www.ncbi.nlm.nih.gov/Genbank/)網站上已公布的HSP90a、HSP26、HSP70、gp96和proeintl(2)efl基因為模板設計熒光定量引物(表1)。采用熒光定量 PCR的方法,檢測5個溫度耐受性相關基因在溫度刺激后的不同仿刺參幼苗群體中的表達情況。以β-actin的表達量為標準值,將對照組和實驗組個體在不同時間點的表達量進行校正,以消除不同個體對實驗結果的影響[26-27]。再將這些校正后的表達量與對照組(16 °C)進行比較,分析各基因在對照組和實驗組中的倍數變化,從而發現基因在高溫刺激后的表達規律。熒光定量PCR的反應條件為95 ℃預變性10 s、40個循環中95 ℃變性5 s、60 ℃退火34 s。
繪畫審美上,中國畫追求詩意的傳達。蘇軾認為王維“詩中有畫,畫中有詩”,這從本質上體現出詩意精神是中國畫的內在特質之一。清代畫家惲南田追求簡淡清遠的審美意趣,體現在繪畫上就是“畫以簡貴為尚,簡之入微,則洗盡塵滓,獨存孤迥,煙鬟翠黛斂容而退矣。”[12]畫家的審美意趣會在繪畫中有充分的展現。所以,在中國畫教學上,應注重培養學生的審美境界,提升其繪畫的追求品味。
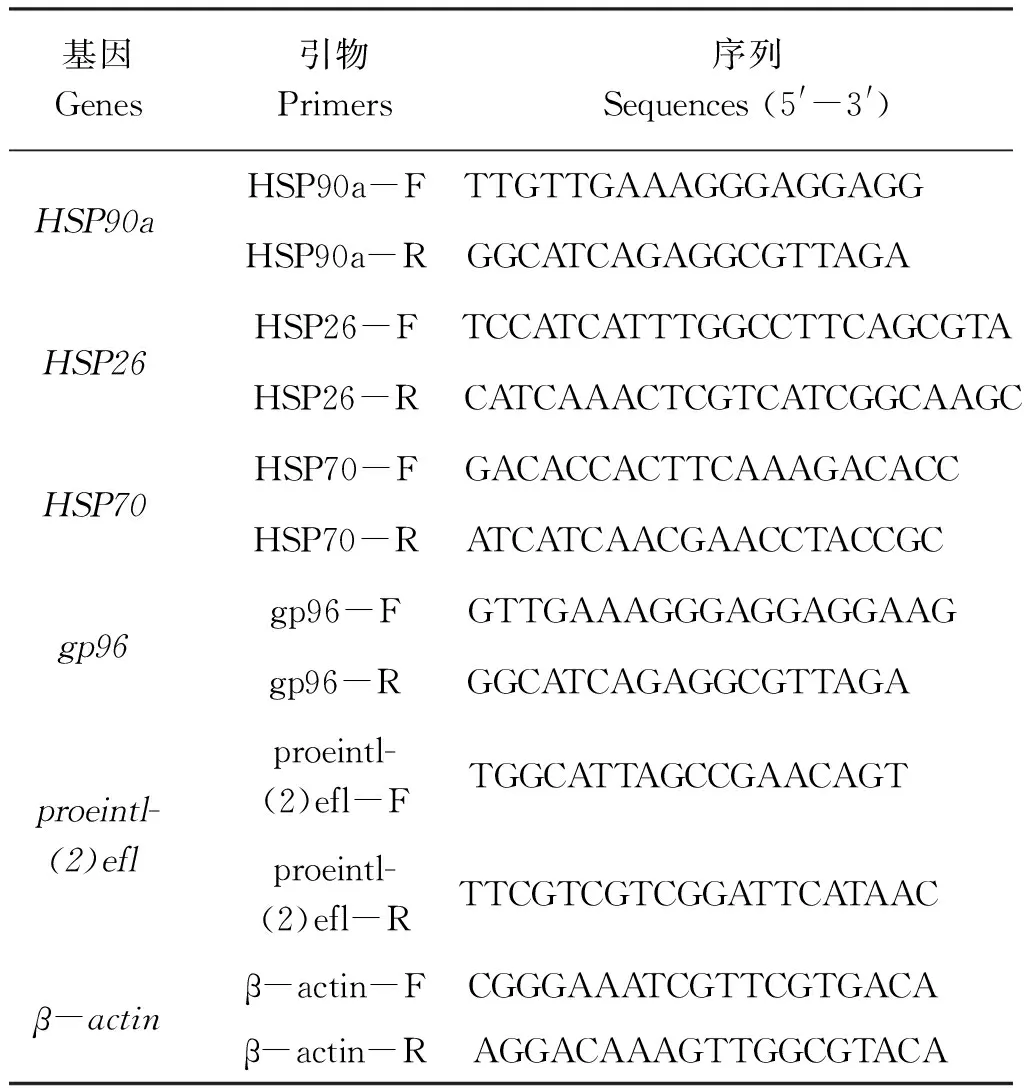
表1 本研究中所使用的引物Tab.1 The primer used in the study
1.5 統計學分析
實驗數據采用SPSS 21.0軟件進行統計分析,采用單因素方差分析(One-way ANOVA),以最小顯著極差法(LSD)比較數據間的顯著性[28-29]。數據結果以平均值±標準差表示,P<0.05為差異顯著。半致死溫度通過SPSS 21.0軟件中的概率單位 (Probit)回歸法[30-32]計算得出。
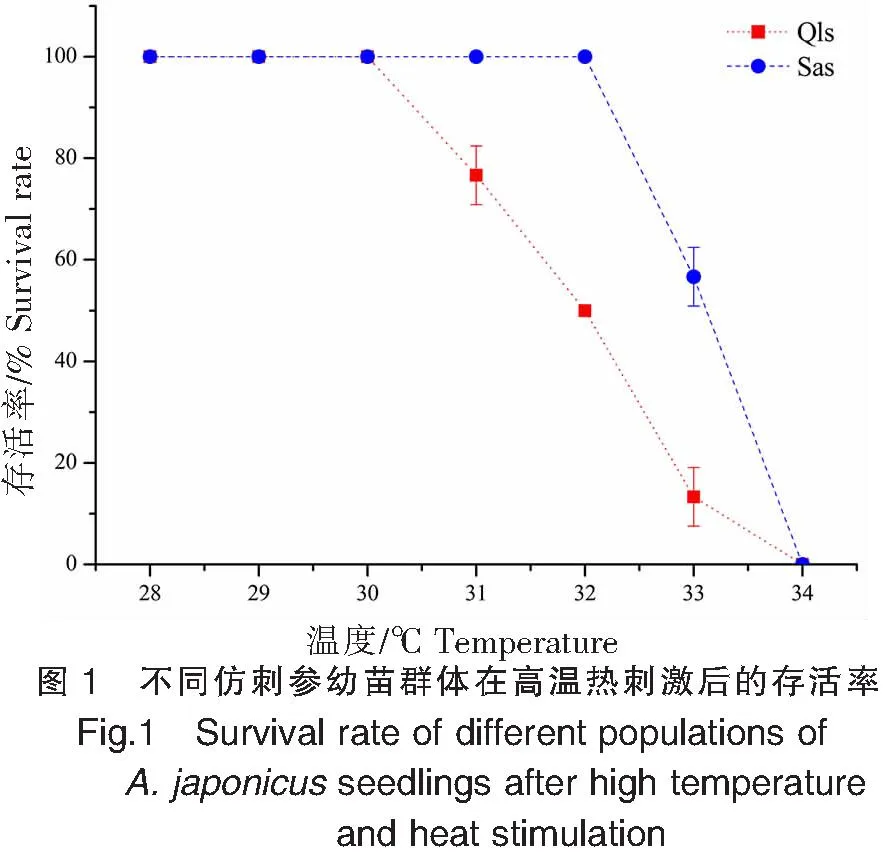
青島本地群體和南方養殖群體在高溫刺激后的存活率如圖1所示。青島本地群體在28~30 ℃高溫刺激2 h后均沒有出現死亡,而南方養殖群體在28~32 ℃高溫刺激2 h后沒有出現死亡,但兩個群體在經過34 ℃高溫刺激2 h后均全部死亡。在31~33 ℃高溫刺激組中,南方養殖群體的存活率均高于青島本地群體,其中青島本地群體在31、32、33 ℃溫度下刺激2 h后的存活率分別為76.7%±5.8%、50.0%±0.0%、13.3%±5.8%,而南方養殖群體分別為100.0%±0.0%、100.0%±0.0%、56.7%±5.8%,兩個群體的存活率差異顯著(P<0.05)。因此,高溫刺激2 h后,青島本地群體和南方養殖群體的亞致死溫度分別為30、32 ℃,半致死溫度(ULTs50)分別為31.9 ℃ (31.4~32.4 ℃)和33.1 ℃ (32.6~33.5 ℃),兩個群體的致死溫度均為34 ℃(圖1)。
2 結果與分析
2.1 不同仿刺參幼苗群體的溫度耐受性
因此,雖然中國專利法的第69條(一)條款在文義解釋上能夠支持這種區別適用者的理論,但這種解釋會導致該條的目的落空,不應該固執地堅持。
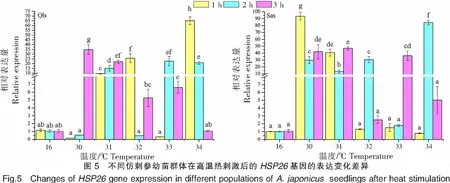
不同仿刺參幼苗群體在高溫熱刺激后的HSP26基因的表達變化差異如圖5所示。青島本地群體經過30 ℃高溫刺激,HSP26基因的表達量在1 h處出現明顯的降低,然后在2 h處繼續降低,但在3 h處達到峰值(34.787±4.978);在31 ℃高溫刺激下,HSP26基因的表達量在1 h處出現顯著上升,之后隨著刺激時間的延長而繼續上調;在32 ℃高溫刺激下,HSP26基因的表達量在1 h處達到高峰,在2 h處降低到正常水平,之后在3 h處又出現升高;在33 ℃高溫刺激下,HSP26基因的表達量在1 h處出現顯著下調,之后在2 h處出現大幅增加并達到峰值,之后在3 h處出現迅速降低;在34 ℃高溫刺激下,HSP26基因的表達量在1 h處迅速上調并達到該群體表達量的最高值(65.127±4.054),之后逐漸降低到正常水平。南方養殖群體的HSP26基因的表達量在30、31 ℃高溫刺激下出現顯著的上調,但是表達量峰值不同,最高值出現在30 ℃刺激1 h處,為(93.710±5.674);在33 ℃高溫刺激下,HSP26基因的表達量隨著刺激時間的延長而增加,在3 h處出現表達量峰值;HSP26基因的表達在32、34 ℃高溫刺激下的表達模式相近,即高溫刺激1 h處的表達沒有顯著差異,而在2 h處的表達量出現快速上調并達到最高峰,之后恢復正常水平。青島本地群體在高溫刺激1、2、3 h后,HSP26基因的表達峰值分別出現在34、33、30 ℃;而南方養殖群體則分別出現在30、34、31 ℃。
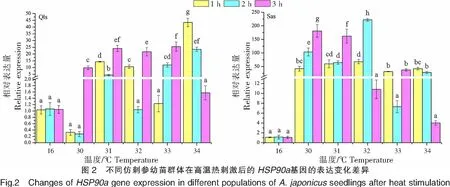
2.2 HSP90a基因的表達情況
不同仿刺參幼苗群體在高溫熱刺激后的HSP90a基因的表達變化差異如圖2所示。青島本地群體經30、31、32、33 ℃高溫刺激后,HSP90a基因的表達量峰值出現在溫度刺激3 h處,分別為(9.801±1.303)、(24.133±2.232)、(21.683±3.082)、(25.473±3.402);而在34 ℃高溫刺激后,HSP90a基因的表達量高峰發生在1 h處,此時達到青島本地群體表達量的最高值(43.367±3.137),隨后表達量隨著溫度刺激時間的延遲而出現降低。南方養殖群體經30 ℃高溫刺激1 h后,HSP90a基因的表達量已達到(42.000±8.798);在30、31、33 ℃高溫刺激下,HSP90a基因的表達峰值出現在溫度刺激3 h處,而32 ℃高溫刺激的最高表達值出現在2 h,此時達到南方養殖群體表達量的最高值(222.150±4.980)。在34 ℃的高溫刺激下,南方養殖群體和青島本地群體的表達模式相近,HSP90a基因的表達高峰均發生在1 h處。青島本地群體在高溫刺激1、2、3 h后,HSP90a基因的表達峰值分別出現在34、34、33 ℃;而南方養殖群體則分別出現在32、32、30 ℃。
注:標有不同小寫字母表示差異顯著(P<0.05),標有相同小寫字母表示差異不顯著(P>0.05)。以下同此。Notes:Different lowercase letters indicated significant difference (P<0.05),while the same lowercase letter meant no significant difference (P>0.05).The same as below.
2.3 gp96基因的表達情況
不同仿刺參幼苗群體在高溫熱刺激后的gp96基因的表達變化差異如圖3所示。青島本地群體在30 ℃高溫刺激下1、2 h處,gp96基因的表達量顯著低于對照組(16 ℃),而在刺激3 h后,表達量才上調并達到峰值(2.508±0.910);在31 ℃高溫刺激下,gp96基因的表達量在1、2、3 h處均出現顯著上調,并在3 h處出現表達量峰值;在32 ℃高溫刺激下,gp96基因的表達量在溫度刺激1 h后出現大幅增加,并達到峰值,隨后在2、3 h處表達量分別出現明顯的下調和上調;在33 ℃高溫刺激下,gp96基因的表達量隨著高溫刺激時間的延長而增加,在3 h處表達量達到青島本地群體的最高值(353.833±21.586);在34 ℃高溫刺激下,gp96基因的表達量隨著溫度刺激時間的延長而降低。
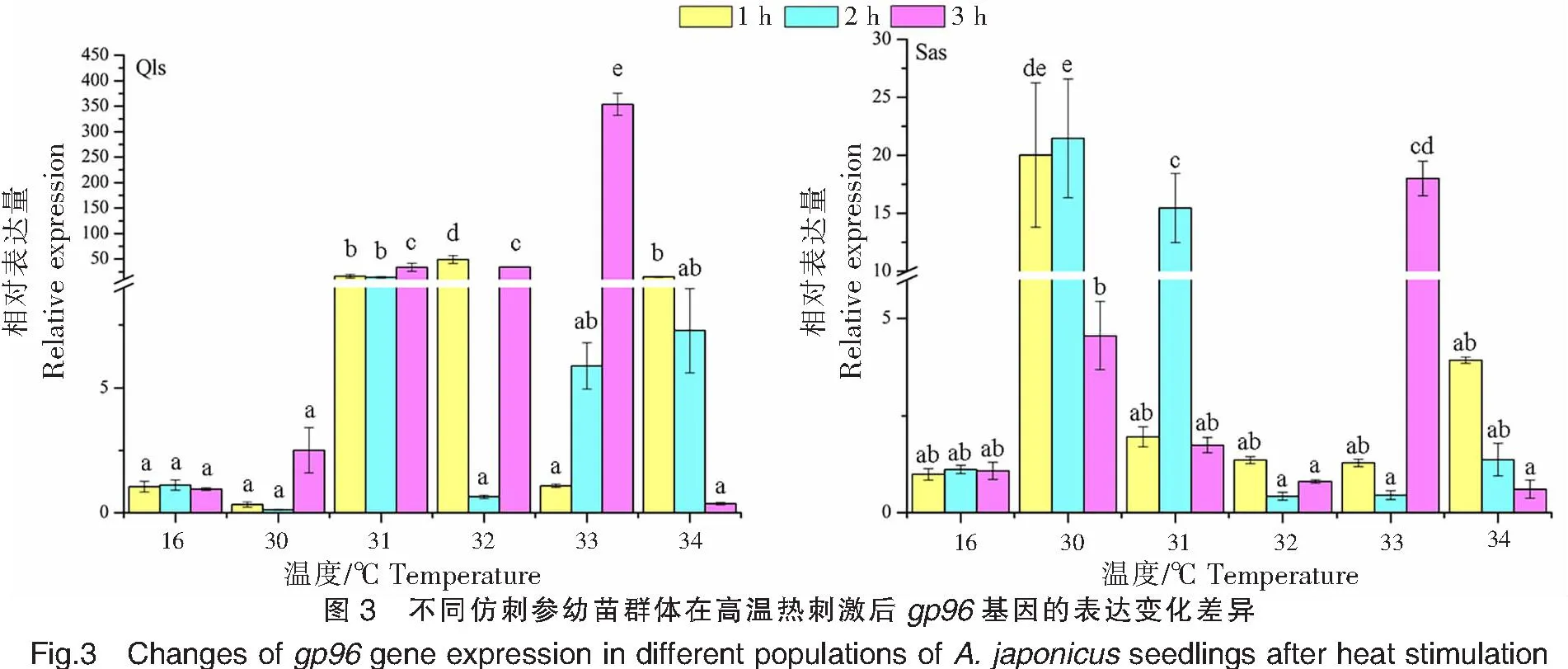
青島本地群體在高溫刺激1、2、3 h后,gp96基因的表達量峰值分別出現在32、31、33 ℃;而南方養殖群體則分別出現在30、30、33 ℃。
南方養殖群體在30 ℃高溫刺激1 h后,gp96基因的表達量已達到(20.019±6.224),并在2 h處達到峰值,此時也是南方養殖群體表達量的最高值(21.467±5.131),最后在3 h處出現下降;在31 ℃高溫刺激下,gp96基因的表達模式與30 ℃高溫刺激下的相同,呈現先升高后下降的趨勢;在32 ℃高溫刺激下,gp96基因的表達量在1 h處出現上調,但在2~3 h間出現上下浮動;在33 ℃高溫刺激下,gp96基因的表達量在1~3 h間來回波動,最高和最低表達值分別出現在2、3 h處;在34 ℃高溫刺激下,gp96基因的表達量在1 h處達到最高,之后表達量隨著高溫刺激時間的延長而逐漸降低。
綜上所述,老年衰弱患者進行手術存在發生短期和長期不良結局的高風險,術后不良事件發生率較非衰弱患者顯著增加。有必要將衰弱納入老年患者的術前評估中,以明確是否存在衰弱及老年衰弱患者術中可能出現的問題,并以此為據進行個體化圍手術期管理。全過程需要跨學科團隊協作。目標是手術可以使老年衰弱患者獲益,減少術后不良并發癥和失能,最終能夠回歸社區生活,改善生活質量。
2.4 HSP70基因的表達情況
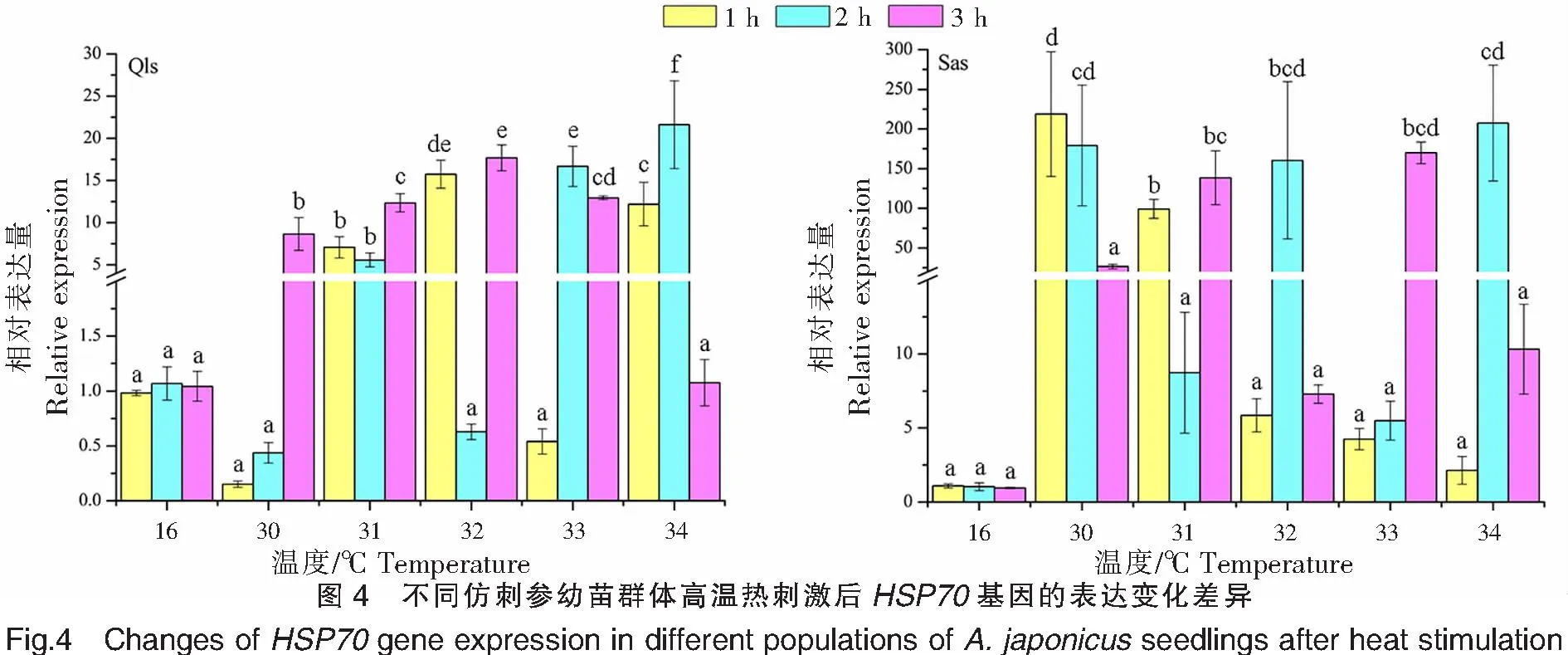
不同仿刺參幼苗群體在高溫熱刺激后的HSP70基因的表達變化差異如圖4所示,在相同的溫度刺激下,不同刺激時間的HSP70基因的表達存在差異。青島本地群體在30、31、32 ℃高溫刺激下,HSP70基因的表達量均在3 h處達到峰值,分別為(8.649±1.936)、(12.350±1.076)、(17.680±1.532);而在33、34 ℃高溫刺激下,HSP70基因的表達量峰值均出現在2 h處;表達量的最高值出現在34 ℃刺激2 h處,為(21.610±5.208)。南方養殖群體在30 ℃高溫刺激下,HSP70基因的表達量在1 h處達到峰值,也是該群體表達量的最高值,為(218.750±78.701);而在31、33 ℃高溫刺激下,HSP70基因的表達量峰值均出現在3 h處;在32、34 ℃高溫刺激下,HSP70基因的表達量峰值均出現在2 h處。青島本地群體在高溫刺激1、2、3 h后,HSP70基因的表達量峰值分別出現在32、34、32 ℃;而南方養殖群體則分別出現在30、34、33 ℃。
2.5 HSP26基因的表達情況
控制變量。經濟發展水平用剔除價格因素的實際人均GDP衡量,地區經濟發展水平越高越有利于該地集聚資源,有利于提升企業的創新水平,促進產業升級[16];人力資本水平用各地區平均受教育年限來測量,計算公式為:(小學受教育人數×6+初中受教育人數×9+高中受教育人數×12+大學受教育人數×16)/總受教育人數[17], 人力資本是影響環境規制和技術進步的重要因素;產業結構的計算公式是工業增加值/GDP,產業結構的變動直接推動產業升級變化;技術創新用各年各省的專利授權量表示[18],新技術的發明能夠促使企業的生產經營向高新技術方向轉變,從而使產業結構向更高端的方向調整,實現產業升級。
2.6 proeintl(2)efl基因的表達情況
為了解不同誘導溫度和處理時間下兩個仿刺參群體HSPs、sHSPs和proeintl(2)efl基因的表達模式差異,將兩個群體分別轉入選定的溫度中進行熱刺激,溫度設置為16 (對照組)、30、31、32、33、34 °C,刺激時間分別為1、2、3 h。每個刺激溫度和刺激時間均有10頭仿刺參,在刺激1、2、3 h后,分別隨機采集不同實驗組別中的3頭仿刺參,然后立即置于液氮中,帶回實驗室并保存在-80 °C冰箱中,備用待測。
3 討論
3.1 高溫馴化提高仿刺參的耐熱性
仿刺參是典型的溫帶物種,對外界環境變化具有強敏感性。Meng X等[27]和王青林[32]對北方仿刺參進行高溫馴化,結果發現高溫馴化后仿刺參的半致死溫度為31.8 ℃。本研究將北方仿刺參轉移至南方,在自然水溫下進行為期一年的養殖,然后與在北方養殖的同批次仿刺參進行耐熱性比較,分析了兩個群體間的耐熱性差異,其中溫度耐受性實驗得出兩個群體的致死溫度均為34 ℃;南方養殖群體的亞致死溫度和半致死溫度分別為32、33.1 ℃,青島本地群體分別為30、31.9 ℃。本研究發現的青島本地群體半數致死溫度與Meng X等和王青林的結論基本一致。李曉英等[33]比較了北方5個不同地理群體仿刺參的高溫耐受力,結果發現膠南群體的半致死溫度最高(31.9 ℃),而昌黎群體半致死溫度最低(31.5 ℃),分析認為膠南群體分布靠南、緯度最低,經過長時間較高溫度的馴化與適應,使其對于高溫的耐受力最強,而昌黎群體分布位于較北端、緯度較高,長期處于略微低溫馴化中,導致其對高溫的耐受能力較弱。本研究發現,南方養殖群體的亞致死溫度和半致死溫度顯著高于青島本地群體,這與李曉英等[33]的研究一致,說明生長環境中水溫的高低能夠影響仿刺參的溫度耐受性,而受到長期高溫馴化的仿刺參具有更強的高溫耐受性。養殖在南方自然水溫中的仿刺參幼苗比北方苗種經歷更強的高溫脅迫,因此其相較于北方苗種具有更高的耐熱性。今后在仿刺參品種選育工作中可以通過在南方累代定向選育,不斷提高其耐熱性能,從而迭代選育出耐高溫品系。
那個時候,我們的縣里,早就有了洋學堂了。小學好幾個,大學沒有。只有一個男子中學,往往成為談論的目標。談論這個,不單是翠姨,外祖母、姑姑、姐姐之類,都愿意講究這當地中學的學生。因為他們一切洋化,穿著褲子,把褲腿卷起來一寸,一張口,格得毛寧外國話,他們彼此一說話就“答答答”,聽說這是什么俄國話。而更奇怪的就是他們見了女人不怕羞。這一點,大家都批評說是不如從前了,從前的書生,一見了女人臉就紅。
3.2 南北不同養殖仿刺參群體的熱休克蛋白基因的表達差異
當生物體受到外界環境刺激時,包括熱休克蛋白在內的一些基因的表達可能被誘導。根據平均分子質量大小,熱休克蛋白可分為HSP110、HSP100、HSP90a、HSP70、HSP60和sHSP[15,34-35]。本研究發現,經過高溫熱刺激后,南方養殖群體和青島本地群體的HSP90a、gp96、HSP70、HSP26和proeintl(2)efl基因的表達存在差異。經過30 ℃高溫刺激的青島本地群體的HSP90a、gp96、HSP70、HSP26基因的表達量在1、2 h處沒有出現顯著增加,在3 h處才出現明顯上調,而南方養殖群體的基因表達量在30 ℃高溫刺激1 h處均出現顯著上調。結果表明經過高溫熱刺激后,南方養殖群體的溫度耐受性相關基因的上調時間明顯早于青島本地群體,說明南方養殖群體對高溫熱刺激的適應能力強于青島本地群體。
在不同的刺激溫度下,青島本地群體和南方養殖群體的HSP90a、gp96、HSP70、HSP26和proeintl(2)efl基因的表達量峰值發生在不同的高溫熱刺激時間點,青島本地群體的表達峰值分別出現在34 °C 1 h處、33 °C 3 h處、34 °C 2 h處、34 °C 1 h處和34 °C 1 h處,而南方養殖群體則分別出現在32 °C 2 h處、30 °C 2 h處、30 °C 1 h處、30 °C 1 h處和34 °C 2 h處。隨著熱刺激溫度的升高或時間的延長,基因表達并非一直上調,這種下降與高溫下生物體整體蛋白質合成的減少有關[36]。當外界溫度達到生物體的耐受極限,隨著溫度的進一步升高,機體熱損傷蛋白質會不斷增加,總蛋白質合成遭到破壞,因此熱休克蛋白的表達受到抑制。
對比南方養殖群體和青島本地群體,HSP90a基因在南方養殖群體的表達量最高值(為對照組的222倍)是青島本地群體(為對照組的43倍)的5倍,HSP70基因在南方養殖群體的表達量最高值(為對照組的218倍)是青島本地群體(為對照組的21倍)的10倍,這與王青林[32]研究發現的仿刺參高溫馴化組HSP70基因在熱刺激誘導溫度下的最高表達量明顯高于低溫馴化組的結果一致,說明經過高溫馴化的仿刺參能保持較高水平的HSP70表達,以防止蛋白質變性和聚集。 此外,HSP90a、gp96、HSP70、HSP26和proeintl(2)efl這5個基因在兩個仿刺參群體的34 ℃高溫刺激3 h處的表達量均下調至對照組水平,說明此時仿刺參HSPs基因的表達已達到上限并開始迅速回落,其已無法通過繼續提高HSPs基因的表達水平來抵抗外界的熱脅迫,這與本研究兩個群體的致死溫度均為34 ℃的結果一致。
(1)基于 OMI的汾渭平原 SO2柱濃度值季節變化特征比較明顯,由高到低依次為冬季、秋季、春季和夏季。太原、渭南和西安逐月濃度變化總體呈現下降趨勢,臨汾表現出了弱上升趨勢。這4個城市的SO2柱濃度值與地面監測站的SO2濃度值具有較好的相關性,說明基于 OMI的 SO2柱濃度變化一定程度上可反映大氣SO2濃度變化。
4 結論
經過高溫馴化,仿刺參能夠更早地對外界高溫做出反應,同時其具有更強的合成熱休克蛋白的能力,以避免溫度驟升引起的蛋白質變性和聚集,從而提高它們在夏季高溫下的耐熱能力和存活率。因此,通過將仿刺參幼苗進行“北參南養”,經過幾代的高溫選育,能夠為仿刺參耐高溫品系的選育提供良好的實驗材料。

