等溫擴增技術應用于蝦肝腸孢蟲檢測的研究進展
譚念秋,魏春梅,文鈺淞,范曉東
(重慶師范大學生命科學學院,重慶 400000)
目前,對蝦養殖業是世界水產養殖的重要組成部分,產值超過260億美元[1-2]。但在養殖過程中,對蝦一直受到各種病原(真菌、細菌、病毒、寄生蟲等)的威脅,如蝦肝腸孢蟲(Enterocytozoonhepatopenaei,EHP)等[3]。EHP隸屬于腸孢蟲屬(Enterocytozoon),是一種專性細胞內寄生蟲,主要感染對蝦肝胰腺上皮細胞[4],傳播途徑可分為水平傳播和垂直傳播。從幼蝦到成蝦的各成長階段均會感染EHP,雖然感染后的對蝦不會死亡,但會出現攝食減少、生長緩慢等病癥[5]。目前尚無有效治療EHP感染的特效藥,導致該病難以防治,給養殖戶造成了極大的經濟損失,嚴重影響了對蝦養殖業的發展[6-7],如2014—2015年印度對蝦產業因受EHP感染,年產量減少10%~20%,經濟損失達數千萬美元[8]。
近年來,EHP在中國、委內瑞拉、泰國、馬來西亞、越南等國家大面積暴發[9-11],在尚未發現有效治療EHP方法的情況下,對其進行預防檢測就顯得尤為重要。EHP的檢測手段主要包括組織病理學檢測和分子生物學檢測,其中屬于分子生物學檢測領域中的等溫擴增技術因具有簡便性、低成本、較高的靈敏度和特異性等優點而成為重要的田間檢測技術。為此,本文擬對EHP的常規檢測方法進行綜述,重點介紹環介導等溫擴增(Loop-mediated isothermal amplification method,LAMP)和重組酶等溫擴增(Recombinase polymerase amplification,RPA)檢測技術及其在EHP檢測中的應用,以期能在EHP感染早期進行陽性篩查,為EHP的高效防治提供理論參考。
1 EHP的檢測方法
在EHP感染早期,宿主無明顯、特定的病理特征,因此無法通過直觀視覺診斷EHP感染,需要借助現有的光學儀器設備及相關的分子檢測手段。目前,EHP的檢測方法主要包括組織病理學、原位雜交以及分子生物學等。
組織病理可通過光學顯微鏡、相差顯微鏡對感染的組織切片進行觀察[4],而各種染色技術的應用則使感染肝胰腺組織中的EHP能被更清晰地觀察到[12]。但組織病理學觀察適用于感染后期,EHP感染早期的組織切片因無明顯感染的組織學跡象,容易產生漏檢而導致檢測人員錯誤判斷,如Salachan P V等[13]研究發現,組織病理學觀察無法判斷是否感染了微孢子蟲,但其核酸檢測為強陽性。Zhao R H等[14]利用熒光染色劑鈣熒光白(Calcofluor white,CFW)對EHP進行檢測,結果表明其可快速檢測懸液、糞便中的EHP孢子,但該方法特異性和靈敏度較差。組織病理學觀察適用范圍有限,容易造成假陰性,只能作為輔助性的EHP檢測方案。
原位雜交常作為一種輔助組織病理檢測的手段而被應用于EHP的檢測[15-18]。如Tangprasittipap A等[18]利用地高辛標記探針,開發了一種用于EHP檢測的原位雜交方法,其具有良好的靈敏度和特異性。但該方法操作復雜,無法在現場進行快速檢測,需在實驗室條件下進行使用。
EHP的分子生物學檢測技術主要包括聚合酶鏈式反應(Polymerase chain reaction,PCR)、實時熒光定量 PCR(Quantitative real-time PCR,RT-PCR)、等溫擴增方法(LAMP和RPA)、數字PCR等。PCR是世界動物衛生組織方案中概述的許多蝦病診斷的金標準[3],在EHP檢測中常用的方法主要有巢式PCR[18]和一步法PCR[19]。目前,在EHP的檢測中,研究者常用SSU-rRNA和SWP等基因作為檢測靶標[15-20]。其中SSU-rRNA作為檢測靶標是早期主要的PCR檢測方法,但存在特異性低等問題,而現在的研究以SWP和β-tubeulin等為檢測靶標[21],有效地提高了PCR檢測的特異性。汪浩等[22]基于EHP孢壁蛋白建立了熒光定量檢測體系,該方法在5.02×101~5.02×108copies/μL范圍內具有良好的線性關系;馬來等[23]研發了基于TaqMan-MGB探針的熒光定量檢測方法,對蝦樣品的檢測下限為10 copies/mg;Zhang H等[24]建立了靈敏、準確的雙鏈液滴數字PCR(ddPCR)方法,可以同時檢測和定量兩種病原體,其中EHP的檢測下限為2.3 copies/μL,極大地提高了檢測靈敏度。采用PCR、熒光定量PCR以及數字PCR檢測EHP時,需要借助聚合酶鏈反應核酸擴增儀、數字PCR檢測儀等儀器,因而只能在實驗室進行檢測,無法在田間進行快速檢測。等溫擴增技術是基于傳統分子生物學方法而發展起來的,通過水浴鍋、恒溫儀等設備,在恒溫條件下快速放大目的基因,操作簡單,具有發展為快速高效的現場檢測方法的潛力。目前用于EHP的等溫檢測技術主要包括LAMP和RPA等[25]。陳進會等[26]基于18S基因建立了檢測EHP的LAMP檢測方法;黃紀徽等[27]分別以EHP的SWP和SSU-rRNA為靶標建立了實時熒光RPA檢測方法。
隨著科技發展,研究人員對以上檢測方法進行了持續改良,以期尋找到特異性強、靈敏度高的方法,但各種技術手段都存在明顯的優缺點(表1),在進行檢測時,應根據需求選擇最佳的實驗方法。Thawatchai C等[3]比較了幾種檢測EPH的技術,其中巣氏PCR、RT-PCR、LAMP、RPA的靈敏度最高,各種檢測技術的特異性與靶標基因相關,其中PTP2和SWP基因的特異性最佳,而組織病理學的靈敏度和特異性相對較差,因此靶標基因的選擇與實驗技術的改良同等重要。

表1 EHP常規的檢測技術比較Tab.1 Comparison of detection techniques for EHP
2 等溫擴增技術的研究進展
等溫擴增技術的反應過程始終保持恒溫狀態,通過添加不同活性的酶和特異性引物達到快速擴增核酸的目的,因其具有高靈敏度、高特異性、低成本、操作方便等特點而被廣泛應用于檢測食源性和環境病原體,但LAMP和RPA并未被大范圍應用。隨著對交叉學科研究的增多,研究者結合熒光染料、探針等手段對LAMP和RPA的方法進行改良,拓展了其應用領域。
2.1 LAMP研究進展
LAMP是一種能在恒定溫度下,利用特異性引物和具有鏈置換特性的Bst.DNA聚合酶快速擴增的技術,具有低成本、檢測操作簡單快捷、特異性強和靈敏度高[25]等特點,是能夠被推廣并應用到田野上的檢測技術。常規的LAMP存在較多的缺點,如擴增后產物不易被分析[28]、缺乏特異性高且成本較低的染料、擴增產物容易造成氣溶膠污染、導致假陽性[29]等。
為彌補LAMP的不足,研究者們將各種染料加入LAMP反應中,Wu C等[30]通過在LAMP體系中加入顯色靈敏的金屬指示劑羥基萘酚藍(HNB),建立了一種快速可視化檢測金黃色葡萄球菌的方法,這是一種有巨大潛力的快速診斷金黃色葡萄球菌感染的技術手段。常規的LAMP檢測只關注基因擴增后的結果,而熒光實時定量方法不僅可以實時觀察基因擴增情況,且可以對基因進行定量分析,能更加直觀地獲得實驗數據[31]。Gadkar V J等[32]在環引物的3’端連接了一個羧基熒光素基團,探針僅在與靶標結合時發出熒光,而在未結合狀態時淬滅,可更直觀地觀察擴增結果;Elbeaino T等[33]將Taqman熒光探針應用于LAMP中,結果顯示該方案有效地提高了LAMP的特異性,避免了假陽性;Lin F等[34]設計了一種雙重逆轉錄-環介導橫溫擴增技術與橫向流動試紙條(Reverse transcription loop-mediated isothermal amplification and lateral flow dipstick,RT-LAMP-LFD)檢測法來檢測引起蝦白尾病的羅氏沼蝦(Macrobrachiumrosenbergii)諾達病毒(MrNV)與超小型病毒(XSV),將異硫氰酸熒光素(FITC)標記在內引物FIP的5’端上,該方法的特異性強和靈敏度高。
2.2 RPA的研究進展
RPA是一種利用重組酶、單鏈結合蛋白、DNA聚合酶在等溫條件下(最佳溫度37 ℃)進行核酸擴增的技術[35-36]。近年來,由于RPA的檢測時間極短,因此許多研究者將其應用于病原微生物的檢測。如Kersting S等[37]利用RPA的原理發明了一種能同時進行多重檢測的芯片,可在20 min內檢測不同的病原體,其對金黃色葡萄球菌和腸道沙門氏菌的檢出限均為10 cfu;Kim T H等[38]開發了一種用于檢測牛奶樣品中沙門氏菌的離心微流體設備,該設備可在30 min內以全自動工作流程完成DNA提取、RPA反應和產品檢測等過程。
與LAMP相同的是,RPA常規的結果分析方法為電泳檢測,因此其無法被用于快速檢測。近年來,隨著基因編輯技術的發展,研究者們將RPA與CRISPR-Cas12a結合,再應用于微小隱孢子[39]、非洲豬瘟[40]、支原體[41]以及(SARS)-CoV-2[42]的現場快速檢測。此外Wang Y等[43]建立的RPA側向流試紙條(RPA-LFS)方法通過在RPA反應系統的5’端添加異硫氰酸熒光素(Fluorescein Isothiocyanate,FITC)標記的探針、用生物素標記反向引物的5’端,將其作為擴增產物在試紙條上反應時的比色指示劑,結果表明RPA與試紙條的結合進一步提高了該技術的靈敏度和特異性,其對病原體檢測下限為1 cfu/μL。Ge R等[44]研究了RPA與光電化學(Photoelectrochemistry,PEC)生物傳感器結合的技術(RPA-PEC),這也為便捷檢測病原奠定了基礎。
3 應用于檢測EHP的等溫擴增技術
3.1 LAMP對EHP的檢測
自從發現等溫擴增技術能低成本且快速靈敏地檢測EHP,研究者們便將研究的熱點轉移到對等溫擴增技術的改良上,試圖找到一種最佳的檢測方案,以實現在現場快速、準確地可視化檢測EHP。為實現此目的,研究者們將LAMP與熒光染料結合起來,并進行了諸多探索。如Ma B等[45]將SYTO-16 DNA結合染料應用于LAMP,開發出一種新的技術——實時定量環介導等溫擴增(Quantitative loop-mediated isothermal amplification,qLAMP),其既能實時觀察,也能有效提高EHP檢測的靈敏度;Kumar T S 等[46]利用SYBRTMgreen Ⅰ染料在封閉管系統中目視檢測擴增的LAMP產物,建立了一種可視化的LAMP方法,在農場水平診斷EHP方面具有巨大的發展潛力。由于EHP可通過水體傳播和親本垂直傳播,因此在孵化前篩選親本、在蝦池放養前篩選幼體、檢測自然攜帶者對對蝦健康養殖十分重要。在對蝦養殖過程中,除了EHP外,其他病原也會造成對蝦生長異常,如白斑綜合征病毒(White spot syndrome virus,WSSV)、十足類虹彩病毒(Decapod iridescent virus 1,DIV1),對蝦在患病時免疫力會隨之下降,更容易感染其他病原體。Hu K S等[47]建立了一種能以特異性檢測EHP、WSSV、DIV1病原的基于LAMP的微流控芯片技術,其能同時檢測蝦體內的多種病原,最大程度地節約時間和成本,滿足快速檢測的需求。李英瑕等[48]設計了一種基于LAMP原理的EHP現場快速檢測試劑盒,其滿足了靈敏度、特異性、重復性、穩定性及簡便快捷的現場檢測要求,可被用于對蝦養殖場EHP的檢測。
3.2 RPA對EHP的檢測
在EHP檢測中,RPA對溫度的要求比LAMP低,但檢測速度更快。2020年,Zhou S H等[49]首次將RPA應用于蝦EHP的檢測,實驗表明RPA在30 ℃恒溫、反應40 min條件下,即可出檢測結果,且無交叉反應,但其靈敏度與PCR相當,而低于RT-PCR。Kanitchinda S等[50]將RPA和CRISPR-Cas12a結合,最低可以檢測到50個拷貝的DNA,雖然這個過程需要在37 ℃下反應1 h,但是可以通過紫外/藍光激發或者橫向流動進行檢測,從而實現肉眼觀察的可能。Li G等[51]開發了一種實時RPA方法,其條件為38.5 ℃反應15 min,檢測限達到10 copies/μL DNA。Ma C等[52]將熒光分析與RPA系統相結合,可在39 ℃、3~7 min內快速檢測EHP,且能達到每個反應12 copies/μL DNA,有效地縮短了檢測的時間、保證了檢測的質量。Yang L H等[53]將激烈熱球菌(Pyrococcusfuriosus)的核酸酶PfAgo與RPA結合,將靈敏度提高到了單拷貝,是目前靈敏度最高的分子檢測方法。
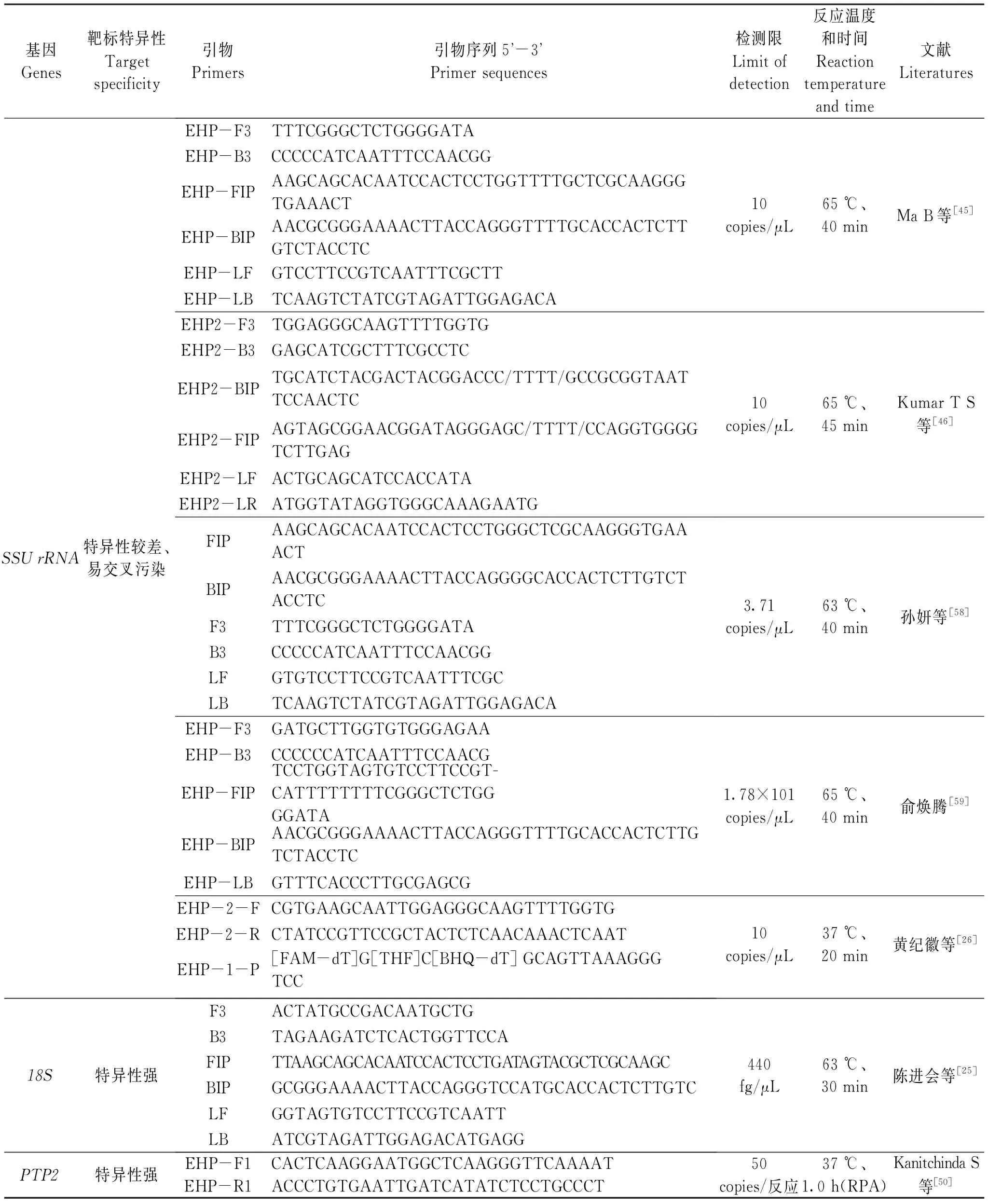
近些年來,隨著分子生物學的發展,等溫擴增技術體系的靈敏度、特異性以及便攜性顯著提高。在EHP檢測中,靶標基因的選擇十分重要,優良特異的靶標可以有效地提高檢測的靈敏度和特異性,以便更早地診斷出EHP的感染,有利于早期防治。目前,EHP的分子檢測主要是以SSU-rRNA[15]、SWP[20]、PTP2[54]、18S[25]、β-tubulin[21]為靶標基因,其中SWP、PTP2特異性較高,適合用于各種檢測方案的建立。隨著對EHP研究的不斷深入,研究者們將會獲得更多的EHP感染后特異表達的潛在標記基因,并將它們應用于對其檢測和防治技術的提升的工作中。近5年等溫擴增技術在EHP檢測中所使用的靶標基因如表2所示。

表2 等溫擴增在EHP檢測中的靶標基因Tab.2 Targets for isothermal amplification in EHP detection
續表2
4 結語
EHP對全世界對蝦養殖業構成了嚴重的威脅,同時由于有效治療EHP感染的方法尚未被發現,因此,EHP感染的早期診斷和預防對對蝦養殖產業的健康發展具有重大意義。
盡管組織學觀察、原位雜交、巢氏PCR、qPCR等技術方法應用在檢測EHP感染上已較為成熟,但這些方法存在反應時間長、依賴實驗室和昂貴設備等缺點,限制了其在野外的大規模使用。而等溫擴增檢測技術具有簡便、快捷、不需要昂貴設備等優點,具有應用于EHP現場檢測的潛力。隨著等溫擴增技術研究的深入,研究者通過在等溫擴增體系中加入熒光染料、探針等以解決靈敏度差、無法直接觀察等問題,以便該技術能更好地應用于EHP的現場檢測。此外,現有報道中通過等溫擴增檢測技術的改良方案所獲得的實驗數據僅僅是在實驗室條件下,最終將其應用于EHP的現場檢測還需要對實驗方案進行優化,同時還需降低檢測成本,開發出一種簡單、成熟的試劑盒,以便對蝦養殖人員進行獨立檢測。
隨著現代交叉學科研究的不斷深入,等溫擴增技術本身存在的局限性會被進一步突破,未來可能會形成一套成熟的等溫擴增技術體系并應用于EHP及其他蝦病的聯合檢測。此外,等溫擴增技術與試紙條及核酸適配體等進行聯合可能會成為未來快速檢測判斷病原微生物感染的新技術。

