赤水河河源段魚類資源現狀調查
陳文善,陳泊霖,盧 群,劉建虎*,何 滔,楊 峰
(1.長江上游珍稀特有魚類國家級自然保護區云南管護局,云南 昭通 657000;2.西南大學水產學院,重慶 400715;3.樅陽南方材料有限公司,安徽 銅陵 246700)

生物通過產生糞便、尿液、唾液、皮膚細胞的方式將DNA排出或脫落到周圍環境中,這類大量存在于環境中的DNA片段總和被稱為環境DNA (Environmental DNA,eDNA)[6]。eDNA技術是指直接從水體、土壤、沉積物等環境樣本中提取DNA片段,然后通過DNA測序和qPCR等分子生物學檢測技術來定性或定量目標生物,從而確定目標生物在該環境中的分布及功能特征的研究方法。該方法應用在魚類資源調查上具有一定的創新性,調查過程不依賴動物樣本,不受禁捕的限制,可以大量采樣[7];eDNA技術進行資源調查相對傳統調查成本較低,對分類學鑒定專業知識要求較低,生態環境侵入性低、影響較小[8];eDNA技術能檢測出傳統魚類多樣性調查手段難以捕獲的物種,但因假陽性和DNA污染等情況的存在,其適合作為魚類資源調查的一個重要補充手段[9]。利用eDNA進行資源調查不能完全替代傳統的魚類調查方法,但該技術具有對生物體以及生態環境無害、操作簡單、高靈敏度以及高檢測率等諸多優勢,隨著數據庫的持續完善,其適用性會越來越強[10]。
本次調查采用傳統捕撈方式和采集水樣檢測環境DNA相結合的技術方法,于2020—2021年對赤水河河源段的魚類資源現狀進行調查,分析其種類組成和數量結構、優勢種、生物多樣性及魚類棲息分布狀況,既彌補了傳統捕撈方法調查不夠全面的不足,也在一定程度解決了eENA技術出現假陽性的問題,旨在為保護區魚類生物多樣性保護提供管理依據。
1 材料與方法
1.1 樣品采集
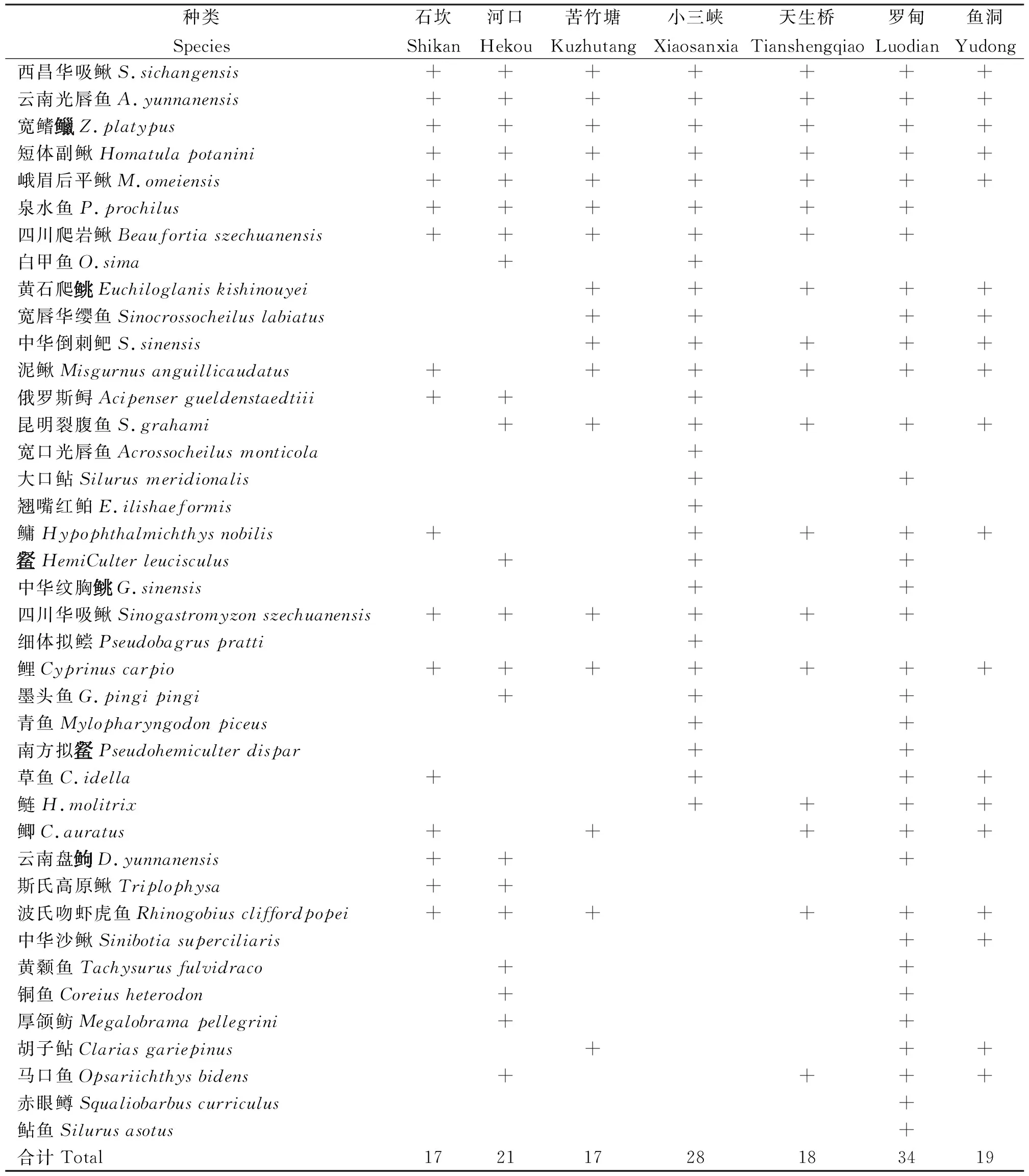
在赤水河河源段的保護區水域布設18個調查站位(表1),其中赤水河干流10個、支流8個,利用籠壺、拋撒掩網和定置三重刺網3種類型漁具對該區域的魚類進行捕撈。同時在赤水河河源段主要支流及干流設置的18個采樣點中選取7個點(魚洞、羅甸、小三峽、天生橋、石坎、河口、苦竹塘)采集eDNA水樣。
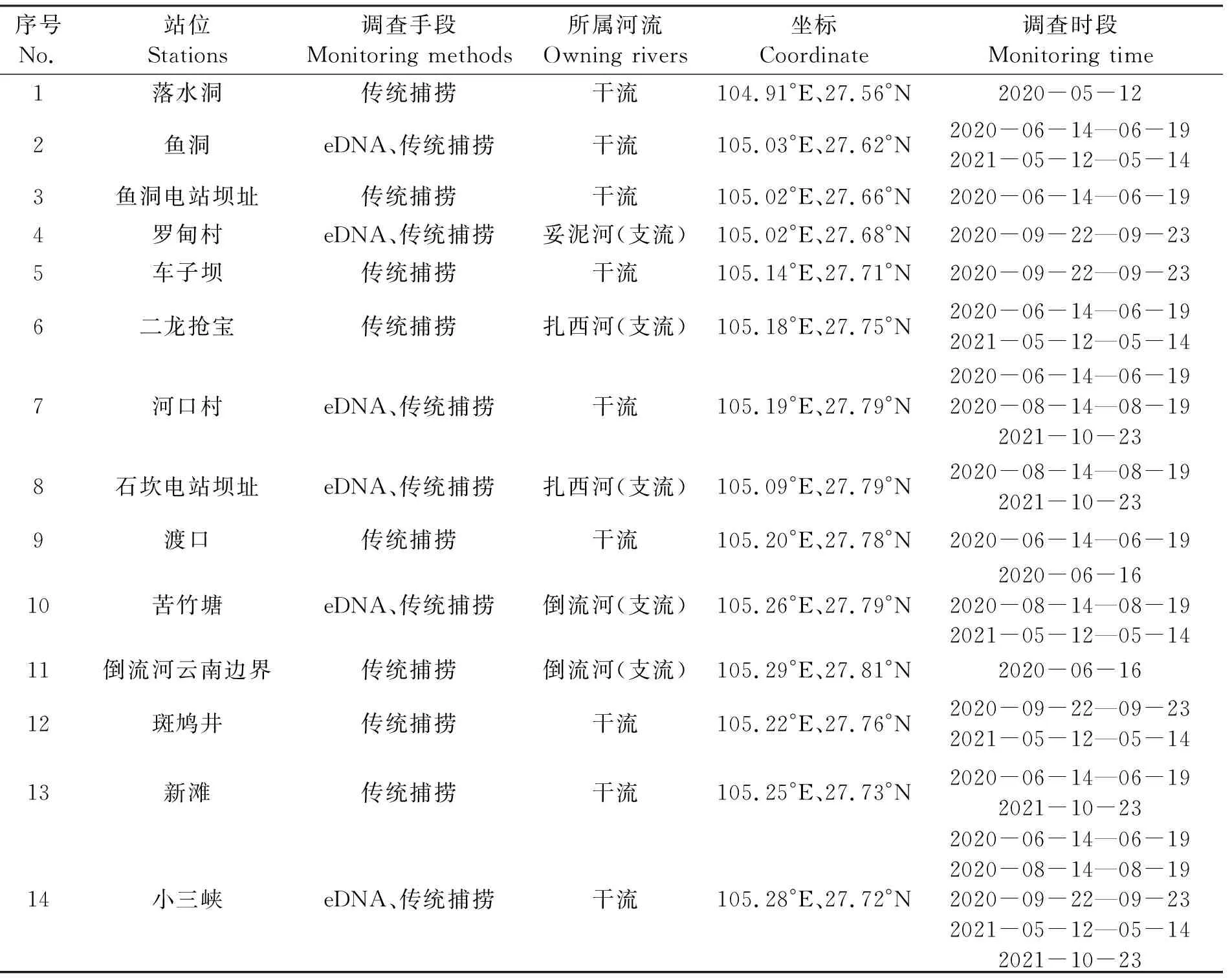
表1 赤水河河源段魚類資源調查站位分布表Tab.1 Characteristics of biodiversity monitoring stations
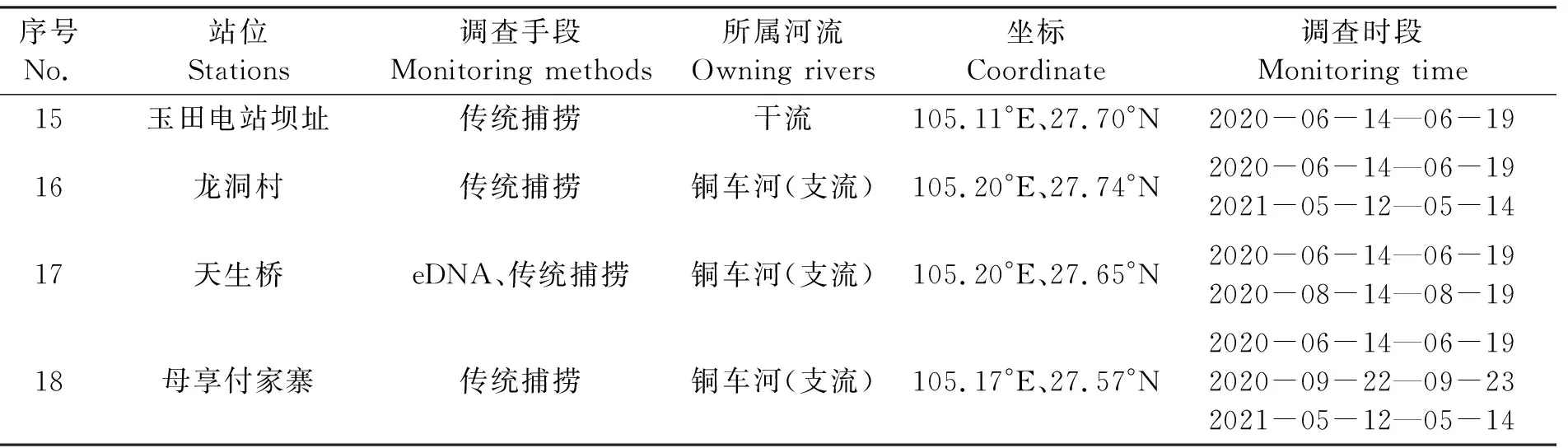
續表1
1.2 樣品鑒定與檢測
對采集到的漁獲物進行現場鑒定,并測量體長和體質量,對于疑難物種采用甲醛固定后帶回鑒定。標本鑒定和分類主要依據《四川魚類志》[11]、《長江魚類》[12]、《貴州魚類志》[13]、《中國內陸魚類物種與分布》[14]。
eDNA水樣按照Omega Soil DNA Kit試劑盒提取DNA,同時利用液氮進行保存,再帶回實驗室,并利用MiFish引物擴增,通過2%瓊脂糖凝膠電泳回收目的條帶檢測濃度。如滿足條件則運用高通量測序 (High-throughput sequencing,HTS)技術,同時對環境樣本中存在的多個物種進行識別[15]。滿足檢測條件后隨機檢測樣本OTU數并繪制OTU稀疏曲線,若有OTU無法比對至種的水平,則向上一級如屬、科等進行統計[16]。
1.3 數據分析
使用相對重要性指數(IRI)[17]計算魚類群落優勢種的成分:
IRI=(N+W)×F
(1)
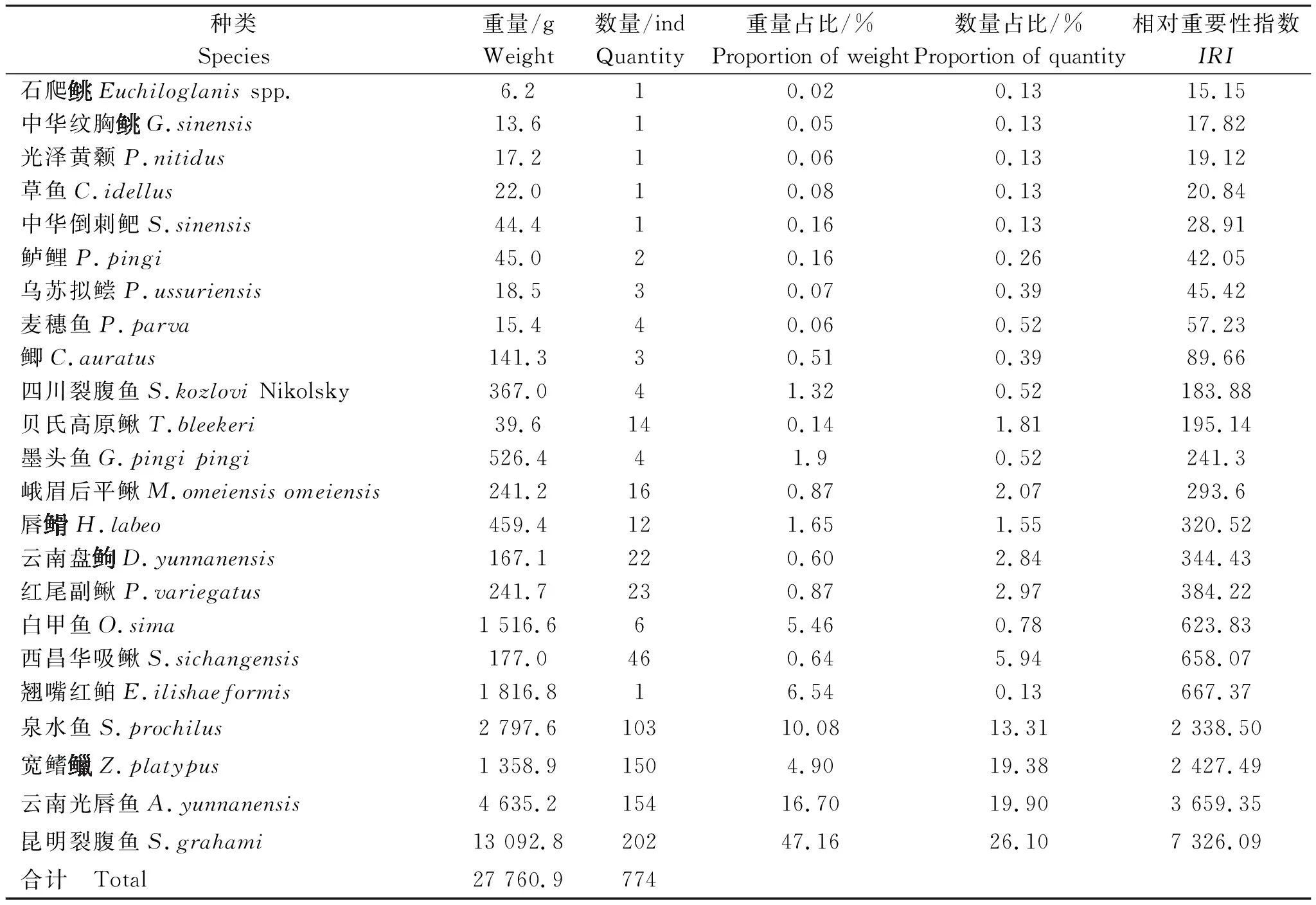
式(1)中:N為某種魚類尾數占總尾數的百分比;W為某種魚類重量占總重量的百分比;F為某種魚類在調查站位出現的次數占在總站位中的百分比。將IRI>1 000的種類作為優勢種;100 采用Shannon-Wiener多樣性指數(H′)[18]、Margalef種類豐富度指數(D)[19]和Pielou均勻度指數(J)[20]研究調查海域魚類群落的生物多樣性,計算公式如下: (2) D=(S-1)∕lnW (3) J=H′/lnS (4) 式(2)~(4)中:S為調查所獲魚類種數;W為該調查總漁獲重量;Pi為第i種重量占總漁獲重量的比例。 表2 調查期漁獲物名錄Tab.2 List of catch during monitoring period 續表2 表3 漁獲物結構Tab.3 Structure of the catch eDNA技術分析檢測出魚類4目8科38屬40種,其中石坎共有魚類3目8科17屬17種;河口共有4目8科20屬21種;苦竹塘共有3目7科17屬17種;小三峽共有4目8科25屬28種;天生橋共有3目7科18屬18種;羅甸共有3目7科30屬34種;魚洞共有4目8科19屬19種(表4)。 表4 基于eDNA檢測各站位的魚類序列比對結果Tab.4 Sequence alignment results of fish based on eDNA detection at each station 本次調查以2020年為主,因甲方資金問題,而順延至來年,但2021年采樣期間為雨季,因此漁獲物少,導致無法作多樣性分析。在2020年度調查期間采集魚類19種,占本次調查總數的82.6%,其中銅車河采集魚類13種,占總數的56.5%;倒流河采集魚類5種,占總數的21.7%;石坎河采集魚類3種,占總數的13.0%。各河段魚類組成存在差異,干流>銅車河>倒流河>石坎河,干流魚類物種更加豐富。 調查期間干流各個站點平均魚類捕獲重量為2 636 g,個體全長分布在2.1~37.0 cm之間,大個體占比較高;銅車河站點平均魚類漁獲重量為748 g,個體全長分布在2.8~22.5 cm之間;倒流河站點平均魚類漁獲重量為242 g,個體全長分布在4.6~13.5 cm之間;石坎河上游各個站點平均魚類漁獲重量為58.5 g,個體全長分布在4.0~15.0 cm之間;支流受流量、餌料生物及生態環境因素影響,其魚類個體整體偏小。干、支流在魚類資源量方面存在差異。 Shannon-Wiener多樣性指數基于物種數量反映群落種類多樣性,群落中生物種類增多代表了群落的復雜程度增高,即H′值愈大,群落所含的信息量愈大[18]。2020—2021年度調查河段漁獲物Shannon-Wiener多樣性指數為2.99,表明該河段總體魚類資源相對豐富,群落結構相對穩定。Margalef豐富度指數指一個群落或環境中物種數目的多寡,亦表示生物群聚(或樣品)中種類豐富度程度的指數[19-21]。調查河段總漁獲物Margalef豐富度指數(D)為3.31,表明調查區域魚類資源種類數相對豐富,生物多樣性結構相對完好,魚類組成及種群結構穩定。Pielou均勻度指數(J)是一個用于反映物種個體數目在群落中分配的均勻程的指數[19-21],調查河段總漁獲物均勻度指數為0.66,種群結構分布較均勻,群落結構穩定(表5)。 表5 漁獲物生物多樣性指數Tab.5 Biodiversity indexes of catches 基于eDNA檢測各站位的魚類群落多樣性指數分析結果如表6所示,從中可知,魚洞、羅甸和小三峽的魚類多樣性更加豐富,魚洞位于調查區干流上游,羅甸位于調查區干流中游,小三峽位于調查區干流下游,其他采樣點則是分布于主要支流。調查區域干流的魚類資源比支流區域更豐富,魚類多樣性也更高。 表6 基于eDNA檢測各站位的魚類群落多樣性指數Tab.6 Fish community diversity indexes based on eDNA detection at each station 本次eDNA調查,共檢測出4目8科28屬40種。考慮到網具、捕魚技術、魚類生活習性和魚類數量等因素,利用eDNA檢測的種類數較傳統捕撈方式更加全面。郭寧寧等[24]利用eDNA技術于2021年9月對赤水河流域開展了魚類多樣性、分布及其特征調查,設置了52個采樣點,其采樣點設置比本研究eDNA技術調查采樣點(7個)多45個,共調查到6目18科62屬77種魚類,比本次河源段調查(40種)多出37種。經分析,存在差異可能是郭寧寧等[24]調查的范圍更大,調查頻次更加密集,且調查區域不同導致的。本次調查區域部分支流存在水量較少等情況,幾條支流存在只有雨季才有的現象,這部分支流的魚類多樣性不高,魚類資源不夠豐富,導致調查出的魚類種類數量較少。本研究eDNA分析結果顯示,羅甸和小三峽的魚類種類最多,分別為34種和28種,其中羅甸采樣點處于妥泥河河口處,小三峽處于干流下流區域。干流區域的魚類種類更加豐富,與漁獲物種類分析結果一致。 在2020—2021年調查過程中,小三峽、魚洞調查點基因含量水平較高,物種相對豐富,而且小三峽段還檢測到部分洄游性魚類基因片段,證明赤水河下游魚類在繁殖季節可上溯至此,下一步應有針對性地加強重點物種調查,加強保護措施。在上游魚洞調查水域檢測到有銅魚基因片段信息,可能是放流品種在此區域活動停留導致的。在檢測過程中檢測到四大家魚、鯉、鯽和鱘魚,可能是養殖或者食用品種基因片段混雜導致的。考慮到采樣點的分布集中在干、支流區域,因此分別對干、支流的資源量進行統計,發現干、支流在魚類資源量方面存在顯著差異,干流的魚類種類數目比支流更加豐富,同時在干、支流的同種類魚類中,干流的魚體顯著大于支流,推測是受流量、餌料生物、生態環境因素和保護力度的影響。在后期魚類多樣性保護上,應加強干流保護區核心區的保護,逐步加強支流資源量恢復措施,提升整體資源水平。2 結果與分析
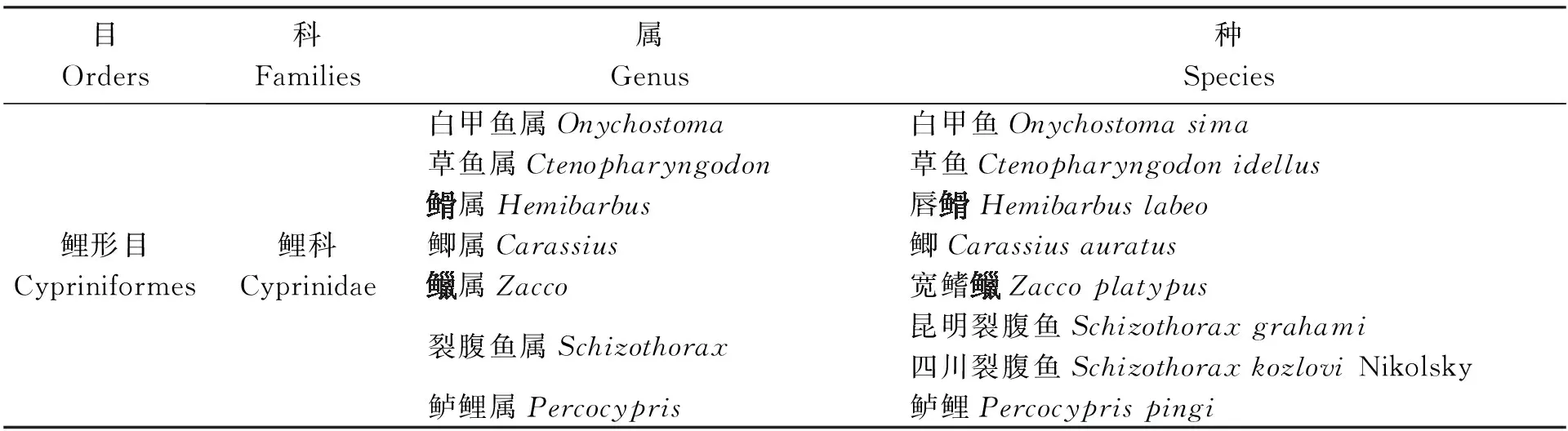
2.1 種類組成




2.2 魚類資源分布特征
2.3 魚類多樣性分析


3 討論


