基于p62/Keap1/NRF2信號通路探討針刺對腦出血后腦組織鐵死亡調控作用
戴曉紅,張宏偉,于薇薇,趙永厚
(1. 黑龍江神志醫(yī)院,黑龍江 哈爾濱 150036; 2. 黑龍江中醫(yī)藥大學附屬第一醫(yī)院,黑龍江哈爾濱 150040; 3. 東北林業(yè)大學醫(yī)院,黑龍江 哈爾濱 150090)
腦出血(intracerebral hemorage,ICH)是指腦內血管破裂造成血液聚積于腦實質內的神經系統(tǒng)損傷,特點是病情兇險、病死率高[1]。高血壓、腦動脈硬化和顱內血管畸形等都是引起腦出血的危險因素。ICH 的發(fā)生常由用力和情緒激動引起,大多數(shù)患者表現(xiàn)為在活動過程中突然發(fā)作[2]。至今尚缺乏有效的治療方法和藥物。闡明腦出血損傷的機制,探究其有效的治療方案,是目前需解決的關鍵問題。
研究表明,腦出血可引起神經元的凋亡并可使腦損傷加劇[3]。腦出血與鐵死亡也有密切關系,有研究發(fā)現(xiàn)腦出血后神經細胞死亡的重要方式是鐵死亡[4]。腦出血后從血腫中釋放出的鐵離子會在腦中積累,引起神經毒性并加速神經變性[5-6],從而導致鐵超載,鐵離子在腦出血引起的腦損傷中具有關鍵作用,腦鐵含量的增加會導致腦水腫、氧化損傷和腦萎縮。
針刺療法目前廣泛用于腦出血的治療,通過針刺對腦出血患者穴位的刺激可促進出血的吸收,提高出血腦組織中的超氧化物歧化酶活性,進而縮小腦部血腫,減輕其癥狀[7]。針刺同樣可使腦部自由基的釋放減少,從而對內皮素的產生達到抑制的作用,增強對腦細胞的保護。腦出血發(fā)生后的不同時間不但神經行為學評分會有不同變化,腦組織病理學同樣也會出現(xiàn)不同的改變。研究表明針刺可明顯改善動物ICH后的神經行為學功能及病理組織學[8]。
Kelch 樣ECH 相關蛋白 - 1(Kelch - like ECH -associated protein 1,Keap1)/核因子E2 相關因子2(Nrf2)通路是細胞內維持氧化還原穩(wěn)態(tài)、清除氧自由基的關鍵通路[9-10]。p62 可調控氧化應激和自噬的發(fā)生,有研究表明,在短暫局灶性腦缺血大鼠中,p62可通過調控Keap1/Nrf2/ARE 信號通路抑制氧化損傷。Nrf2 可介導谷胱甘肽過氧化物酶4(glutathione peroxidase 4,GPX4)和其他參與谷胱甘肽(GSH)生物合成的關鍵鐵死亡蛋白的表達。GPX4 通過把脂質過氧化物轉變成無毒脂質來抵抗鐵和氧依賴性脂質過氧化[11]。一般來說,脂肪酸氫過氧化物可以通過GPX4介導轉化成脂肪酸醇。當GPX4 失活時,累積的脂肪酸氫過氧化物催化為脂質過氧自由基,直接驅動因System Xc-抑制而介導的鐵死亡[12]。研究表明,蓽茇酰胺作用于胃癌細胞HGC - 27,可使丙二醛(MDA)的表達水平顯著升高,System Xc-、GPX4降低,可促進鐵死亡[13]。
本研究針刺對大鼠腦出血模型中神經功能和組織病理學變化的影響,并通過分析腦出血大鼠的MDA、System Xc-、GSH、GPX4 表達水平和線粒體形態(tài)的變化,探究基于p62/Keap1/NRF2 信號通路研究針刺對腦出血后腦組織鐵死亡調控作用,以期為臨床治療腦出血提供新的方向。
1 材料與方法
1.1 實驗動物與分組
健康雄性SD大鼠由哈爾濱醫(yī)科大學第二附屬醫(yī)院提供,體質量200~220 g,許可證號:SYXK(黑)2019 -001,共33只。將33只大鼠隨機分為假手術組、模型組和針刺組。假手術組3只,隨機分為1 d、3 d和7 d 3個亞組,每個亞組1只;模型組15只,隨機分為1 d、3 d和7 d 3 個亞組,每個亞組5 只;針刺組15 只,隨機分為1 d、3 d 和7 d 3 個亞組,每個亞組5 只。動物的日常飼養(yǎng)委托哈爾濱納川生物實驗動物平臺負責,給予動物適合的飼養(yǎng)條件。環(huán)境溫度控制在25 ℃左右,濕度70%左右,自動通風器保持室內通風;每天給予生長維持飼料約10 g/只,提供自由飲水。觀察大鼠精神狀態(tài)、進食及大、小便情況;患病動物給予對癥治療,必要時剔除。在實驗前適應性喂養(yǎng)1 周,實驗過程中的一切處理符合動物倫理要求,在造模前令大鼠禁食12 h,并禁水6 h。
1.2 主要試劑和儀器
電泳儀(北京六一儀器廠,型號:DYY - 12);針灸針(華佗牌,型號:0.35 mm × 40 mm);透射電子顯微鏡(HITACHI,型號:H - 7650);臺式牙鉆機(中國上海齒科醫(yī)械廠,型號:307 - 6 型);Real - time 檢測儀(ABI,型號:ABI - 7300)。
System Xc-抗體(abcam,貨號:ab175186);GPX4抗體(Abclonal,貨號:A13309);BCA 蛋白濃度測定試劑盒(Beyotime,貨號:P0010);谷胱甘肽過氧化酶4(GPX4)檢測試劑盒(云克隆,貨號:SEC995Hu);丙二醛(MDA)檢測試劑盒(云克隆,貨號:CEA597Ge);谷胱甘肽(GSH)檢測試劑盒(云克隆,貨號:CEA294Ge);亞鐵離子比色法測試盒(Elabscience,貨號:E - BC -K773 - M)。
1.3 動物腦出血模型的制備
根據(jù)大鼠立體定向圖譜,采用自體血注射結合的方式建立腦出血大鼠模型。常規(guī)麻醉,注射60 mg/kg戊巴比妥鈉進入大鼠腹腔,剪毛備皮后,采用俯臥位固定在立體定位儀上。將定位儀二側耳桿伸入大鼠骨的外耳道,以確保頭骨和內耳線保持同一平面定位;將大鼠門牙定于前端的門牙孔內以控制位置,并保證前囟點與人字位在同一位置。取大鼠兩耳尖連線的中點,消毒后行切口暴露前囟點及冠狀縫,定位坐標點(前囟點為中心,右側3.5 mm,后側0.2 mm),用1.0 mm 直徑牙鉆頭鉆孔至硬腦膜表面,鼠尾進行消毒后在剪切應力下,距尾端3 cm 處用微量注射儀取靜脈血50 μL 后將其定位在立體定位儀上,垂直進針6 mm 左右,注血速率約為20 μL/min,用自體血進行注射,留針5 min。出針后,鉆孔用牙科水泥封堵后進行縫合。
1.4 干預方法
假手術組,不予造模,予以針刺組相同的針刺療法;模型組,于腦出血造模成功后1、3、7 d內單獨取材;針刺組,于腦出血造模成功后12 h內進行針刺療法,頻次為每24 h 進行1 次針刺治療,針刺方法采用百會向曲鬢穴的透刺方法,選穴參照《實驗針灸學》[14],針灸針規(guī)格為0.35 × 40 mm,由百會穴向右側曲鬢穴進行透刺,深度35 mm 左右,留針30 min,取材時間點分別為治療后或腦出血造模后。
1.5 腦組織處理
各組大鼠常規(guī)腹腔注射麻醉,麻醉后迅速斷頭取腦組織,在冰面上把出血周圍腦組織修剪成小塊組織,而后置于EP 管中,迅速投入液氮中急凍,隨后轉入 - 80 ℃冰箱保存。取腦組織血腫灶周邊組織(以立體定位儀定位坐標點前囟點為中心,右側3.5 mm,后側0.2 mm 為腦出血造模位置),2.5%戊二醛固定用于做透射電鏡。
1.6 指標檢測
1.6.1 大鼠神經功能缺損評價方法
造模后,采用Ludmila Belayev 等設計的神經功能評分方法,對3 組大鼠的中樞神經系統(tǒng)功能進行評估。姿勢反射試驗:出現(xiàn)明顯神經功能缺失計0 分;出現(xiàn)心臟梗死對側肢體屈曲計1分;出現(xiàn)心臟梗死對側肢體外伸展計2分。肢體放置試驗:出現(xiàn)肢體放置反應速度正常計0分;出現(xiàn)身體放置反應速度滯后,但未超出2 s計1分;出現(xiàn)肢體放置反應延遲超2 s計2分。
1.6.2 Western blot 檢測腦組織中System Xc-、GPX4蛋白的表達
蛋白質經磨碎后冰上裂解30 min,用超聲波搗碎并添加DNA酶;4 ℃離心機中12 000 r/min離心15 min,配制成10%、15% SDS - PAGE 分離膠和5%濃縮膠,待測蛋白在每孔上樣20 μg。電泳過程:在Tris - 甘氨酸電泳緩沖液中電泳,設置濃縮膠電壓為80 V,染料前沿到分離膠后再加電壓到100 V,然后持續(xù)電泳直到溴酚藍到分散膠底面為止。轉膜、將膜置入溶液適量稀釋后(脫脂奶粉稀釋)的一抗中,4 ℃密封過夜,使用TBST洗膜,加適量稀釋的二抗(脫脂奶粉稀釋),然后在室內濕度孵1 h,使用TBST洗膜,加入ECL顯色底物,曝光顯色,凝膠成像分析系統(tǒng)測量條帶,目的條帶與內參條帶的強度比值代表該目的蛋白的相對表達量。
1.6.3 透射電鏡觀察線粒體形態(tài)
通過透射電鏡可以看到急性腦出血的血腫灶及周圍血管組織的線粒體超微結構改變。抽取出大鼠尾狀核組織后立即放進帶有電子顯微鏡固定液的組織培養(yǎng)器腔中,在組織培養(yǎng)器的顯微固定液中取出進行組織切割而成的0.5 cm × 0.5 cm × 0.5 cm 大小的小組織塊。將已剪切好的小組織塊放入帶有新的電鏡固化液的離心管內,進行進一步固化,經過乙醇脫水處理、樹脂包埋法、超小巧切片、最后用鉛鈾染色,經蒸餾水洗凈晾干后讀片。
1.6.4 酶聯(lián)免疫吸附法檢測腦組織中MDA、GSH、GPX4含量的變化
提取大鼠腦組織中蛋白,通過ELISA 試劑盒對大鼠心肌組織中MDA、GSH、GPX4 含量進行測定。具體實驗方法參照試劑盒說明書進行。
1.7 統(tǒng)計學方法
采用SPSS 16.0 進行統(tǒng)計學分析,數(shù)據(jù)用±s表示,兩組間比較采用t檢驗。P< 0.05表示差異具有統(tǒng)計學意義。
2 結果
2.1 各組大鼠不同時間點神經功能缺損評分比較
大鼠手術蘇醒后開始觀察并記錄3 組大鼠的神經功能體征評分。假手術組沒有神經系統(tǒng)功能缺陷的癥狀,計0 分。與假手組比較,模型組大鼠在1 d 時出現(xiàn)明顯的神經缺失情況(P< 0.05),3 d 時神經細胞缺損情況最嚴重(P< 0.05),在7 d 時神經缺失情況稍有改善(P< 0.05)。與模型組比較,針刺組大鼠中樞神經系統(tǒng)在1 d 和3 d 有所改善,但在7 d 后變化并不明顯(P> 0.05)。見表1。
表1 各組大鼠不同時間點神經功能 Ludmila Belayev評分比較(±s,分)
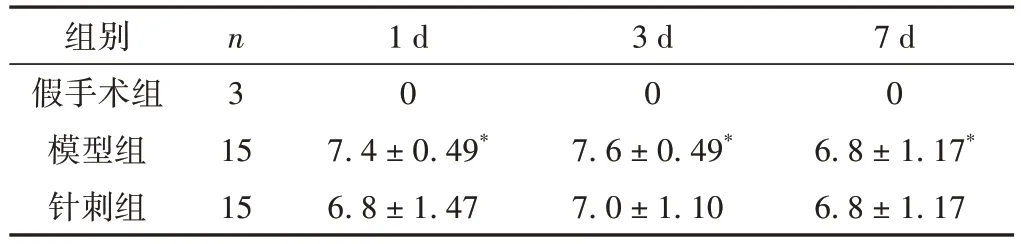
表1 各組大鼠不同時間點神經功能 Ludmila Belayev評分比較(±s,分)
注:與假手術組比較,*P < 0.05。
組別假手術組模型組針刺組7 d 0 6.8 ± 1.17*6.8 ± 1.17 n3 15 15 1 d 0 7.4 ± 0.49*6.8 ± 1.47 3 d 0 7.6 ± 0.49*7.0 ± 1.10
2.2 各組大鼠System Xc - 和GPX4相對表達量比較
不同時間點相比較,3 組大鼠System Xc-相對表達量在3 d 和7 d 均高于1 d;模型組System Xc-蛋白含量在3 d 和7 d 顯著上升,模型組在 3 d 時達到頂峰之后開始下降,針刺組在7 d 達到最大值,假手術組和針刺組整體表現(xiàn)為隨著時間增加System Xc-蛋白量不斷增加的趨勢;模型組和針刺組的GPX4 相對表達量在3 d時達到頂峰,隨后下降;且在同一時間點模型組大鼠GPX4 水平較假手術組大鼠明顯降低,針刺組大鼠GPX4水平較模型組大鼠明顯升高。見圖1。

圖1 各組大鼠腦中System Xc - 、GPX4表達情況圖
2.3 各組大鼠不同時間點神經細胞線粒體形態(tài)比較
透射電鏡觀測結果表明,模型組大鼠在1 d時線粒體體積明顯減少,線粒體嵴縮短明顯,線粒體的外膜結構出現(xiàn)斷裂。部分細胞器已遭到了嚴重的破壞,在3 d大鼠線粒體嵴幾乎全部消失,線粒體斷裂,并且引起神經元細胞凋亡,但7 d大鼠神經元細胞體發(fā)育中的線粒體形態(tài)有所恢復。與模型組比較,針刺組在每個時間點上的線粒體形態(tài)的改變程度均比較輕微。見圖2~4。
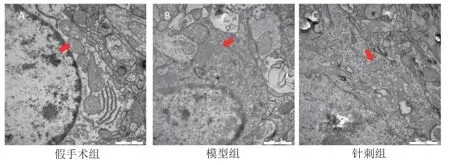
圖2 各組大鼠腦組織1 d線粒體超微結構(標尺=1 μm)
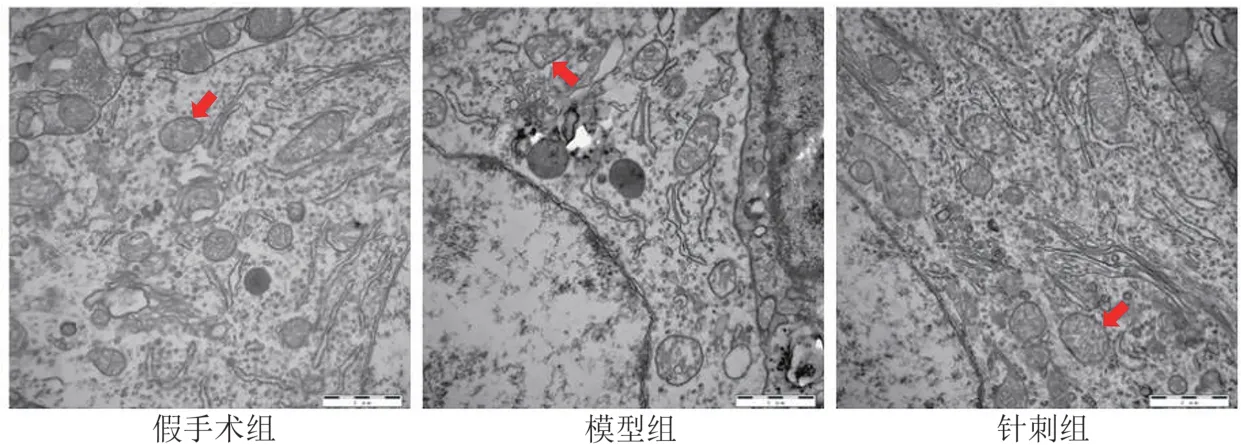
圖3 各組大鼠腦組織3 d線粒體超微結構(標尺=1 μm)

圖4 各組大鼠腦組織7 d線粒體超微結構(標尺=1 μm)
2.4 各組大鼠不同時間點腦組織中MDA、GSH、GPX4水平比較
與假手術組比較,模型組在不同時間點大鼠的MDA 水平均明顯升高(P< 0.05);GSH、GPX4 水平均明顯降低(P< 0.05);與模型組同一時間點比較,針刺組大鼠MDA 水平均明顯降低(P< 0.05);GSH、GPX4水平均明顯升高(P< 0.05)。模型組和針刺組大鼠在3 d MDA 水平達到高峰,7 d MDA 水平下降。GSH、GPX4水平則不斷升高。見表2。
表2 各組大鼠不同時間點MDA、GSH、GPX4水平比較(±s)
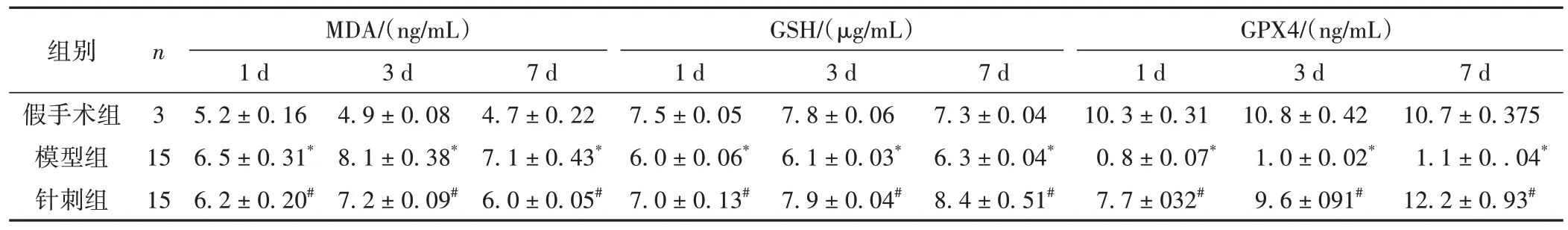
表2 各組大鼠不同時間點MDA、GSH、GPX4水平比較(±s)
注:與假手術組比較,*P < 0.05;與模型組比較,#P < 0.05。
組別假手術組模型組針刺組n3 15 MDA/(ng/mL)1 d 5.2 ± 0.16 6.5 ± 0.31*6.2 ± 0.20#GSH/(μg/mL)GPX4/(ng/mL)7 d 10.7 ± 0.375 1.1 ± 0..04*12.2 ± 0.93#3 d 10.8 ± 0.42 1.0 ± 0.02*9.6 ± 091#3 d 4.9 ± 0.08 8.1 ± 0.38*7.2 ± 0.09#7 d 4.7 ± 0.22 7.1 ± 0.43*6.0 ± 0.05#1 d 7.5 ± 0.05 6.0 ± 0.06*7.0 ± 0.13#3 d 7.8 ± 0.06 6.1 ± 0.03*7.9 ± 0.04#7 d 7.3 ± 0.04 6.3 ± 0.04*8.4 ± 0.51#1 d 10.3 ± 0.31 0.8 ± 0.07*7.7 ± 032#15
3 討論
腦出血一般是由各種因素造成的腦內小血管破裂而引發(fā)。臨床研究表明,80%的腦出血患者會出現(xiàn)長期的神經功能缺損和腦萎縮,且多發(fā)于高齡人群,發(fā)病率隨著年齡增大而提升。針刺治療腦血管疾病歷史悠久,是一種無毒副作用的“綠色”安全治療方法[15]。研究表明,針刺可以改善血管內皮功能障
針刺療法中由百會經向曲鬢穴透刺法,可明顯緩解腦出血的繼發(fā)性病理損害。研究表明,針刺頭部穴位可明顯提高患者體內SOD 活性,減少NO 生成,提高認知能力,針刺可以有效發(fā)揮抗氧化效果,改善腦供血以及保護營養(yǎng)神經系統(tǒng),進而減輕腦血管病[23-24]。本研究中,通過 Ludmila Belayev 評分對3 組大鼠中樞神經系統(tǒng)缺陷的情況進行判斷,結果模型組和針刺組在出血后的1 d 發(fā)生了中樞神經系統(tǒng)缺陷的情況,其中3 d 的缺陷情況最為嚴重,7 d后缺陷情況得到減輕,兩組中大鼠的1 d和3 d的中樞神經系統(tǒng)缺陷情況較假手術組稍減輕,且7 d 后兩組的缺陷情況基本相同,可充分證明,早期的針刺治療達到更好的療效。
鐵死亡的死亡方式是一種新型細胞程序性死亡[25]。發(fā)生鐵死亡的組織細胞內鐵離子會積累,并產生GSH 耗竭和脂質過氧化病理過程。GSH 主要發(fā)揮抗氧化、清除自由基作用,System Xc-是調節(jié)細胞內外GSH 平衡狀態(tài)的主要蛋白,通過調節(jié)細胞內外氨基酸水平來影響GSH 合成。Nrf2 是抗氧化反應的主要調節(jié)因子,能使細胞免受鐵死亡的損傷,并且還可介導鐵代謝蛋白、GPX4 等鐵死亡相關蛋白的表達。本研究觀察了大鼠腦組織中System Xc-、MDA、GSH、GPX4的表達,通過Western blot 檢測發(fā)現(xiàn),模型組大鼠System Xc-蛋白在 3 d時達到頂峰之后開始下降,假手術組和針刺組整體表現(xiàn)為隨著時間增加System Xc-蛋白量不斷增加的趨勢。另外,GPX4 和MDA 的表達與礙[4,16-17],擴大毛細血管循環(huán),改善局部細胞血液,加快身體新陳代謝物,并加快損傷組織的恢復[18-19]。針刺對干預腦出血改善神經系統(tǒng)功能缺陷程度和生活質量有較好的療效。此外,針刺干預時間越早,療效就越好,針刺不僅能有效改善腦血流,而且有助于吸收腦血腫,減少神經損傷[20]、縮短病程[3,21]和減少并發(fā)癥[22]。鐵死亡關系密切。GPX4 通過GSH 的作用,可將脂質過氧化中的過氧鍵轉化為輕基,降低了鐵死亡的風險。MDA 是脂質氧化的結果,能夠使細胞膜的損傷加劇,還能使線粒體呼吸鏈復合物和線粒體內關鍵酶的活性受到影響。因此,MDA 的表達水平可以間接反映出機體脂質過氧化及細胞損傷的程度。本研究中,與假手術組比較,模型組大鼠的MDA 水平明顯升高(P< 0.05);GSH、GPX4 水平均明顯降低(P< 0.05);在同一時間點與模型組相比較,針刺組大鼠MDA 水平均明顯降低(P< 0.05);GSH、GPX4 水平均明顯升高(P< 0.05)。模型組和針刺組大鼠在3 d MDA 水平達到高峰,7 d MDA 水平下降。GSH、GPX4 水平則不斷升高。結果表明針刺可降低腦出血后腦組織中MDA 水平的表達、提高GSH、GPX4 水平的表達,可促進腦血腫的吸收,減輕神經的損傷,推測針刺可能通過調節(jié)MDA、System Xc-、GSH、GPX4 的表達對腦出血后的腦組織神經細胞鐵死亡神經功能修復產生積極作用。
線粒體鐵蛋白(FtMt)是一種線粒體鐵儲存蛋白,在調節(jié)細胞鐵平衡和維持細胞氧化還原平衡方面起著關鍵作用[26-27]。研究表明,鐵死亡的發(fā)生與線粒體的形態(tài)、能量供應和新陳代謝均有關,因此研究針刺治療腦出血后線粒體的變化至關重要。韓佳煒等[28]研究針灸對于腦出血大鼠治療后線粒體形態(tài)結構變化影響中表明針刺能明顯改善腦出血后周圍組織線粒體的損傷。鄒偉等[29]通過實驗證明,針刺可使線粒體結構被破壞的相對較輕,突觸結構也相對清晰。這與本實驗結果一致,模型組大鼠1 d 后線粒體數(shù)量逐漸減少,線粒體嵴縮短,線粒體完全的斷裂,隨后神經元細胞逐漸凋亡,7 d 后,神經元中的線粒體結構已有所恢復。針刺組與模型組在各時間點線粒體形態(tài)變化均不明顯,從而可表明針刺治療腦出血可減少線粒體結構的破壞,抑制神經元鐵死亡的發(fā)生。
4 結論
針刺治療腦出血可促進血腫的吸收,減輕神經損傷,抑制線粒體損傷,可推測出針刺可能通過調節(jié)MDA、System Xc-、GSH、GPX4 的表達對出血后腦組織神經細胞鐵死亡神經功能修復產生積極作用。

