發育性內皮基因座-1在人冠狀動脈粥樣硬化斑塊中的表達及其與冠心病的關系*
路艷林, 周明, 李曼, 彭進, 戴佳琳, 丁九陽, 萬昌武, 汪家文, 王杰***, 夏冰***
(1.貴州醫科大學 法醫學院, 貴州 貴陽 550004; 2.遵義醫科大學醫學與科技學院 基礎醫學院, 貴州 遵義 564600; 3.遵義醫科大學 法醫學院, 貴州 遵義 564600)
冠心病(coronary heart disease,CHD)是心血管系統疾病中發生猝死最常見的疾病,其發病機制仍不完全明確[1]。動脈粥樣硬化(atherosclerosis, AS)是CHD發生的病理生理基礎,研究表明炎癥反應是引起AS發生發展的關鍵因素之一,與CHD猝死直接相關[2]。目前在法醫病理鑒定中,CHD引起的猝死主要是根據冠狀動脈的病理形態學改變來診斷,但實踐中往往缺少典型的病理形態改變,給法醫鑒定帶來了一定的難度。研究表明心臟標記物對CHD輔助診斷具有一定的指導意義[3]。課題組前期蛋白組學實驗發現在患有CHD死者的冠狀動脈中發育性內皮基因座-1(developmental endothelial locus-1,DEL-1)表達上調,提示DEL-1可能是參與CHD的相關炎性生物標記物。DEL-1是一種分子量為52 kDa的炎癥因子,主要參與炎癥反應的調節[4-6]。研究顯示,CHD患者血清DEL-1的水平明顯高于健康者[7];Kakino等[8]研究顯示,DEL-1在急性炎癥中主要發揮抗炎作用,而在慢性炎癥中則是促進作用;提示DEL-1可能和CHD的發生發展有關。DEL-1可通過調節磷酸化糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)/CAAT增強結合蛋白β(enhanced binding proteinβ,C-EBPβ)通路參與炎癥反應[6],因此本研究以人體冠狀動脈組織為研究對象,直接檢測DEL-1及下游GSK-3β/C/EBPβ通路蛋白在冠狀動脈病灶內的表達,探討DEL-1是否通過GSK-3β/C-EBPβ通路調節炎癥反應參與CHD的發生發展,以期補充DEL-1基因在動物實驗和血清實驗之外人冠狀動脈中的研究空白,為臨床及法醫學中CHD診斷、CHD猝死案件的病理學診斷提供實驗依據。
1 對象與方法
1.1 研究對象
本研究獲貴州醫科大學倫理審查委員會認可(審批號2020163),選取貴州醫科大學法醫司法鑒定中心冠狀動脈標本共58例,分為CHD組(25例)與對照組(CON組,33例)。CHD組納入標準:(1)尸體常溫保存不超過24 h或冷凍保存不超過3 d,室溫解凍24 h內尸檢;(2)冠狀動脈管壁內膜粥樣斑塊形成,伴有或不伴有繼發病變形成;(3)組織病理學明確診斷為CHD(包括因CHD猝死的案例)。排除標準:(1)組織自溶或結構不清者;(2)患有心肌病、風濕性心臟病及心肌炎等心臟病者;(3)多發全身炎癥性感染或中毒死亡者。按照納入和排除標準CHD組統一選取冠狀動脈左前降支狹窄程度最嚴重處,CON組取肉眼及組織學檢查未見明顯病變者左前降支。CHD組織一部分采用4%多聚甲醛固定做石蠟切片;其余部分采用液氮速凍后,-80 ℃冰箱保存供蛋白提取[9-10]。
1.2 主要試劑和儀器
鼠抗白細胞介素-17(IL-17) 單克隆抗體(Proteintech公司,US)、兔抗DEL-1多克隆抗體(Proteintech公司,US)、兔抗GSK-3β多克隆抗體(Affinity公司,US)、兔抗P-GSK3β多克隆抗體(Abcam公司,UK)、兔抗C/EBPβ多克隆抗體(Affinity公司,US)、鼠抗人β-肌動蛋白(β-actin)單克隆抗體(Abbkine公司,US)、DAB 顯色試劑盒(中杉金橋公司,中國)、兔/鼠超敏二步法免疫組織化學檢測試劑(中杉金橋公司,PV-9000,中國)、EasyScan數字切片掃描與應用系統(麥克奧迪實業集團有限公司,中國)、SDS-PAGE凝膠配制試劑盒(碧云天生物技術公司,中國)、Bio-Rad凝膠成像系統(伯樂公司,US)等。
1.3 研究方法
1.3.1冠狀動脈組織學形態觀察與測量 10%中性甲醛液固定1周的冠狀動脈組織進行石蠟包埋、切片(3 μm)、制片、蘇木素-伊紅(HE)染色、中性樹脂封片后,用 EasyScan 數字切片掃描,Image-Pro Plus 6.0 測量冠狀動脈內膜厚度和纖維帽厚度,計算管腔狹窄程度,測量3次取均值為測量結果。
1.3.2免疫組織化學檢測冠狀動脈病灶內DEL-1、IL-17、 GSK-3β及C/EBPβ的表達與分布 經10%甲醛固定后的冠脈組織,行常規石蠟包埋、3 μm切片、脫蠟、水合。滴入3% H2O2于37 ℃孵育15 min以封閉內源性過氧化物酶,高壓熱修復抗原4 min,加一抗(IL-17,1∶100;DEL-1,1∶100; GSK-3β,1∶200;C/EBPβ,1∶200)PBS緩沖液作為陰性對照,于4 ℃冰箱孵育過夜。第2天根據一抗屬性分別加入HRP標記二抗(羊抗兔IgG,1∶10 000,DEL-1、GSK-3β、C/EBPβ)或HRP標記二抗(鼠抗兔 IgG,1∶10 000,IL-17)37 ℃恒溫孵育30 min后DAB顯色、蘇木素復染、二甲苯透明,中性樹膠封片。在光學顯微鏡下觀察DEL-1、IL-17、GSK-3β及C/EBPβ的陽性表達。陽性染色定位條件:排除邊緣效應及非特異性染色,光鏡下組織陽性表達著黃色、棕黃色或棕褐色,觀察陽性染色在細胞內的定位和分布特點。400倍鏡下采集圖片,Image-Pro Plus6.0 測量陽性表達的總面積(Area)和總吸光度(IOD),計算平均吸光度(AOD)[10]。
1.3.3Western blot法檢測DEL-1及其相關蛋白GSK-3β、p-GSK-3β、C/EBPβ、IL-17表達水平 -80 ℃冰箱取出冠狀動脈樣本,加液氮研磨致粉末,再按1 mg/20 μL比例加入蛋白裂解液,充分勻漿后冰上靜置裂解30 min,提取上清液,測量蛋白總濃度,SDS-PAGE膠電泳后將目的蛋白轉至PVDF膜上,加入5%脫脂牛奶封閉,分別加入適當濃度一抗(DEL-1,1∶1 000;GSK-3β及p-GSK-3β,1∶800;C/EBPβ,1∶1 000;IL-17,1∶1 000;β-actin,1∶2 000),于4 ℃搖床上孵育過夜,洗膜后加辣根過氧化物酶(horseradish per-oxidase,HRP)標記的二抗(羊抗兔IgG,1∶10 000;羊抗小鼠IgG 1∶5 000),室溫孵育2 h,使用增強化學發光(ECL)液顯色。以β-actin為內參照,用ImageJ軟件測量條帶灰度值,以測得3次均值作為最終測定結果。
1.4 統計學處理

2 結果
2.1 一般情況
本研究收集尸檢案例冠狀動脈標本58例,其中男 40例、女 18例,平均(49.67±16.23)歲;其中CON組33例,男23例、女10例,平均(47.00±17.20)歲;CHD組25例,其中男17例、女8例,平均(55.18±13.04)歲。CON組和CHD組間年齡比較,差異有統計學意義(P<0.05)。
2.2 冠狀動脈形態學改變
HE結果顯示,CON組冠狀動脈內膜壁薄而平滑,內、中、外膜厚度無增厚,且均勻一致,管腔未見明顯狹窄;與CON組比較,CHD組血管內膜不規則增厚、內膜下見纖維帽明顯(P<0.05);CHD組中膜因斑塊壓迫、平滑肌萎縮受壓變薄,管腔呈不同程度向心性狹窄(P<0.05),部分粥樣硬化斑塊內可見典型粥樣壞死灶。結果見圖1、表1。

圖1 冠狀動脈組織的組織形態學變化(HE,×200)Fig.1 Histomorphological changes of the coronary artery tissues (HE,×200)

圖2 兩組冠狀動脈中DEL-1 、IL-17、C/EBPβ及GSK-3β的表達(免疫組織化學,×400)Fig.2 Expression of DEL-1, IL-17, C/EBPβ, and GSK-3β in coronary atherosclerotic lesions(immunohistochemical staining, ×400)
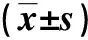
表1 冠狀動脈形態學相關指標比較Tab.1 Comparison of morphological indexes of coronary artery
2.3 DEL-1、IL-17、C/EBPβ及GSK-3β 細胞定位和吸光度的變化
免疫組織化學染色結果如2圖所示,CON組中,DEL-1、IL-17、C/EBPβ及GSK-3β在冠狀動脈內膜處呈低表達或不表達狀態。在CHD組DEL-1、IL-17、C/EBPβ及GSK-3β蛋白呈強陽性、高表達狀態;IL-17、C/EBPβ及GSK-3β多表達于泡沫細胞胞質,染色呈棕黃色;DEL-1聚集性表達于泡沫細胞的胞質及胞核中,呈棕黃色、團塊狀或彌散顆粒樣。用Image-ProPlus6.0 圖像處理軟件測量所染組織切片DEL-1 、IL-17、C/EBPβ及GSK-3β陽性表達的總面積Area和IOD發現,與CON組比較,CHD組上述蛋白的AOD均增高(P<0.05)。見表2。

表2 兩組冠狀動脈中 DEL-1 、 IL-17、C/EBPβ及 GSK-3β蛋白表達的Tab.2 AOD of DEL-1, IL-17, C/EBPβ, and GSK-3β protein expression in human coronary
2.4 冠狀動脈內DEL-1及相關通路關鍵蛋白表達水平
Western blot檢測結果如圖3所示,與CON組相比,冠心病組DEL-1及其相關因子GSK-3β、p-GSK-3β,C/EBPβ,IL-17表達水平增高(P<0.05),且GSK-3β的表達水平隨p-GSK-3β的升高而升高(P<0.05)。

注:(1)與CON組比較,P<0. 05。
2.5 DEL-1的表達水平與冠狀動脈形態結構的關系
將DEL-1表達水平與病灶斑塊結構參數做相關性分析發現,DEL-1表達水平與血管內膜厚度、管腔狹窄程度呈正相關(r=0.693、0.733,P<0.05),與纖維帽厚度呈負相關(r=-0.432,P<0.05)。見圖4。

圖4 DEL-1的表達水平與冠狀動脈形態結構的關系Fig.4 Relationship between DEL-1 expression and coronary artery morphological structure
3 討論
AS的發病機制學說包括慢性炎癥、脂質浸潤、動脈平滑肌細胞克隆、血栓形成、損傷反應等[11],其中被廣泛接受的是血管壁的慢性炎癥學說[12]。研究證實,在參與AS的多種因素中,斑塊內炎性反應的增強與其斑塊不穩定性直接相關,最終造成CHD猝死[13-15]。
DEL-1是一種由巨噬細胞及內皮細胞分泌的炎癥因子,其主要作用是參與炎癥調節、內質網應激等[16],其在炎癥方面具有雙重作用,一方面DEL-1通過抑制趨化因子配體2(CXCL2)和趨化因子3(CCL3)等趨化因子的作用而抑制炎癥[17];另一方面DEL-1可通過刺激多種炎癥因子釋放,如腫瘤壞死因子-α(TNF-α)、IL-17等,從而誘導組織炎癥反應的發生[18-19]。在炎癥和自身免疫性疾病中,IL-17與DEL-1相互作用使平衡偏向IL-17,此時慢性炎癥被增強[20];此外,DEL-1表達水平高低與缺血性疾病的嚴重程度有關[21-23]。臨床研究證實在CHD患者血清中,DEL-1的循環水平高于健康人群,且DEL-1的表達水平與CHD的嚴重程度有關[8]。本研究通過檢測人冠狀動脈粥樣硬化斑塊內DEL-1的表達,發現在CHD組中DEL-1表達上調。
研究表明,CHD晚期纖維帽變薄與動脈粥樣硬化不穩定性直接相關,最終導致CHD不良事件的發生[9,13],為了探討DEL-1與AS穩定性的關系,將DEL-1表達水平與斑塊結構穩定性參數進行相關性分析,結果顯示DEL-1表達水平與血管內膜厚度、管腔狹窄程度呈正相關,與纖維帽厚度呈負相關。提示DEL-1參與AS的病變演進,DEL-1的表達升高與AS斑塊不穩定性有關,但其機制仍需深入探討。研究表明,可通過GSK-3β/C-EBPβ信號通路調節DEL-1來調節炎癥反應[6]。C/EBP的功能主要是調節細胞增殖分化、炎癥及免疫基因的表達,而在AS中其通過促進泡沫細胞形成參與AS,表達水平隨著AS病變的加重而升高[24]。GSK-3β是一種獨特的多任務激酶,主要參與炎癥反應和細胞凋亡的調節,相關炎癥疾病研究顯示,疾病組中GSK-3β的表達水平高于健康組,且GSK-3β可通過促進泡沫細胞的形成,加速了AS病變的進程[25]。IL-17是一種由輔助性T細胞(Th17)、執行固有免疫功能T細胞(γδT)、自然殺傷細胞受體(NKT)等細胞分泌的促炎因子,與多種細胞因子協同放大炎癥反應,在AS疾病中起著關鍵性作用[26];在CHD死亡者的AS斑塊中,IL-17的表達水平與斑塊內繼發性病變呈正相關[27]。本研究檢測了人冠狀動脈粥樣硬化斑塊內DEL-1及GSK-3β/C-EBPβ通路關鍵蛋白C/EBPβ、GSK-3β、Il-17等表達,結果顯示在CHD組中上述蛋白表達同樣呈現上調趨勢,推測DEL-1可能是通過參與調節炎癥通路參與CHD的病變,其作用機制可能是在CHD發生時,導致斑塊內DEL-1表達上升,誘導IL-17激活冠脈斑塊中GSK-3β/C-EBPβ炎癥通路與之對抗,然而GSK-3β/C-EBPβ表現出更強的能力,最終導致炎癥反應增強,破壞斑塊結構的穩定性,加重了CHD的發展進程,從而引起急性心血管事件的發生。
本研究結果顯示,DEL-1參與人冠狀動脈粥樣硬化的病變演進,DEL-1表達的升高與AS斑塊不穩定性發生有關,其機制可能是通過激活GSK-3β/C-EBPβ通路促進炎癥反應的發生,證明了DEL-1在中扮演重要作用,本研究結果雖然為DEL-1在CHD猝死中的作用及機制研究提供了人體實驗參考依據,但本研究一些不足,比如由于人體標本選自尸檢死后案例,受到多種不可控因素的影響,所以下一步本研究將建立動物、細胞模型進行進一步的機制研究。

