2型糖尿病周圍神經(jīng)病變與內(nèi)臟脂肪面積的相關(guān)性
柳怡瑩 萬沁
【摘要】? 目的? 探討2型糖尿病(T2DM)患者周圍神經(jīng)病變(DPN)與內(nèi)臟脂肪面積(VFA)的相關(guān)性。方法? 選取2019年7月- 2021年5月來醫(yī)院就診的525例2型糖尿病(T2DM)患者為研究對象,根據(jù)是否合并DPN分為T2DM未合并DPN組332例(未合并組),T2DM合并DPN組193例(合并組)。收集各組患者的臨床資料,通過單因素分析及多因素Logistic回歸分析2型糖尿病患者周圍神經(jīng)病變與內(nèi)臟脂肪面積的關(guān)系。結(jié)果? 單因素分析結(jié)果顯示,兩組患者性別、舒張壓、收縮壓、病程、高密度脂蛋(HDL)、谷丙轉(zhuǎn)氨(ALT)、谷草轉(zhuǎn)氨酶(AST)、甘油三酯(TG)、總膽固醇(TC)、脂蛋白(LDL)、飲酒史比較,差異無統(tǒng)計學意義(P>0.05);而兩組患者年齡、空腹血糖、身體質(zhì)量指數(shù)(BMI)、空腹C肽、VFA、皮下脂肪面積、糖化血紅蛋白(HbA1c)、吸煙史、高血壓病史、高脂血癥病史比較,差異均有統(tǒng)計學意義(P<0.05)。多因素Logistic回歸分析顯示,在控制了組間有差別的因素后,VFA仍然與DPN有關(guān)系(P<0.05),VFA降低的T2DM患者,出現(xiàn)DPN的危險性增大。結(jié)論? VFA與DPN的發(fā)生有關(guān),VFA降低的T2DM患者,出現(xiàn)DPN的危險性增大。
【關(guān)鍵詞】? 2型糖尿病;糖尿病周圍神經(jīng)病變;內(nèi)臟脂肪面積
中圖分類號? R587.2? ? 文獻標識碼? A? ? 文章編號? 1671-0223(2024)05--03
糖尿病周圍神經(jīng)病變(DPN)是糖尿病常見并發(fā)癥之一,目前糖尿病患者中DPN患病率達60%~90%[1],已對人類健康造成極大威脅。DPN作為糖尿病常見慢性并發(fā)癥之一,與糖尿病其他常見慢性并發(fā)癥有著共同的致病機制。有研究發(fā)現(xiàn),內(nèi)臟脂肪組織產(chǎn)生的多種炎性因子、脂肪因子和血管活性肽等能導致心血管系統(tǒng)的炎性反應、氧化應激、結(jié)構(gòu)重塑和功能異常[2]。目前關(guān)于DPN與內(nèi)臟脂肪面積(VFA)的關(guān)系報道較少,基于此,本研究擬通過臨床病例對照研究,探討DPN與VFA的關(guān)系,從而為DPN的診療提供參考依據(jù)。
1? 對象與方法
1.1? 研究對象
選取2019年7月- 2021年5月來醫(yī)院就診的525例2型糖尿病(T2DM)患者為研究對象。納入標準:T2DM的診斷符合WHO(1999年)糖尿病診斷標準。排除標準:1型糖尿病;妊娠期糖尿病;糖尿病急性并發(fā)癥;嚴重動靜脈血管性病變;其他原因造成的DPN;藥物引起的神經(jīng)毒性作用。DPN是指在排除其他原因的情況下,糖尿病患者出現(xiàn)與周圍神經(jīng)功能障礙相關(guān)的癥狀,臨床表現(xiàn)為對稱性疼痛和感覺異常,下肢癥狀較上肢多見,診斷標準依據(jù)《糖尿病神經(jīng)病變診治專家共識(2021年版)》[3]。根據(jù)是否合并DPN分為T2DM未合并DPN組332例(未合并組),T2DM合并DPN組193例(合并組)。患者及其家屬知情同意,并簽署知情同意書。
1.2? 資料收集
收集患者性別、年齡、病程、血壓、高血壓病史、高脂血癥病史、吸煙史、飲酒史等指標,計算身體質(zhì)量指數(shù)(BMI);化驗室指標:包括糖化血紅蛋白(HbA1c)、谷丙轉(zhuǎn)氨酶(ALT)、谷草轉(zhuǎn)氨酶(AST)、甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、血糖、空腹C肽。
1.3? 測定方法
1.3.1? VFA和皮下脂肪面積測定? 患者檢查前約9小時囑禁止飲食,受診者仰面躺床上并保持安靜,使用DUALSCAN HDS-2000儀器測定。將腹測量單元裝在受診者身上,指導受診者呼吸,然后取下腹部測量單元,將生物電阻抗單元裝在受診者身上,指導患者呼吸。
1.3.2? 其他指標的測定? 患者采血前24小時禁食高脂飲食,早晨空腹采肘靜脈血,測定HbA1c、ALT、AST、TG、TC、HDL、LDL、血糖、空腹C肽。
1.4? 數(shù)據(jù)處理方法
采用SPSS 17.0統(tǒng)計學軟件進行數(shù)據(jù)分析,計量資料用“±s”表示,組間均數(shù)比較用t檢驗;計數(shù)資料計算百分率,組間率的比較用χ2檢驗;非正態(tài)分布計量資料以“中位數(shù)(四分位數(shù)間距)”表示,組間中位數(shù)比較采用秩和檢驗;兩變量間的相關(guān)性采用Spearman相關(guān)分析。多因素分采用Logistic回歸模型。P<0.05為差異有統(tǒng)計學意義。
2? 結(jié)果
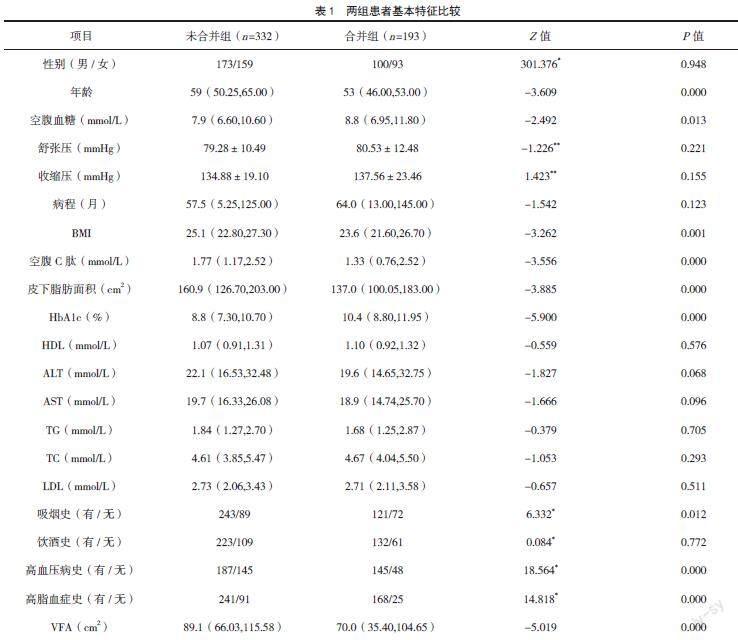
2.1? 兩組患者基本特征及VFA比較
兩組患者性別、舒張壓、收縮壓、病程、HDL、ALT、AST、TG、TC、LDL、飲酒史比較,差異無統(tǒng)計學意義(P>0.05);而兩組患者年齡、空腹血糖、BMI、空腹C肽、皮下脂肪面積、HbA1c、吸煙史、高血壓病史、高脂血癥病史比較,差異均有統(tǒng)計學意義(P<0.05)。合并組患者的VFA水平明顯低于未合并組,組間差異有統(tǒng)計學意義(P<0.05)。見表1。
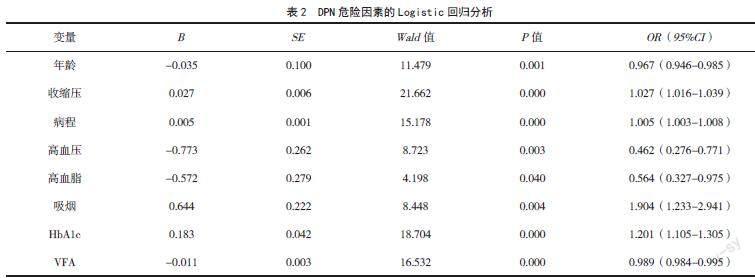
2.2? VFA與 DPN關(guān)系的多因素Logistic回歸分析
以是否合并DPN為因變量(是=1,否=0),以性別、年齡、空腹血糖、舒張壓、收縮壓、BMI、VFA、皮下脂肪面積、病程、高血壓病史、高脂血癥病史、抽煙史、飲酒史、空腹C肽、HbA1c、ALT、AST、TG、TC、HDL、LDL為自變量,進行多因素Logistic回歸分析。結(jié)果顯示,在控制了組間有差別的因素后,VFA仍然與DPN有關(guān)系(P<0.05),VFA降低的T2DM患者,出現(xiàn)DPN的危險性增大。同時發(fā)現(xiàn)年齡、病程、高血壓病史、高脂血癥病史、抽煙史、HbA1c是DPN的危險因素,差異有統(tǒng)計學意義(P<0.05)。見表2。
3? 討論
DPN是糖尿病最嚴重的并發(fā)癥之一[4],也是糖尿病患者常見的微血管并發(fā)癥[5],具有起病緩慢、隱匿性強、癥狀逐漸加重、不易逆轉(zhuǎn)、預后差的特點。目前關(guān)于DPN的發(fā)病機制尚未明確,普遍認為這是多種因素綜合作用的結(jié)果。除高糖外,還存在胰島素抵抗、氧化應激、異常代謝途徑(多元醇、己糖胺、糖基化終末產(chǎn)物形成等)激活、代謝異常、血管功能障礙、以及神經(jīng)生長因子缺乏、免疫損傷血脂紊亂、炎癥等多種因素參與[6-9]。本研究顯示,年齡、病程、高血壓病史、HbA1c等是DPN的危險因素,這可能是由于機體長期處于高糖環(huán)境下,致使微血管壁重構(gòu),微循環(huán)障礙,進而神經(jīng)纖維缺血缺氧,引發(fā)DPN[10-15]。
關(guān)于DPN與VFA的關(guān)系報道尚少且存在爭議。有研究表明[16-17],脂肪含量,尤其是VFA與慢性炎癥、脂肪細胞活躍等有關(guān),能增加包括IR、高血糖、血脂異常等多種代謝異常的風險,與心腦血管疾病關(guān)系密切,常用VFA來評估肥胖和脂肪分布[18]。Tae Jung Oh等[19]研究表明,DPN組的VFA高于無DPN組,表明其發(fā)生機制可能與胰島素抵抗有關(guān),胰島素抵抗表示低度炎癥水平,進一步影響內(nèi)皮功能紊亂[20]和微血管并發(fā)癥[21-22],從而使得DPN組VFA高于T2DM組。Shi Y等[23]表示內(nèi)臟脂肪可通過分泌多種代謝活性的脂肪因子作用于肥胖患者的脂肪組織的胰島素信號傳導通路,從而引起胰島素抵抗。李華峰等[24]則是選用65例臨床患者,對T2DM內(nèi)臟脂肪含量與胰島β細胞功能及胰島素抵抗的關(guān)系做了深入研究,發(fā)現(xiàn)內(nèi)臟脂肪含量是T2DM胰島素抵抗及B細胞功能變化的獨立影響因素,說明通過改變內(nèi)臟脂肪含量,降低體重可改善胰島素抵抗和胰島B細胞功能及敏感性,從而使得疾病有效緩解,達到糖尿病的有效控制。本研究中VFA和糖尿病DPN成反比,究其原因,可能是糖尿病患者長期高血糖激活巨噬細胞,引起氧化應激產(chǎn)生終末糖化蛋白(AGE)和AGE修飾蛋白受體,而AGE可促使巨噬細胞浸潤到神經(jīng)組織中,促使TNF-α的分泌,而過多的TNF-α負反饋抑制脂肪細胞的分泌,干擾內(nèi)臟脂肪的合成。亦或者是隨著年齡、糖尿病病程的延長內(nèi)臟脂肪量減少的反映,還推測不同測量VFA的方式使得數(shù)據(jù)的準確性不同也可能造成結(jié)果的不一致。
綜上所述,VFA與糖尿病DPN成密切相關(guān),控制血壓、血脂水平對改善糖尿病DPN是有效的,同時適時監(jiān)測VFA對評估糖尿病及其并發(fā)癥也有一定的參考價值。本研究通過對我國西南瀘州地區(qū)社區(qū)居民的研究得出,區(qū)域代表性有限,有待進一步開展深入廣泛的研究。
4? 參考文獻
[1] 廖鑫.冷啟書.陽琰等.血清內(nèi)臟脂肪素與糖尿病周圍神經(jīng)病變的相關(guān)性研究[J].中國糖尿病雜志,2016,24(6):524-527.
[2] 周潔,賈愛華,姬秋和.關(guān)注正常體質(zhì)量代謝性肥胖和體質(zhì)量波動帶來的影響[J].中華糖尿病雜志,2017,9(4):209-213.
[3] 中華醫(yī)學會糖尿病學分會神經(jīng)并發(fā)癥學組,時立新,朱大龍,等.糖尿病神經(jīng)病變診治專家共識(2021年版)[J].中華糖尿病雜志,2021,6:540-557.
[4] Vuong M Pham1,Shinji Matsumura2,Tayo Katano,etal.Diabetic neuropathy research: From mouse models to targets for treatment[J].Neural Regeneration Research,2019,14(11):1870-1879.
[5] 楊瑋,張倩為,陳巧云,等.2型糖尿病周圍神經(jīng)病變病人甲狀腺激素及抗體表達水平變化的研究[J].安徽醫(yī)藥,2022,26(4):697-701.
[6] 侯麗萍,谷巍,周立新,等.血清新喋呤、VEGF-B與新診斷2型糖尿病患者周圍神經(jīng)病變的相關(guān)性研究[J].轉(zhuǎn)化醫(yī)學雜志,2022,11(2):92-96.
[7] NatherA,LinWK,AzizZ,et al.Assessment of Sensory neuropathyin patients with diabetic foot problem[J].Diabetic Foot&Ankle,2011,2:3402.
[8] 焦書文,周亞茹,張曉陽,等.血清脂聯(lián)素水平和內(nèi)臟脂肪厚度與妊娠糖尿病的相關(guān)性研究[J].中國臨床醫(yī)生雜志,2019,47(11):1333-1336.
[9] 朱凌峰,血清同型半胱氨酸水平與H型高血壓合并2型糖尿病患者頸動脈內(nèi)膜中層厚度的相關(guān)性分析[J].醫(yī)學臨床研究,2019,36(6):1120-1122.
[10] 黃雪,張娟,趙曉宏.血同型半胱氨酸對2型糖尿病合并亞臨床甲減患者外周血管斑塊的臨床意義[J].中國醫(yī)師雜志,2021,23(3):379-383.
[11] 李苗苗,劉軍,丁和遠等.2型糖尿病周圍神經(jīng)病變的危險因素及神經(jīng)元特異性烯醇化酶的相關(guān)性[J].中國臨床醫(yī)學,2018,25(5),724-727.
[12] Bettini S,F(xiàn)avaretto F,Compagnin C,et al.Resting energy expenditure, insulin resistance and UCP1 expression in human subcutaneous and visceral adipose tissue of patients with obesity[J].Front Endocrinol(Lausanne),2019,10:548.
[13] Yen-Wei Pai,Ching-Heng Lin,Shih-Yi Lin,et al.Reconfirmation of newly discovered risk factors of diabetic peripheral neuropathy in patients with type 2 diabetes:A case-control study[J].PloS one,2019,14(7):e0220175.
[14] Silaghi CA,Silaghi H,Cr?ciun AE,et al.Age,abdominal obesity,and glycated hemoglobin are associated with carotid atherosclerosis in type 2 diabetes patients with nonalcoholic fatty liver disease[J].Med Ultrason,2015,17(3):300-307.
[15] Zhou YY,Qiu HM,Yang Y,et al.Analysis of risk factors for carotid intima-media thickness in patients with type 2 diabetes mellitus in Western China assessed by logistic regression combined with a decision tree model[J].Diabetol Metab Syndr,2020,12:8.
[16] AbrahamTM,PedleyA,MassaroJM,et al.Association betweenvisceral and subcutaneous adipose depots and incident cardiovascular disease risk factors[J].Circulation,2015,132:1639-1647.
[17] Tang L,Zhang F,Tong N,et al.The association of visceral adipose tissueand subcutaneous adipose tissue with metabolic riskfactors in a large population of Chinese adults[J].Clin Endocrinol(Oxf),2016,85:46-53.
[18] Yang S J,Li H R,Zhang W H,et al.Visceral Fat Area (VFA) superior to BMI for predicting postoperative complications after radical gastrectomy: A prospective cohort study[J].Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract,2020,24(6):1298-1306.
[19] Tae Jung Oh,Jie-Eun Lee,Sung Hee Choi,et al.Association between body fat and diabetic peripheral neuropathy in middle-aged adults with type 2 diabetes mellitus: A preliminary report[J].2019,28(2):112-117.
[20] Muniyappa R,Sowers JR.Role of insulin resistance in endothelial dysfunction[J].Rev Endocr Metab Disord,2013,14:5-12.
[21] Schram MT,Chaturvedi N,Schalkwijk CG,et al.EURODIAB prospective complications study group. Markers of inflammation are cross-sectionally associated with microvascular complications and cardiovascular disease in type 1 diabetes: The EURODIAB prospective complications study[J].Diabetologia,2005,48:370-378.
[22] Nguyen DV,Shaw LC,Grant MB.Inflammation in the pathogenesis of microvascular complications in diabetes[J].Front Endocrinol (Lausanne),2012,3:170.
[23] Shi Y,Vanhoutte P M.Macro‐ and microvascular endothelial dysfunction in diabetes[J].Journal of Diabetes,2017,9(5):434-449.
[24] 李華峰,張廣鳳,趙文杰等.2型糖尿病內(nèi)臟脂肪含量與胰島β細胞功能及胰島素抵抗的關(guān)系研究[J].現(xiàn)代生物醫(yī)學進展,2019,19(14):2740-2742,2759.
[2023-09-04收稿]

