制曲原料中添加綠茶對大曲發酵過程理化特征及細菌多樣性的影響
趙 亮,王新葉,羅貞標,江 璐,吳福勇,鐘艷霞,王相勇
(茅臺學院釀酒工程系,貴州 遵義 564507)
大曲作為白酒釀造的起始發酵劑,可為酒醅提供充足的酶系,如各類糖化酶、蛋白酶、纖維素酶等;另外還可引入種類多樣的功能性微生物。醬香型大曲以小麥作為唯一原料,經人工踩制成曲磚后,轉入曲倉進行為期40 d的開放式發酵,發酵完成后再經3~6 個月的儲存老熟方可投入使用[1]。近年來,利用高通量測序技術對大曲發酵過程進行多方面研究,結果發現原料和場地環境是大曲微生物的主要來源。此外,在發酵過程中,微生物新陳代謝產生的內源生物熱、大曲水分含量和酸度的變化,推動微生物間相互作用。在此過程中一些雜菌被消亡殆盡,而一些對釀酒有作用的微生物在大曲中被富集保留,最終形成穩定的功能微生物區系[2-5]。這些微生物區系在發酵過程中經自身代謝產生多種酶系、風味及其風味前體物質。其中產出的酶系具有糖化力、液化力、酯化力和蛋白質分解能力。可以將大曲原料中的大分子淀粉和蛋白質分解成小分子的還原糖和氨基酸,為微生物生長繁殖提供營養物質,并通過微生物代謝產生風味物質[6-8]。因此,大曲中微生物區系的組成和豐度水平對下游釀酒環節的代謝物形成及豐富度影響顯著。
茶葉是我國傳統飲品,具有多種保健功效,也是貴州省重要的經濟作物。鮮茶葉中有機成分主要包括纖維素、果膠質、蛋白質、咖啡堿、多元酚類、兒茶素、有機酸等[9]。茶葉經過發酵后,酚氨比降低,芳香類物質增加,能溶入許多微生物代謝活性物質以及微生物菌體,茶葉品質得以改善,例如普洱茶和黑茶。因此,茶葉的感官特性和化學成分和大曲類似,與微生物發酵密不可分。同時,大曲中發現的優勢微生物菌群與茶葉發酵過程中的優勢微生物菌群也有眾多相同之處[10-15]。在大曲原料中添加天然植物成分的代表是董香型白酒的小曲和大曲,曲中130余種天然植物的添加為成曲過程培養了大量有益微生物,并衍生出許多能夠強身健體的化合物和呈香、呈味物質,賦予了董酒神奇的綜合養生功能和幽雅舒適的天然香味。基于這個理念,白蕊[16]在清香型白酒的大曲原料中加入茶樹花,并進行相關研究,在加入茶樹花的成曲中檢測到茶樹花的一些特征香氣成分苯乙酮和α-苯乙醇等風味物質,豐富了清香型大曲的風味成分。因此,對于添茶曲的研究可為多原料制曲和茶葉在白酒釀造方面的應用提供理論依據和工藝指導。
綜上所述,本研究向醬香型大曲原料中加入一定比例的貴州綠茶,進行為期40 d的發酵,在此過程中對添加不同比例綠茶的大曲進行微生物群落和內源理化指標的綜合分析,旨在揭示發酵過程中:1)不同比例添茶曲理化因素和群落多樣性變化特征;2)茶葉添加比例對群落結構和演替的影響;3)驅動各添茶曲理化特征變化的重要菌群。
1 材料與方法
1.1 材料與試劑
硬質小麥來自貴州仁懷市有機小麥,綠茶為貴州省湄潭縣綠茶。
DNA提取試劑盒MP FastDNA?SPIN kit for soil美國MP Biochemicals公司;磷酸鹽緩沖液(phosphate buffer solution,PBS)、TBE(Tris-硼酸-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA))緩沖液、異丙醇(分析純)、瓊脂糖 北京索萊寶科技有限公司;引物合成 北京百邁客生物科技有限公司;鹽酸、碘化鉀、五水合硫酸銅、三水合六氰鐵酸鉀、三水合乙酸鈉、硫酸、冰乙酸 國藥集團化學試劑有限公司;氫氧化鈉、次甲基藍、葡萄糖、碘、酒石酸鉀鈉、可溶性淀粉 天津科密歐化學試劑有限公司。
1.2 儀器與設備
臺式高速冷凍離心機 德國Sigma 公司;Gene Amp?9700型聚合酶鏈式反應(polymerase chain reaction,PCR)儀 美國ABI公司;DYY-8C型電泳儀北京六一儀器廠;SW-CJ-1F型超凈工作臺 蘇州凈化設備有限公司;HH-6數顯恒溫水浴鍋 國華電器有限公司;Illumina MiSeq PE300測序平臺 北京百邁客生物科技有限公司;MDF-U54V醫用低溫箱 松下健康醫療器械株式會社;PHS-3C pH計 上海儀電科學儀器股份有限公司;DK-98-1電子萬用爐 天津市泰斯特儀器有限公司;FA2004N電子天平 上海菁海儀器有限公司;WP-CP-GHS-30微量分析型超純水機 四川沃特爾水處理設備有限公司;DGG-9140AD電熱恒溫鼓風干燥箱 上海森信實驗儀器有限公司;HH-6數顯恒溫水浴鍋 常州潤華電器有限公司;CL-2磁力加熱攪拌器 北京科偉永興儀器有限公司;ZNHW智能控溫電熱套 上海力辰邦西儀器科技有限公司。
1.3 方法
1.3.1 曲塊制備
以硬質小麥、綠茶為原料,如流程圖1A所示,按照傳統醬香大曲加工工藝(潤料、粉碎、拌料、成型、入倉發酵)[17],制成原曲(純小麥,不添加綠茶)、10%(按曲塊質量的10%添加綠茶)添茶曲、20%添茶曲(按曲塊質量的20%添加綠茶)和30%添茶曲(按曲塊質量的30%添加綠茶),共4 類曲,每類曲制作4 個曲塊。每個曲塊質量為1500 g,拌料加水675 g(水占曲塊總質量45%),母曲用量150 g(10%)。曲塊壓制好后,放入紙箱,模擬曲倉發酵。具體制備過程如圖1B所示,準備好原料綠茶和小麥,磨碎后(a~c)與母曲和水按比例拌合,拌合時根據實驗要求的茶葉添加量(0%、10%、20%和30%)制備曲塊拌料(d~e)。拌料結束后,將拌好的曲料放入模具手工壓制定型,制成四周緊、中間松的龜背形曲塊(f~i)。準備一紙箱用來模擬曲倉,箱底鋪滿稻草(作用同曲倉中的底草),曲塊用稻草包裹,采取平放的方式在箱中從下到上放置4 層,每層4 個曲塊,每層間再用鋪平的稻草相隔(j~k)。曲塊放置好后,箱口合攏,箱子側邊打孔,并從側孔置入溫度計,插入到曲塊中,用于監測曲塊溫度(l),開始為期40 d的發酵。


圖1 大曲制備流程(A)及制作過程(B)圖Fig.1 Flow chart of Daqu preparation process (A) and production procedures (B)
1.3.2 曲樣收集
4 類曲塊分別在入倉發酵的第1天(Day 1)、第6天(Day 6)、第12天(Day 12)、第15天(Day 15)、第30天(Day 30)和第40天(Day 40)進行取樣。取樣時分別在曲塊的上表面(隆起面向內1 cm)、下表面(曲底面向內1 cm)和曲心(曲塊中央)各取1 個部位的樣品,3 個部位樣品混合后作為對應時段的一個曲樣,每個時段收集3 個曲樣,最終獲得72 個(4 種類型曲×6 個時段×3 個曲樣)大曲樣品。
1.3.3 理化指標檢測
曲塊溫度從插入曲塊的溫度計直接讀取獲得。酸度、糖化力、淀粉質量分數和水分含量按照QB/T 4257—2011《釀酒大曲通用分析方法》進行測定[18]。
1.3.4 曲塊中微生物總DNA提取
參照戴奕杰等[19]方法對大曲樣品進行預處理。預處理后得到的細胞沉淀使用DNA提取試劑盒MP FastDNA?SPIN kit for soil,按說明書提示,提取大曲樣品中微生物細胞總DNA。
1.3.5 細菌16S rRNA基因擴增
使用引物319F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[20]對細菌16S rRNA基因V3~V4可變區進行擴增。擴增程序:98 ℃預變性30 s,35 個循環(98 ℃變性10 s,54 ℃退火30 s,72 ℃延伸45 s),72 ℃終延伸10 min。凝膠電泳:2%瓊脂糖凝膠,核酸染料(GenGreen),電壓90 V,電泳時間30 min。
1.3.6 Illumina MiSeq測序
采用Illumina二代測序技術,基于Illumina MiSeq PE300測序平臺,由北京百邁客生物科技有限公司完成測序。
1.3.7 測序數據處理
PE300雙端測序reads使用FLASH拼接,根據Barcode區分序列樣本來源。使用Trimmomatic v0.33軟件,對測序得到的Raw Reads進行過濾。Cutadapt 1.9.1軟件進行引物序列的識別與去除,得到不包含引物序列的Clean Reads。使用Usearch v10軟件,通過overlap對每個樣品的Clean Reads 進行拼接,然后根據不同區域的長度范圍對拼接后數據進行長度過濾。使用QIIME2中的DATA2插件進行去噪,雙端序列拼接并去除嵌合體序列,得到最終有效數據(Effective Reads),并獲得擴增子序列變異體(amplicon sequence variants,ASVs)。從每個ASV中選取質量最好的序列作為對應ASV的代表序列,以Silva(release 132)為參考數據庫使用樸素貝葉斯分類器對代表序列進行分類學注釋。生成的ASVs_table文件除去總序列數小于5的低豐度ASVs,并利用R軟件對ASVs序列數進行重抽樣,保證每個樣品的總序列數完全一致,最終獲得用于統計分析ASVs_table文件。
1.4 統計分析
理化指標組間差異性檢驗使用方差分析,組間兩兩比較使用最小顯著差異(least significant difference,LSD)法;α多樣性基于5 種指數,分別從群落成分(Shannon指數)、物種豐富度(Richness指數和Chao1指數)和系統進化多樣性(群落內的物種與其系統發育關系最近的物種間的距離(mean nearest taxon distance,MNTD)和最近親緣指數(nearest taxon index,NTI))[21-22]3 個角度來衡量。α多樣性指數組間差異性檢驗使用Kruskal-Wallis檢驗,組間兩兩比較使用Wilcoxon符號秩檢驗。理化指標與α多樣性之間相關性使用Spearman相關性檢驗進行分析。β多樣性基于表征系統進化演替的GUniFrac距離[23]和群落成分演替的Bray-Curtis距離衡量。β多樣性在組間的差異性分析基于非參數多元方差分析(Adonis)和相似性檢驗(Anosim),Adonis和Anosim模型顯著性均基于9999 次置換檢驗獲得。使用Bioenv[24]分析法篩選對系統進化演替存在顯著相關的理化指標,并將篩選出的指標整體轉化成歐氏距離,以表示大曲理化特征變化。使用隨機森林模型推斷驅動大曲理化特征變化的優勢屬。
上述所有統計、多樣性指數計算及相關作圖均使用R語言完成,涉及的主要軟件有BiodiversityR[25]、Vegan[26]、RAM[27]、OTUtable[28]、ggplot2[29]、agricolae[30]、picante[31]、A3[32]和rfPermute[33]。
2 結果與分析
2.1 理化指標變化趨勢
糖化力、溫度、淀粉質量分數、酸度和水分含量5 種指標的變化趨勢如圖2A(具體數值見表1),4 種曲雖然呈現出大致相似的變化趨勢,但在不同時段的高低水平存在顯著差異。4 種曲的糖化力從Day 1逐漸降至Day 12,且此階段始終原曲>10%添茶曲>20%添茶曲>30%添茶曲(P<0.001)。表明大曲中的耗氧微生物大量繁殖,致使溫度和酸度升高,曲塊中的微生物多樣性和數量減少,導致糖化力逐步下降;此外,茶葉添加量從10%至30%依次增多,致使各曲中淀粉比例相對減少,進而降低了淀粉中原有糖化酶含量,因此糖化力在Day 1至Day 12這個階段(即前緩期和中挺期),始終維持原曲>10%添茶曲>20%添茶曲>30%添茶曲的高低模式。Day 12至Day 40(即后緩落期),酸度和溫度逐漸下降,微生物在歷經曲內高溫和高酸后重啟生長,糖化力隨之回升,發酵結束的Day 40,糖化力表現出20%添茶曲>30%添茶曲>10%添茶曲>原曲的模式,且差異極顯著(P<0.001)。這個結果表明,在發酵的前緩和中挺期,大曲中淀粉的相對比例可能主導各時段的糖化力高低。一旦進入后緩落期,曲中經高酸和高溫篩選的微生物類群開始因茶葉比例的不同,在不同曲塊中形成特定群,進而主導各時段糖化力的高低。水分含量從Day 1至Day 40始終呈現下降趨勢,且從Day 6至Day 40均表現出20%添茶曲>10%添茶曲>30%添茶曲>原曲的模式,說明添加茶葉可以提高大曲的持水性,且20%的添茶比例對大曲的持水作用最強。酸度在起始發酵Day 1時30%添茶曲>20%添茶曲>10%添茶曲>原曲,雖發酵過程4 類曲酸度高低有變動,但發酵結束時4 類曲的酸度仍恢復到起始時的水平,這可能與茶葉中本身的有機酸含量有關,即添茶比例越高,酸度隨之增高。4 類曲溫度變化趨勢相同,且各階段沒有表現出明顯的溫度區別。
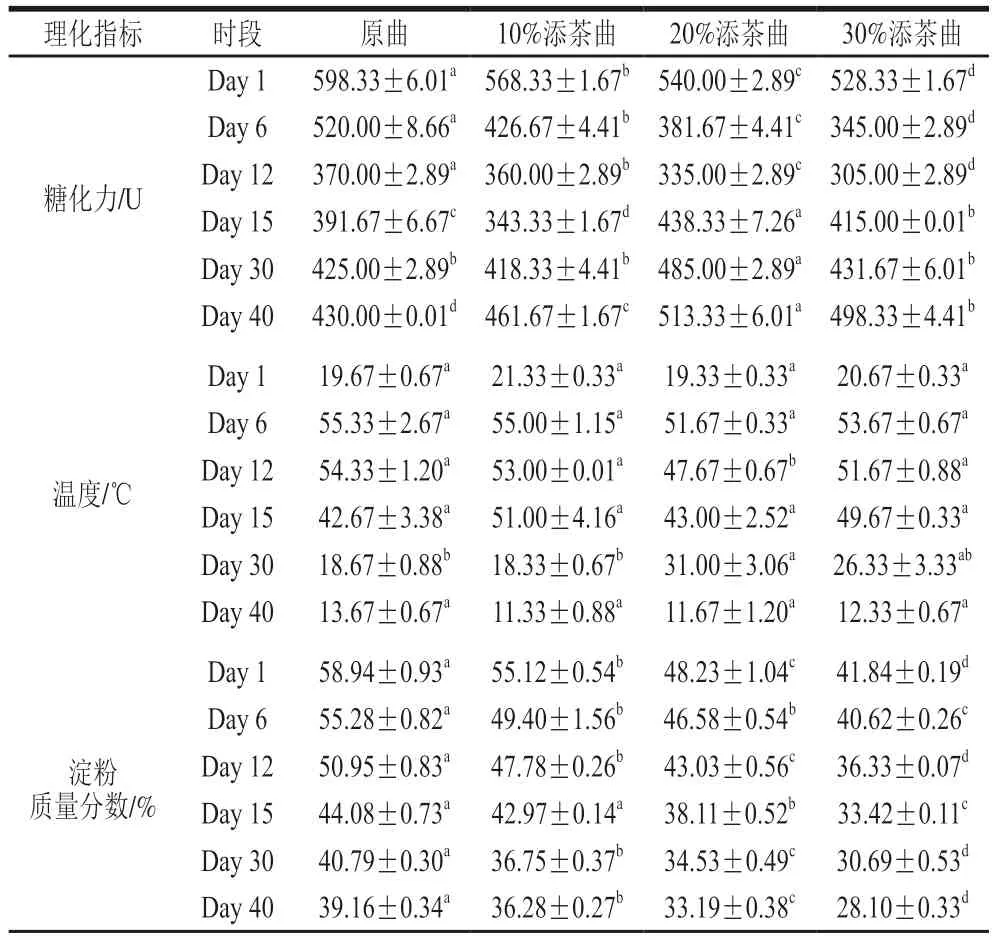
表1 各類曲理化指標Table 1 Physicochemical indicators of Daqu during fermentation
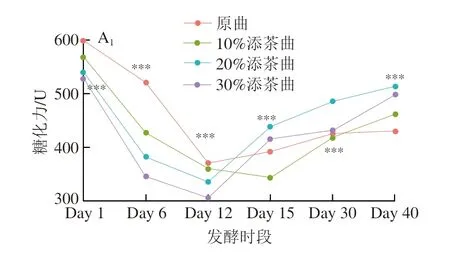
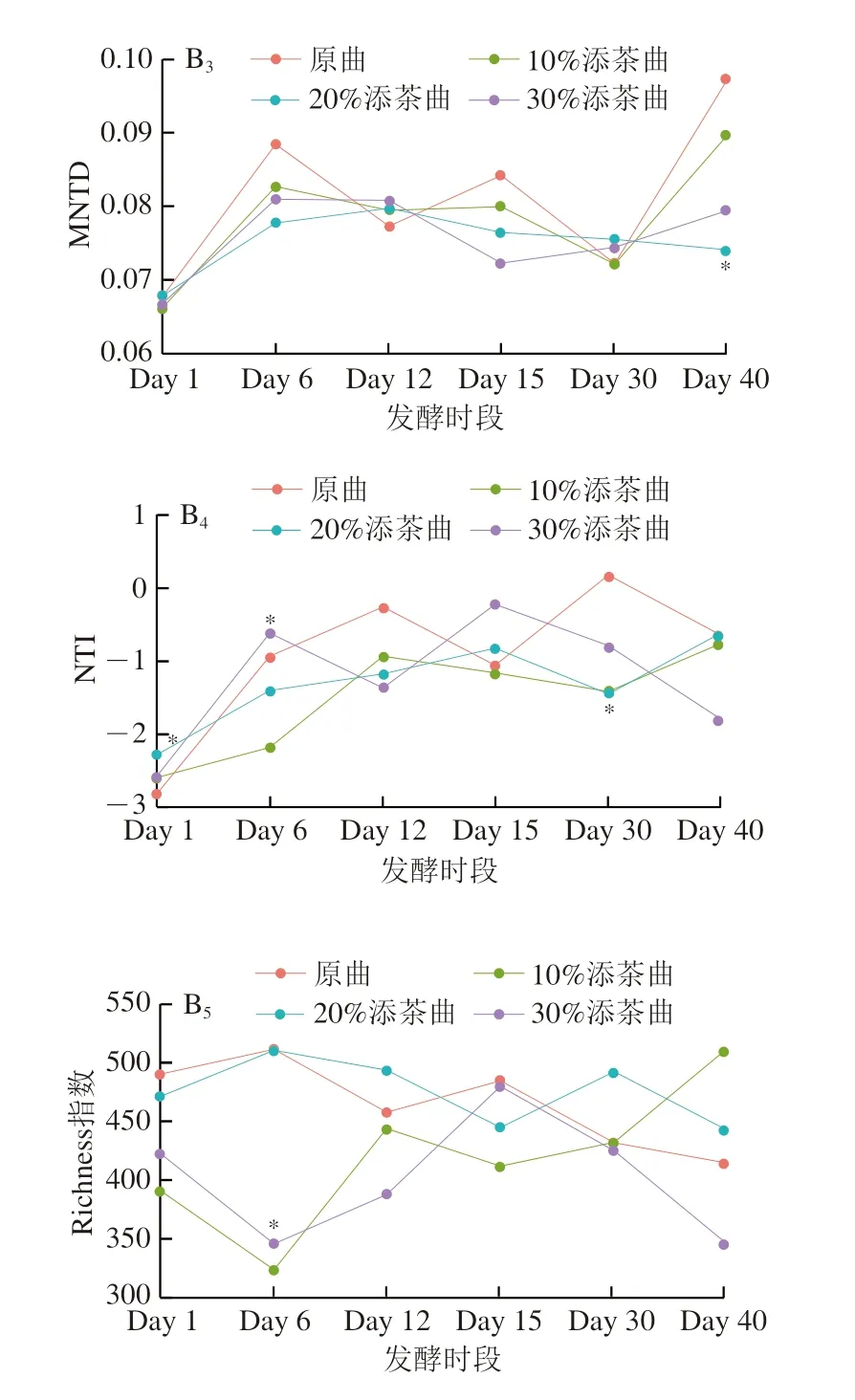
圖2 各類曲理化指標(A)和α多樣性指數(B)變化趨勢圖Fig.2 Trends of physicochemical parameters (A) and α diversity indices (B) of Daqu during fermentation
2.2 群落多樣性
2.2.1α多樣性分析
如圖2B所示(具體數值見表2),4 類大曲在5 種多樣性指數上的變化趨勢均表現出一定的不同,并且利用Kruskal-Wallis檢驗發現,Shannon、Chao1、MNTD、Richness和NTI各指數分別在Day 1、Day 6、Day 30和Day 40這4 個時段展現出不同的差異變化,說明大曲原料中加入茶葉可改變曲中微生物的群落演替特征,且這種變化與原料中加入茶葉的相對含量有關。不同曲間Shannon和NTI兩種指數在Day 1存在顯著性差異(P<0.05),10%添茶曲的Shannon指數最高,并顯著高于原曲(P<0.05,Wilcoxon符號秩檢驗);20%添茶曲的NTI最高,并顯著高于原曲(P<0.05);原曲的Shannon指數和NTI最低。這些結果表明茶葉的加入可引入更豐富的微生物成分,提供群落組成多樣性,并同時減弱近緣物種的聚集程度,從群落組成和譜系豐富度兩方面提高曲中群落多樣性。此外還發現,原料中茶葉的加入量并不與多樣性呈比例關系,如Day 1時,10%添茶曲的Shannon指數最高(4.18±0.50),其次為30%添茶曲(3.73±0.52),以及20%添茶曲(3.47±0.58);Day 6時,20%添茶曲和原曲的Richness均顯著高于10%和30%添茶曲。這說明大曲中微生物多樣性的高低與大曲中小麥和茶葉的相對比例關系緊密。綜合上述結果可以說明,原料中加入茶葉可以改變大曲起始發酵時的群落結構,且加入茶葉的比例不同,會出現不同水平的群落多樣性,并使發酵全過程群落演替規律出現不同的趨勢。在先前研究中,曾在小麥中摻入其他淀粉類原料,如青稞、紫小麥等,可以提高大曲中群落多樣性水平[17]。類似地,曾橋等[10]利用不同原料在同一加工條件下發現茯磚茶活性成分和微生物多樣性呈顯著差異。本研究使用茶葉這種非淀粉類原料進行研究,同樣發現可改變大曲中微生物多樣性水平,表明無論是淀粉類或是茶葉這種纖維素類原料,與小麥進行多原料制曲,都對微生物群落多樣性和發酵演替規律影響顯著。
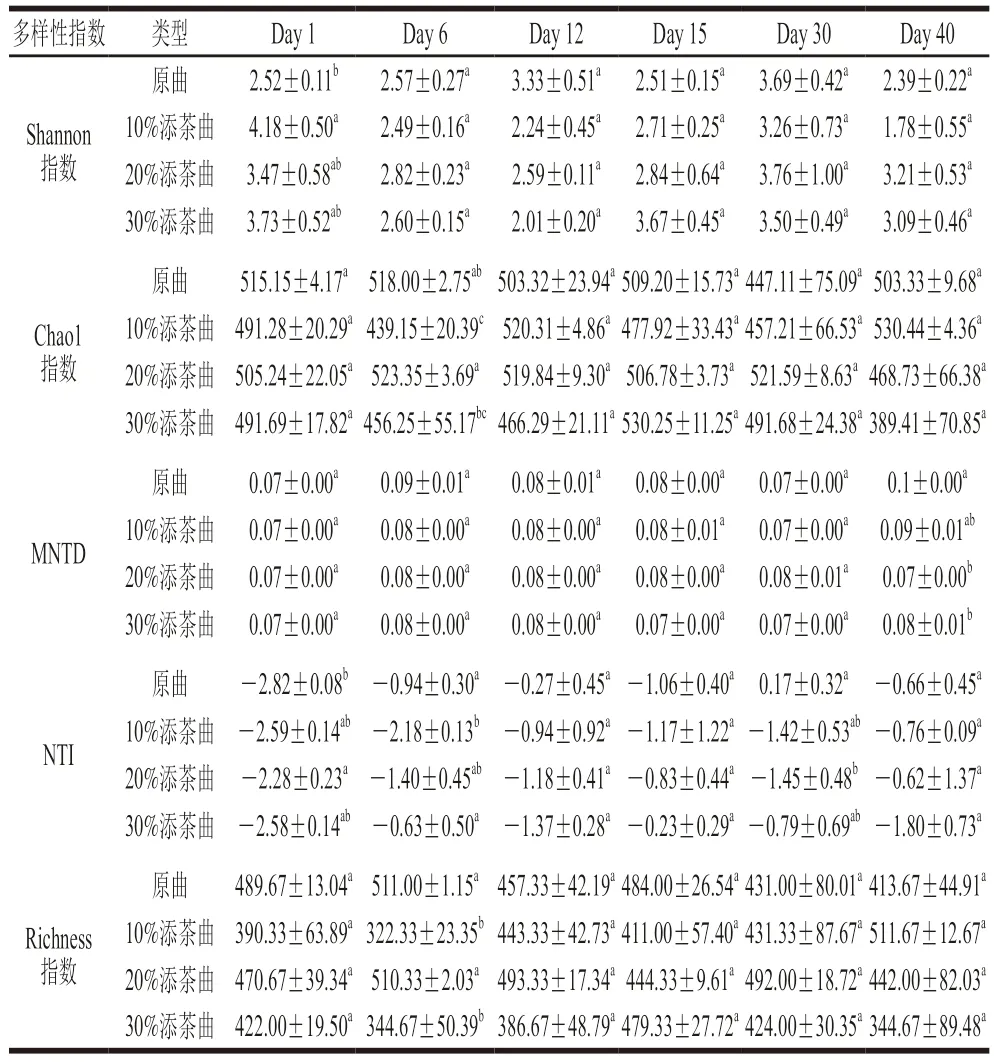
表2 各類曲α多樣性指數Table 2 α Diversity indices of Daqu at different fermentation times
2.2.2 理化指標與α多樣性相關性
理化指標與5 種多樣性指數間Spearman相關性如圖3所示。除溫度外,其他理化指標與Shannon、Richness、NTI和MNTD各指數在4 種曲中存在不同程度的相關性,說明溫度不是影響各4 類曲群落多樣性特征的決定因素。此外,表征群落內個體間譜系距離的MNTD在4 類曲中均存在顯著相關,表明各類曲中特有的微生物系統進化結構是影響大曲理化特征變化的主要因素。MNTD與酸度僅在添茶曲中存在顯著相關,且為正相關(r=0.60~0.66,P<0.05),表明添茶曲的酸度變化可能除了與茶葉本身引入的有機酸有關外,還與茶葉引入的特定微生物區系有關,且微生物個體間譜系越遠緣,酸度越高。從而隨著MNTD的升高,添茶量較多的20%和30%添茶曲中的糖化力顯著降低(r=-0.55~-0.52,P<0.05)。表征群落譜系聚集程度的NTI同時與原曲和10%添茶曲的淀粉和水分含量呈顯著負相關(r=-0.55~-0.49,P<0.05)。NTI越高則群落譜系聚集程度越弱,相反會使曲內的淀粉和水分含量降低,表明群落譜系聚集程度的減弱可能會增加發酵過程淀粉消耗量和水分散失。
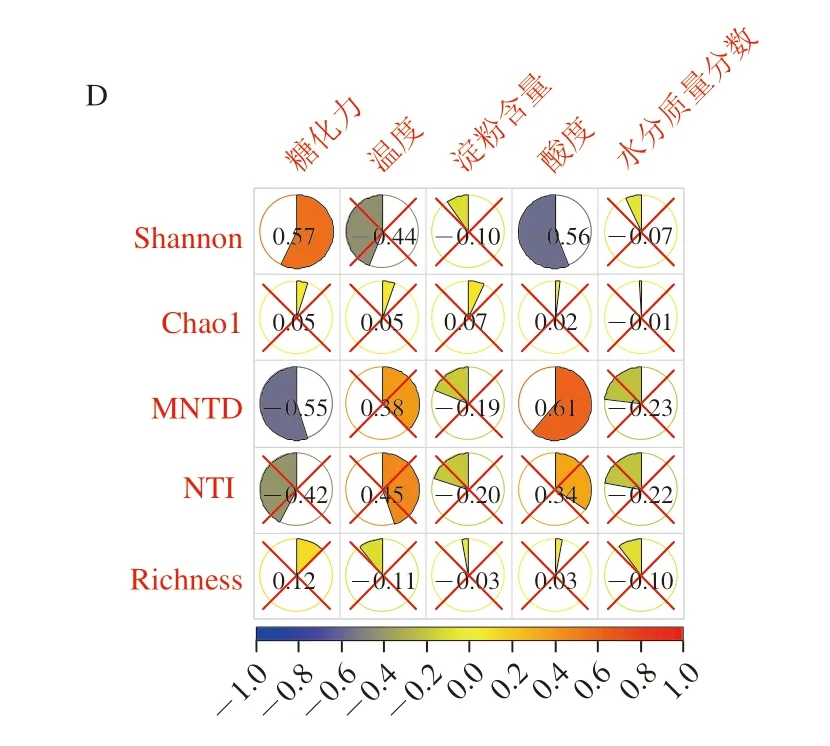
圖3 各類曲理化指標與α多樣性指數間Spearman相關性熱圖Fig.3 Heatmaps showing Spearman correlations between physicochemical parameters and α-diversity indices of Daqu
2.2.3β多樣性
Adonis多元方差分析對整個數據集檢驗結果顯示,大曲類型(GUniFrac:R2=0.06,P=0.012;Bray-Curtis:R2=0.13,P<0.001)、發酵時段(GUniFrac:R2=0.33,P<0.001;Bray-Curtis:R2=0.34,P<0.001),以及兩者交互效應(GUniFrac:R2=0.19,P=0.020;Bray-Curtis:R2=0.20,P<0.001)對β多樣性均存在顯著性貢獻,表明不同大曲在發酵過程中可形成特定的群落結構。按發酵時段對整個數據集分割,使用Adonis多元方差分析和相似性檢驗(Anosim)進一步分析各時段不同大曲間群落結構差異(表3),發現在Day 6、Day 12和Day 40這3 個時段兩類距離矩陣都呈現顯著性差異,且Bray-Curtis距離矩陣在Day 15也出現顯著性差異。這個結果進一步體現,在發酵的中挺期和后緩落階段,不同大曲間的群落會發生顯著分化。
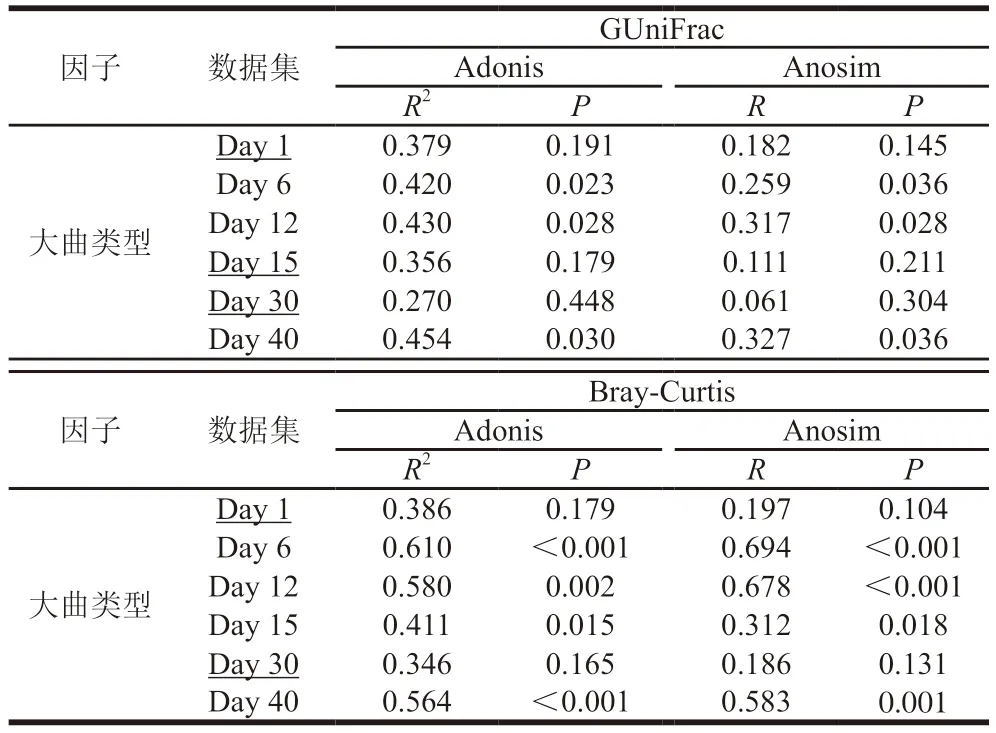
表3 各類曲在不同時段群落結構差異性分析Table 3 Analysis of difference in community structure between different Daqu samples at fermentation time
2.3 群落結構與演替
2.3.1 群落結構特征
4 類曲中共有4 種相對豐度>1%的優勢門,分別為變形桿菌門(Proteobacteria;各類曲中總占比48.0%~59.7%)、厚壁菌門(Firmicutes;32.4%~44.8%)、擬桿菌門(Bacteroidota;2.6%~4.1%)和放線菌門(Actinobacteriota;2.0%~2.6%),這些優勢門在先前針對多原料制曲[17]、茶葉發酵[10],以及酒醅[34]的研究中也被發現是重要的優勢菌群,表明無論是原曲、添茶曲,甚至是酒醅中,優勢門相似。然而,它們在各曲中豐度變化趨勢明顯不同(圖4)。以厚壁菌門為例,在原曲中Day 1時相對豐度最低,僅占5.4%,到Day 6升至全時段最高60.5%,從Day 12到Day 40變化幅度不明顯,維持在41.0%~49.5%之間;在10%添茶曲中,Day 1時相對豐度最低(17.5%),之后逐漸上升,Day 6至Day 15維持在60.8%~61.7%,之后從Day 30的72.5%升至Day 40的84.9%。其他各門類菌群,在不同曲間也同樣表現出演替趨勢的不同。這些結果說明,雖然各類曲優勢門相同,但茶葉添加量的不同,會促使起初引入的微生物“種子”隨發酵推進出現演化。此外,茶葉添加量的不同會使各類曲初始理化特征出現顯著區別,并在發酵進程中與微生物相互作用,促使理化特征進一步分化,最終使各類曲之間群落多樣性和理化特征出現顯著區別。
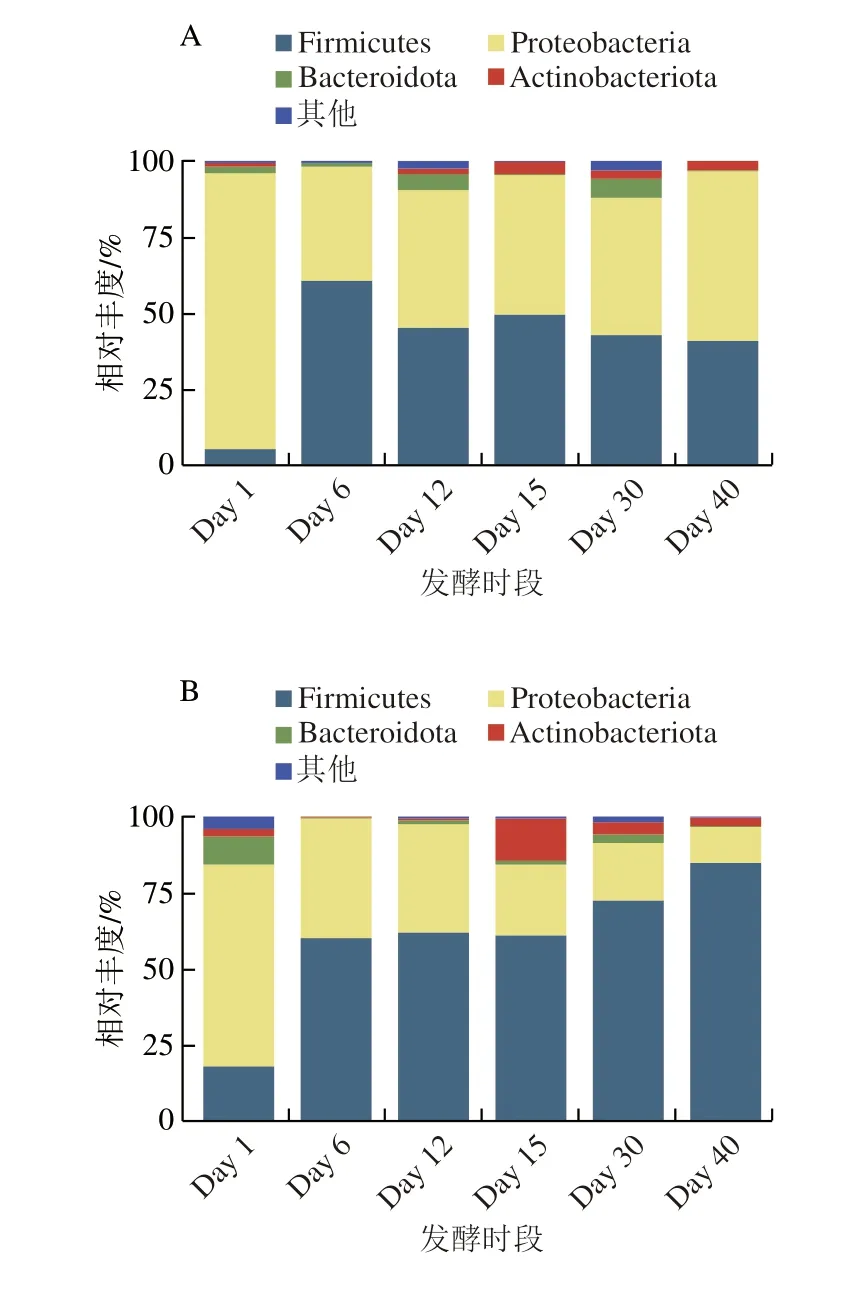
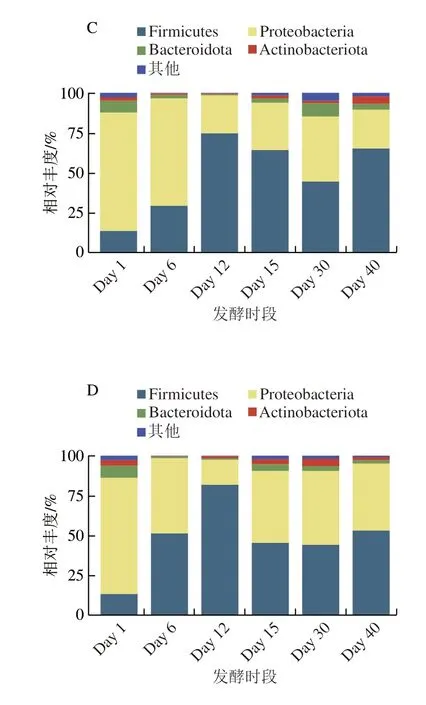
圖4 各類曲發酵過程中優勢門相對豐度圖Fig.4 Relative abundance of dominant phyla in Daqu during fermentation
2.3.2 驅動大曲群落演替及理化特征變化的菌群因素
為確定驅動群落演替的主要菌群,利用Mantel相關性檢驗分析各優勢門對群落系統進化演替(GUniFrac距離)的影響。結果如表4所示,4 種優勢門對各曲中群落系統進化演替均存在不同的影響。變形桿菌門對4 類曲均有顯著影響,且對10%添茶曲影響最大(r=0.666),而對原曲影響最小(r=0.345)。厚壁菌門和擬桿菌門除對10%添茶曲無顯著影響外,對其他各曲均有顯著影響,但影響程度不同。如厚壁菌門對原曲影響最大(r=0.577),其次為30%和20%添茶曲;擬桿菌門對30%添茶曲影響最大(r=0.750),其次為20%添茶曲和原曲。放線菌門僅對10%添茶曲有顯著影響(r=0.739),對其他曲無顯著影響。這些結果表明,驅動10%添茶曲群落演替的菌群明顯區別于其他3 類曲。此外,雖然原曲、20%和30%添茶曲在驅動菌群上相同(均為變形桿菌門、厚壁菌門和擬桿菌門),但受到的影響卻存在區別。這些結果說明在大曲發酵過程中,因茶葉添加量的不同,促使曲內群落結構出現分化,且驅動各類曲群落演替的細菌區系有一定的獨特性,從而推動大曲理化特征產生特定的變化。

表4 各類曲中優勢門與群落系統進化演替間Mantel相關性檢驗Table 4 Mantel correlation between difference in relative abundances of dominant phyla and GUniFrac distances for each Daqu
為探索驅動大曲理化特征變化特定菌群,針對各曲抽取上述Mantel檢驗中存在顯著影響的分類門中的優勢屬(相對豐度>0.5%),形成各優勢屬的豐度差異性矩陣;其次,利用Bioenv分析法篩選各曲中與系統進化演替存在顯著相關的理化指標,并將這些指標轉化成歐氏距離,以表征理化特征變化;最終使用隨機森林模型確定對大曲理化特征變化存在顯著貢獻的優勢屬。實驗發現,共有18 個優勢屬分別在不同曲中存在顯著貢獻,且在各類曲中貢獻程度也不盡相同(圖5)。在原曲中,有12 個類群對理化特征變化有顯著貢獻,其中Pseudomonas(假單胞菌,61.6%)、unclassified_Erwiniaceae(埃文氏菌科未鑒定屬,60.8%)和Bacillus(芽孢桿菌,60.1%)相對重要度較高,是最主要的貢獻菌群。10%添茶曲中,有5 個類群有顯著貢獻,其中假單胞菌(66.1%)和Sphingomonas(鞘氨醇單胞菌,51.2%)是最主要的貢獻菌群。20%添茶曲中,有13 個類群有顯著貢獻,其中乳酸菌Weissella(魏斯氏菌,89.8%)和Pediococcus(片球菌,51.4%)是最主要的貢獻菌群。30%添茶曲中,有9 個類群存在顯著貢獻,其中芽孢桿菌(69.8%)相對重要度明顯高于其他類群,是最主要的貢獻菌群。這些有顯著貢獻的菌群,除Vibrio(弧菌)外,在先前關于大曲和茶葉的報道中均有發現[10-16],表明原曲和添茶曲的優勢屬有相似之處,但茶葉添加比例的差異使驅動曲塊理化性質的優勢菌群存在較大區別。在以后的研究中,可進一步分析這些高貢獻菌群與茶曲之間的代謝作用關系,明確其中隱藏的機理,為添茶曲的工藝優化,甚至是多原料制曲提供理論基礎。
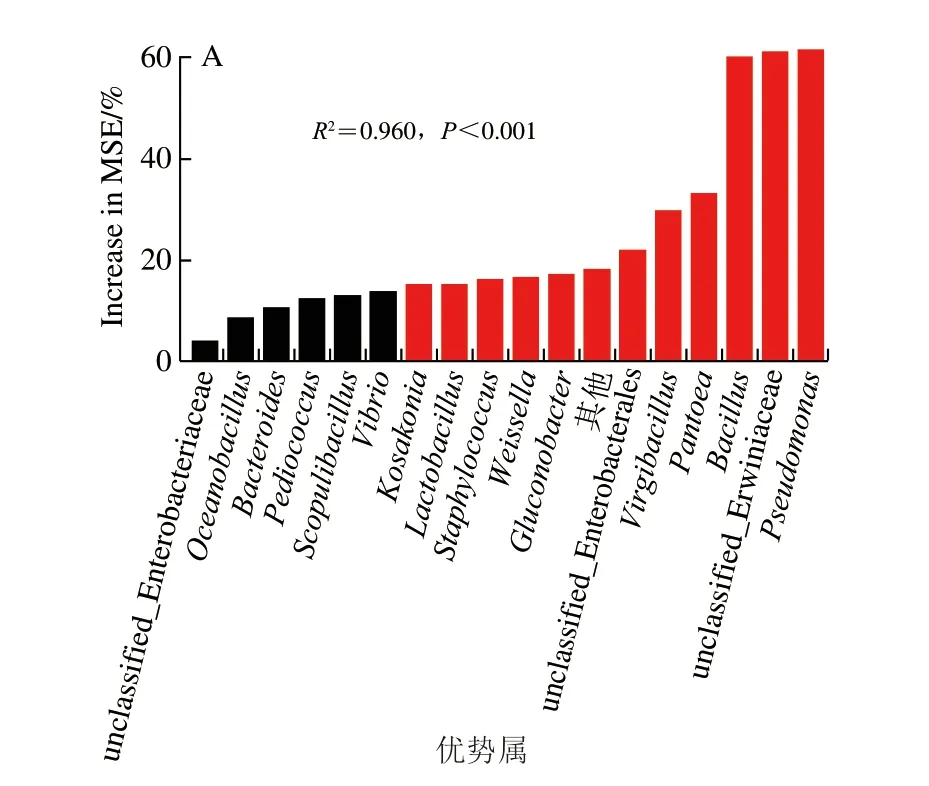
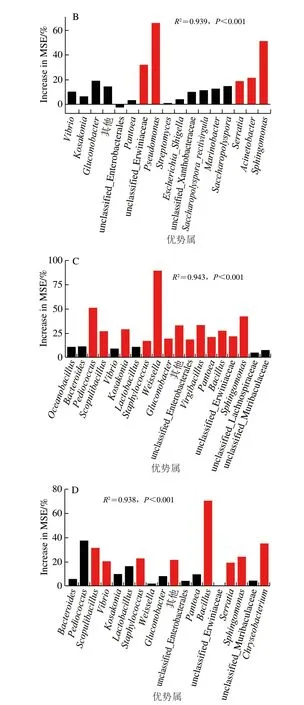
圖5 隨機森林模型呈現各類曲中驅動理化特征變化的優勢屬Fig.5 Random forest models displaying the potential drivers of variation in physicochemical properties of each Daqu
3 結論
本研究利用高通量測序技術結合大曲理化指標測定,通過一定數理統計手段系統揭示了添加不同比例綠茶對大曲發酵過程中細菌多樣性及演替、大曲理化特征及群落結構變化的影響,并得出相應結論。在制曲過程中添加茶葉可以顯著增加大曲發酵后的糖化力、水分含量和酸度水平。特別是添加20%茶葉可以使大曲發酵后的糖化力和水分含量達到最高水平,而30%茶葉則使大曲發酵后的酸度達到最高水平。茶葉的添加可以提高曲中細菌多樣性水平,并改變群落的演替規律。然而,茶葉添加比例與群落多樣性的高低并不呈比例關系。曲中特有的微生物系統演化結構是影響大曲發酵過程理化特征變化的主要因素,尤其對于添茶曲的酸度變化具有顯著影響。中挺期原曲和添茶曲開始出現群落結構分化,并且在發酵結束時形成各自獨特的群落區系。變形桿菌門、厚壁菌門、擬桿菌門和放線菌門對不同類別曲的群落結構演替存在不同程度的影響,而驅動10%添茶曲群落演替的菌群與其他3 類曲明顯不同。驅動大曲理化特征變化的菌群在4 個類別之間存在較大差異。其中,假單胞菌是原曲和10%添茶曲中的重要驅動菌群,魏斯氏菌和片球菌兩類乳酸菌是20%添茶曲的重要驅動菌群,芽孢桿菌則是30%添茶曲的重要驅動菌群。

