香豆素通過調控組蛋白去甲基化酶3 和骨髓分化蛋白2 改善膿毒癥相關AKI的機制研究
金光軍 趙金凱 徐步海 張建成 潘旭鳴 季明霞
膿毒癥是由微生物感染引起的播散性炎癥反應,易引發(fā)膿毒癥相關急性腎損傷(acute kidney injury,AKI)[1]。目前,AKI 除 透 析 外 沒 有 更 好 的 治 療干預措施,因此,迫切需要新的治療干預措施來阻止或緩解AKI 的發(fā)生、發(fā)展。香豆素(scoparone,Sco)是來自中藥地膚中的一種活性物質,在多種疾病中顯示出抗炎、抗氧化作用。如Sco 可以改善非酒精性脂肪性肝炎小鼠的肝臟炎癥和自噬[2],還能抑制IL-1β 誘導軟骨細胞中誘導型一氧化氮合酶和環(huán)氧合酶2 的表達,從而減輕軟骨細胞的炎癥反應[3]。此外,Sco 還通過抑制Ras 相關C3 肉毒毒素底物1 介導的氧化應激來減輕血管緊張素Ⅱ誘導的心肌肥大和炎癥反應[4]。但Sco 對AKI 的作用機制尚未闡明。組蛋白去甲基化 酶3(jumonji domain-containing protein 3,JMJD3)和骨髓分化蛋白2(myeloid differentiation protein-2,MD-2)均是膿毒癥中起促炎作用的關鍵分子,但JMJD3 與MD-2 在AKI 中的具體作用有待進一步闡明。本研究擬通過體內外實驗探究Sco 對膿毒癥相關AKI 的作用,同時對Sco 治療膿毒癥相關AKI的機制進行闡釋,旨在為治療膿毒癥相關AKI 的新藥研發(fā)提供參考。
1 材料和方法
1.1 實驗動物及細胞 6~8 周齡C57BL6 雄性小鼠24只購自杭州醫(yī)學院實驗動物中心,許可證號:SYXK(浙)2019-0011。所有小鼠飼養(yǎng)在SPF 級動物房,正式實驗前小鼠適應性飼養(yǎng)1 周。本實驗經浙江省實驗動物中心實驗動物福利倫理委員會審查通過(批準文號:ZJCLA-IACUC-20020102)。人腎小管上皮細胞系HK-2(批號:BNCC339833)來自北京北納創(chuàng)聯(lián)生物科技有限公司。
1.2 試劑及儀器 小鼠血肌酐(serum creatinine,Scr)(批號:ml037726)、血尿素氮(blood urea nitrogen,BUN)(批號:ml076479)均購自上海酶聯(lián)生物科技有限公司;抗體JMJD3(批號:3457S)購自美國Cell Signaling Technology 公司;抗體MD-2(批號:ab24182)購自英國Abcam 公司;脂多糖(lipopolysaccharides,LPS)(批號:L8880)、HE 染色試劑盒(批號:G1120)、高效RIPA 蛋白裂解液(批號:R0010)、BCA 蛋白濃度檢測試劑盒(批號:PC0020)、ECL 化學發(fā)光法檢測試劑盒(批號:SW2010)均購自北京索萊寶科技有限公司;Sco 粉劑(批號:HY-N0228)購自美國MedChemExpress 公司;RPMI 1640 培養(yǎng)基(批 號:11875093)、FBS(批號:30044333)均購自美國Thermo Fisher Scientific 公司;JMJD3 質粒由吉瑪基因(蘇州)合成;原位末端轉移酶標記法(TdT-mediated dUTP-biotin nick end labeling,TUNEL)試劑盒(批號:12156792910)購自美國Roche公司;化學發(fā)光成像系統(tǒng)(型號:ChemiScope 6200)購自上海勤翔科學儀器有限公司;酶標儀(型號:1681130 iMarkiMark)購自美國BIO-RAD 公司;熒光顯微鏡(型號:dm6000)購自美國Leica 公司;流式細胞儀(型號:CytoFLEX CytoFLEX)購自貝克曼庫爾特國際貿易(上海)有限公司。
1.3 動物分組和模型構建 采用隨機數(shù)字表法將小鼠分為對照組、LPS 組、LPS+40 mg/kg Sco 組和LPS+80 mg/kg Sco 組,每組6 只。除對照組外,其余3 組小鼠腹腔注射LPS 10 mg/kg(100 mg LPS 溶于20 mL 的0.9%氯化鈉注射液)建立膿毒癥相關AKI 模型。造模成功后,LPS+40 mg/kg Sco 組和LPS+80 mg/kg Sco 組分別腹腔注射Sco 40 mg/kg(50 mg Sco 粉劑溶于1 mL DMSO,0.8 mL/kg)和80 mg/kg(50 mg Sco 粉劑溶于1 mL DMSO,1.6 mL/kg),連續(xù)3 d。對照組小鼠腹腔注射0.9%氯化鈉注射液2 mL/kg。3 d 后,將所有小鼠麻醉,收集血液樣本并進行安樂死,采集小鼠腎臟組織,待下一步檢測。
1.4 細胞分組和模型構建 HK-2 細胞置于含10%FBS、100 U/mL 鏈霉素和100 U/mL 青霉素的RPMI 1640 培養(yǎng)基中,37 ℃,5%CO2的條件下進行培養(yǎng)。細胞實驗包 括 兩個部分:(1)分為Control 組、LPS 組、LPS+30 μmol/L Sco 組和LPS+60 μmol/L Sco 組,LPS 組使用1 μg/mL LPS 處理HK-2 細胞24 h;對照組不用LPS 處 理;LPS+30 μmol/L Sco 組 在LPS 誘導HK-2 細胞前,給予30 μmol/L Sco 干預24 h;LPS+60 μmol/L Sco 組在LPS 誘導HK-2 細胞前,給予60 μmol/L Sco 干預24 h。(2)分為LPS 組、LPS+60 μmol/L Sco 組、LPS+60 μmol/L Sco+過表達對照(oe-NC)組和LPS+60 μmol/L Sco+過表達JMJD3(oe-JMJD3)組,LPS 組使用1 mg/L LPS 處理HK-2 細胞24 h;LPS+60 μmol/L Sco 組在LPS誘導HK-2 細胞前,給予60 μmol/L Sco 干預24 h;LPS+60 μmol/L Sco+oe-JMJD3 組在Sco 干預后在細胞中轉染JMJD3 質粒;LPS+60 μmol/L Sco+oe-NC 組在Sco 干預后在細胞中轉染空白質粒載體。HK-2 細胞按3×105個/mL 接種于6 孔板中,在細胞融合度達到60%~80%時,更換為含JMJD3 質粒的腺相關病毒的無血清培養(yǎng)基,24 h 后更換為完全培養(yǎng)基。
1.5 小鼠觀測指標
1.5.1 小鼠腎臟組織形態(tài)觀察 采用HE 染色。小鼠安樂死后,將各組小鼠腎臟用4%多聚甲醛固定24 h,石蠟包埋,5 μm 厚切片,二甲苯脫蠟,與蘇木精室溫下孵育5 min,洗滌后使用伊紅在室溫下孵育約2 min。顯微鏡下觀察腎臟組織的病理變化并拍照。
1.5.2 小鼠腎臟組織細胞凋亡水平檢測 采用TUNEL 染色。取各組小鼠腎臟組織石蠟切片,將50 μL TDT 酶混合物(TDT 酶∶熒光標記液=1∶9)滴加至切片表面,37 ℃孵育1 h,PBS 洗3 次,5 min/次,熒光顯微鏡下觀察并拍照。
1.5.3 小鼠腎功能指標Scr、BUN 水平檢測 采用ELISA 法。嚴格按照ELISA 試劑盒操作說明書檢測小鼠血清中Scr 和BUN 水平。
1.5.4 小鼠腎臟組織JMJD3 和MD-2 蛋白表達水平檢測 采用Western blot 法。使用蛋白質裂解緩沖液提取小鼠腎臟組織總蛋白,離心后收集上清液。用BCA蛋白濃度檢測試劑盒檢測蛋白質濃度。制備十二烷基硫酸鈉-聚丙烯酰胺凝膠并用于電泳。將蛋白轉移到聚偏二氟乙烯膜上,并在室溫下用5%脫脂牛奶封閉2 h。隨后加入一抗(抗JMJD3、抗MD-2),4 ℃下孵育12 h。加入二抗并在室溫下孵育1.5 h。采用ECL化學發(fā)光法檢測試劑盒進行化學發(fā)光檢測。使用Image J 軟件計算各組灰度值,蛋白相對表達水平=各組灰度值/第1 泳道對照組平均灰度值。
1.6 細胞觀測指標
1.6.1 細胞凋亡水平檢測 采用流式細胞術。收集細胞并調整濃度為1×106個/mL,4 ℃下70%冰冷乙醇固定過夜。用PBS 洗滌后,將細胞與Annexin Ⅴ和碘化丙啶染色溶液混合,在室溫下孵育30 min,然后用流式細胞儀檢測細胞凋亡水平。
1.6.2 細胞JMJD3 和MD-2 蛋白表達水平檢測 采用Western blot 法。在細胞中添加蛋白質裂解緩沖液,離心后收集上清液。用BCA 蛋白濃度檢測試劑盒檢測蛋白質濃度。制備十二烷基硫酸鈉-聚丙烯酰胺凝膠并用于電泳。將蛋白轉移到聚偏二氟乙烯膜上,并在室溫下用5%脫脂牛奶封閉2 h。隨后加入一抗(抗JMJD3、抗MD-2),4 ℃下孵育12 h。加入二抗并在室溫下孵育1.5 h。采用ECL 化學發(fā)光法檢測試劑盒進行化學發(fā)光檢測。使用Image J 軟件計算各組灰度值,蛋白相對表達水平=各組灰度值/第1 泳道對照組平均灰度值。
1.7 統(tǒng)計學處理 采用SPSS 22.0 和GraphPad Prism 6.0 統(tǒng)計軟件。計量資料多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。所有實驗重復3 次。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 小鼠觀測指標
2.1.1 Sco 對小鼠腎臟組織損傷的影響 HE 染色結果顯示,對照組小鼠腎臟組織未發(fā)現(xiàn)明顯病理變化;與對照組相比,LPS 組小鼠腎臟組織有明顯的病理變化,部分腎小管變形,細胞核消失,腎間質周圍炎癥細胞浸潤,而Sco 能明顯緩解AKI 小鼠腎臟組織以上病理變化,見圖1A(插頁)。另外,TUNEL 染色結果顯示,LPS組小鼠腎臟組織細胞凋亡信號(棕褐色)明顯增強,而Sco 能逆轉這種情況,棕褐色明顯減弱,且LPS+80 mg/kg Sco 組逆轉效果更加明顯,見圖1B(插頁)。
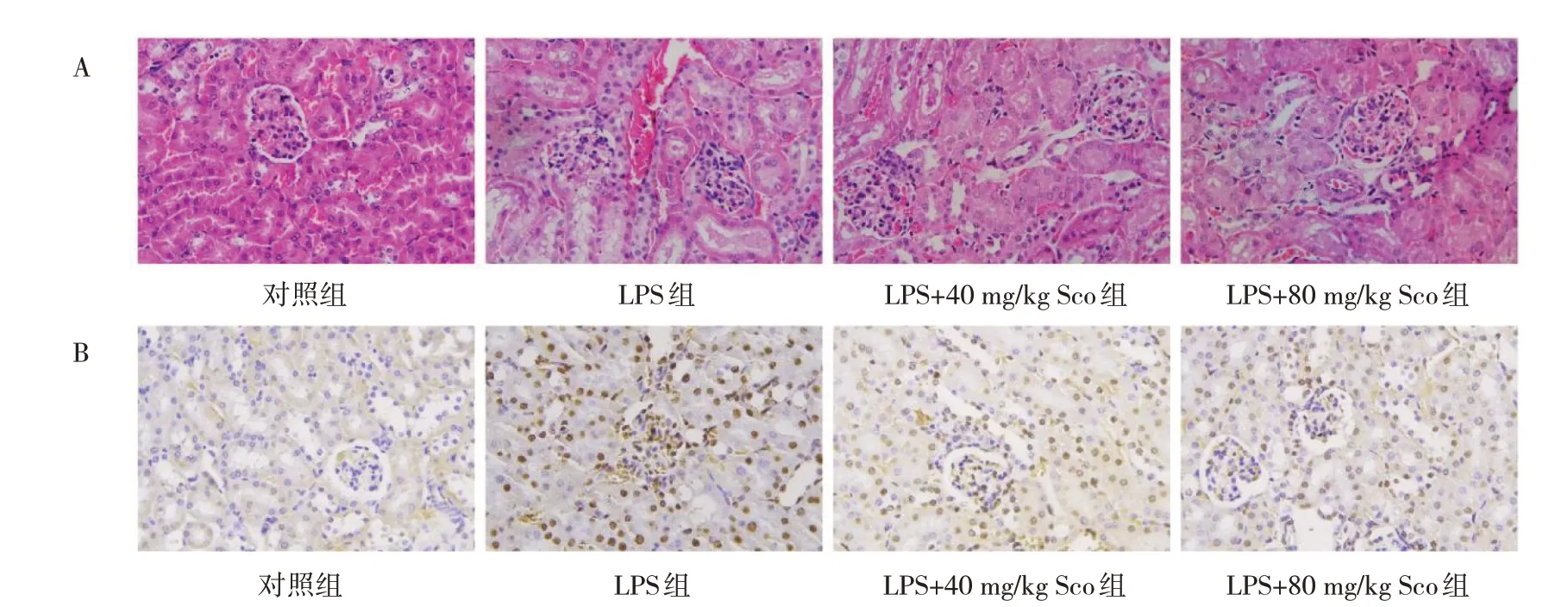
圖1 Sco 對小鼠腎臟組織損傷的影響(A:4 組小鼠腎臟組織損傷的病理檢查所見,HE 染色,×400;B:4 組小鼠腎臟組織細胞凋亡圖,TUNEL 染色,×400)
2.1.2 4 組小鼠血清中Scr 和BUN 水平比 較 4 組小鼠血清中Scr 和BUN 水平比較差異均有統(tǒng)計學意義(F=7.189 和1.552,P=0.009 和0.001)。與對照組相比,LPS 組小鼠血清中Scr和BUN水平均升高(均P<0.01)。與LPS組相比,LPS+40 mg/kg Sco 組和LPS+80 mg/kg Sco組小鼠血清中Scr 和BUN 水平均下降(均P<0.05),且LPS+80 mg/kg Sco 組小鼠下降更明顯,見圖2。
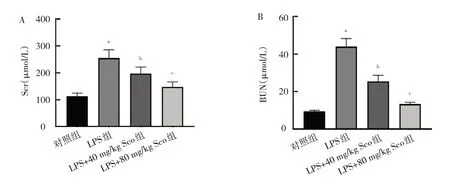
圖2 4 組小鼠血清中Scr 和BUN 水平比較(A:4 組小鼠血清中Scr 水平比較;B:4 組小鼠血清中BUN 水平比較)
2.1.3 4 組小鼠腎臟組織中JMJD3 和MD-2 蛋白表達水平比較 4 組小鼠JMJD3 和MD-2 蛋白表達水平比較差異均有統(tǒng)計學意義(F=2.203 和2.359,P=0.014 和0.046)。與對照組相比,LPS 組小鼠腎臟組織中JMJD3和MD-2 蛋白表達水平均上升(均P<0.01)。與LPS 組相比,LPS+40 mg/kg Sco 組和LPS+80 mg/kg Sco 組小鼠腎臟組織中JMJD3 和MD-2 蛋白表達水平均下降(均P<0.05),且LPS+80 mg/kg Sco組下降更明顯,見圖3。
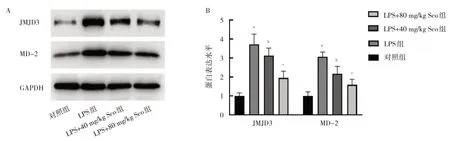
圖3 4 組小鼠腎臟組織中JMJD3 和MD-2 蛋白表達水平比較(A:4 組小鼠腎臟組織JMJD3 和MD-2 蛋白表達的電泳圖;B:4 組小鼠腎臟組織JMJD3 和MD-2 蛋白表達的柱狀圖)
2.2 細胞觀測指標
2.2.1 4 組細胞凋亡水平比較 4 組細胞凋亡水平比較差異有統(tǒng)計學意義(F=2.351,P=0.039)。與對照組相比,LPS 組細胞凋亡水平上升(P<0.05)。與LPS 組相比,LPS+30 μmol/L Sco 組和LPS+60 μmol/L Sco 組細胞凋亡水平均下降(均P<0.05),且LPS+60 μmol/L Sco組干預效果更加明顯,見圖4(插頁)。
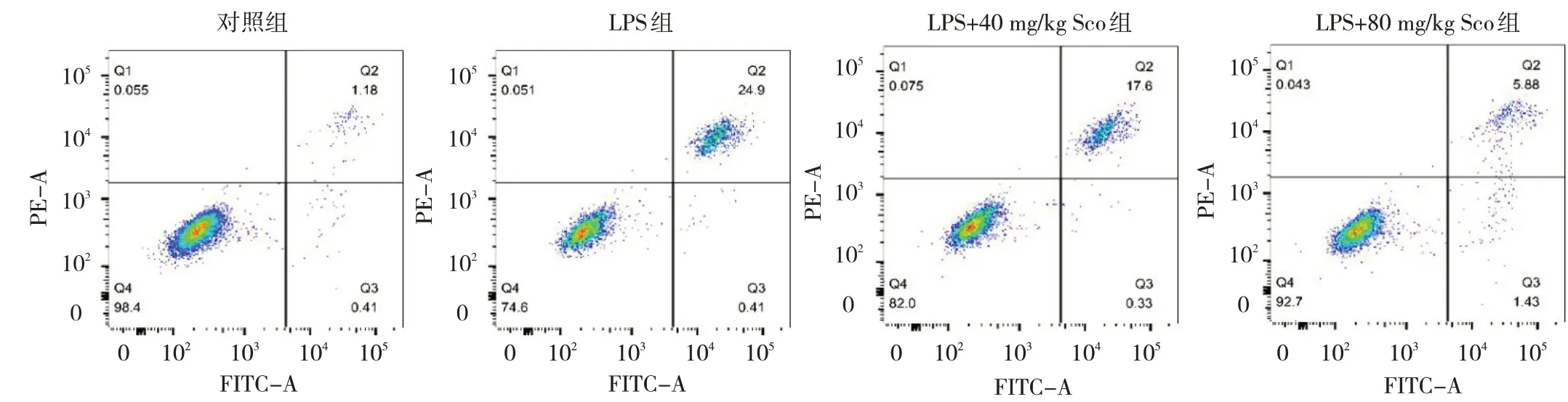
圖4 4 組細胞凋亡水平比較
2.2.2 4 組細胞JMJD3、MD-2 蛋白表達水平比較 4組細胞JMJD3 和MD-2 蛋白表達水平比較差異均有統(tǒng)計學意義(F=3.348 和2.971,P=0.003 和0.048)。與對照組相比,LPS 組細胞JMJD3 和MD-2 蛋白表達水平上升(均P<0.01)。與LPS 組比較,LPS+30 μmol/L Sco組和LPS+60 μmol/L Sco 組細胞JMJD3 和MD-2 蛋白表達水平下降均下降(均P<0.05),見圖5。
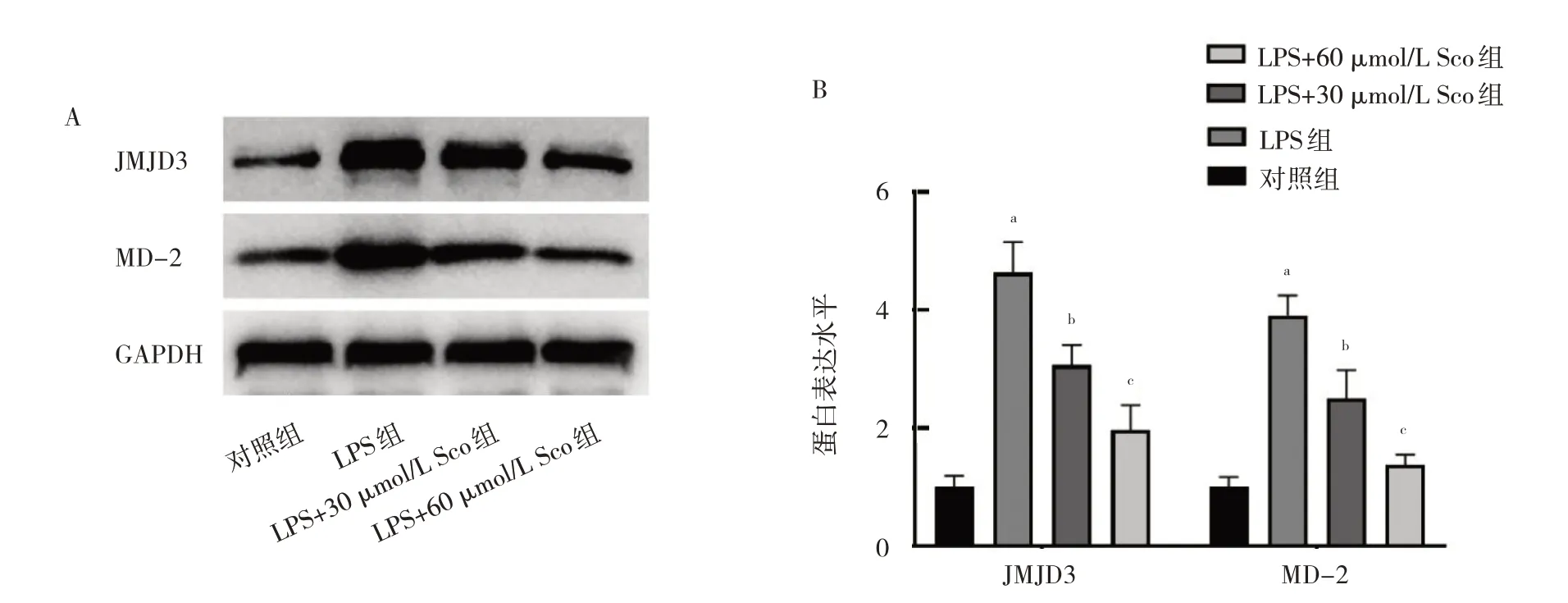
圖5 4 組細胞JMJD3、MD-2 蛋白表達水平比較(A:4 組細胞JMJD3 和MD-2 蛋白表達的電泳圖;B:4 組細胞JMJD3 和MD-2 蛋白表達的柱狀圖)
2.2.3 oe-JMJD3 后4 組細胞凋亡水平比較 oe-JMJD3后4組細胞凋亡水平比較差異有統(tǒng)計學意義(F=4.332,P=0.013)。與LPS 組相比,LPS+60 μmol/L Sco 組細胞凋亡水平下降(P<0.01)。與LPS+60 μmol/L Sco+oe-NC 組相比,LPS+60 μmol/L Sco+oe-JMJD3 組細胞凋亡水平上升(P<0.05),見圖6(插頁)。
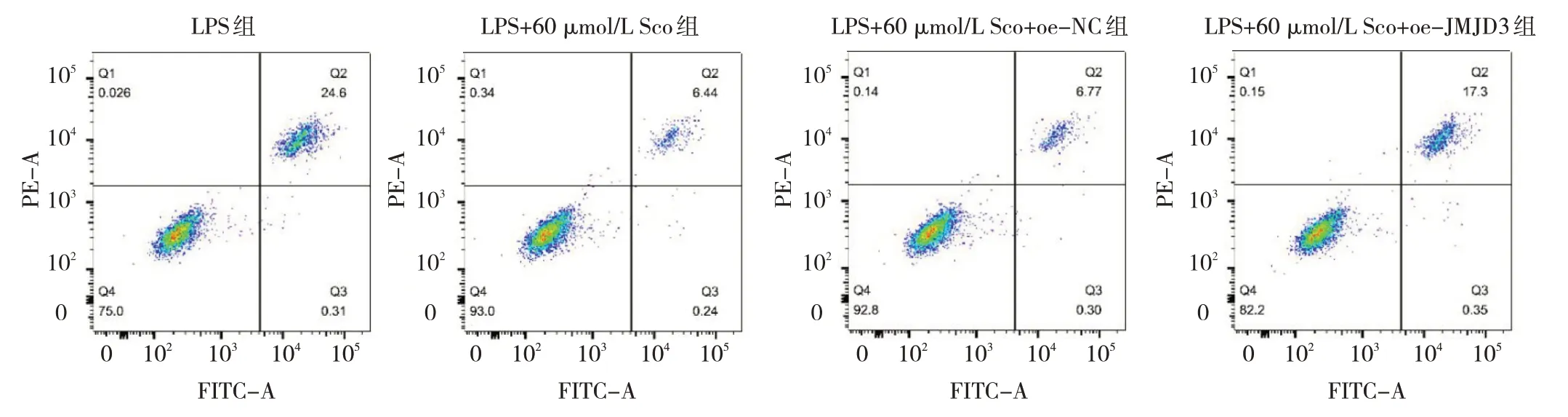
圖6 oe-JMJD3 后4 組細胞凋亡水平比較
2.2.4 oe-JMJD3 后4 組細胞JMJD3、MD-2 蛋白表達水平比較 oe-JMJD3 后4 組細胞JMJD3 和MD-2 蛋白表達水平比較差異均有統(tǒng)計學意義(F=1.387 和1.110,P=0.008 和0.017)。與LPS 組 相 比,LPS+60 μmol/L Sco 組細胞JMJD3 和MD-2 蛋白表達水平均下降(均P<0.01)。與LPS+60 μmol/L Sco+oe-NC 組相 比,LPS+60 μmol/L Sco+oe-JMJD3 組細胞JMJD3 和MD-2蛋白表達水平均上升(均P<0.05),見圖7。
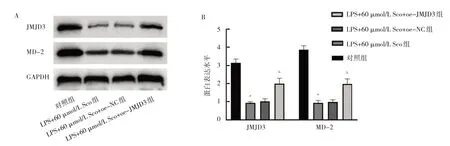
圖7 oe-JMJD3 后4 組細胞JMJD3、MD-2 蛋白表達水平比較(A:oe-JMJD3 后4 組細胞JMJD3 和MD-2D 蛋白表達的電泳圖;B:oe-JMJD3 后4 組細胞JMJD3 和MD-2 蛋白表達的柱狀圖)
3 討論
血清Scr 和BUN 是腎功能評估中使用最廣泛的生物標志物。在膿毒癥相關AKI 中,機體最明顯的變化之一就是血清Scr 和BUN 水平升高[5]。本研究通過LPS 建立了膿毒癥相關AKI 小鼠模型,小鼠血清Scr和BUN 水平明顯升高,Sco 干預能逆轉這種現(xiàn)象,提示Sco 能提高腎功能。此外,小鼠腎臟組織HE 和TUNEL 染色發(fā)現(xiàn),與對照組相比,LPS 組小鼠腎臟組織出現(xiàn)明顯的組織損傷和細胞凋亡,而Sco 干預能明顯改善腎臟組織損傷并抑制細胞凋亡。
腎小管上皮細胞凋亡是AKI 最常見的病理特征之一。本研究選擇對HK-2 細胞進行培養(yǎng),通過LPS 建立體外AKI 模型,LPS 顯著促進了細胞凋亡。對LPS誘導的HK-2 細胞模型給予Sco 干預后,細胞凋亡受到抑制。Sco 能促進膿毒癥相關AKI 中腎小管上皮細胞的損傷修復。在既往研究中,Sco 能顯著抑制氧糖剝奪再復氧誘導的海馬神經元細胞凋亡[6],促進真皮細胞的增殖,抑制其凋亡[7]。Sco 顯著提高了缺血再灌注中心肌細胞活力和抗凋亡蛋白的表達,降低了心肌細胞凋亡率和促凋亡蛋白的表達[8-10]。可見Sco 能促進細胞的損傷修復,但是Sco 對HK-2 細胞的具體作用機制還未闡明。
研究表明JMJD3 有助于中性粒細胞mPR1 高表達,從而促進早期膿毒癥中促炎IL-1β 的產生[11]。已知JMJD3 參與細胞分化、增殖、衰老和凋亡的生物過程,因此JMJD3 與機體發(fā)育和疾病進展有關[12]。如JMJD3(-/-)神經元表現(xiàn)出細胞凋亡抑制和對氧糖剝奪損傷的耐受性[13]。本研究發(fā)現(xiàn)在LPS 誘導的AKI 小鼠模型以及HK-2 細胞模型中,JMJD3 表達上調,給予Sco 干預以后,JMJD3 表達被抑制。進一步oe-JMJD3后,細胞凋亡水平上升。因此在膿毒癥相關AKI 中,Sco 能通過抑制JMJD3 的表達緩解疾病的發(fā)展。MD-2在膿毒癥小鼠模型中上調,MD-2 能激活核苷酸結合寡聚結構域,從而加劇膿毒癥小鼠的神經炎癥和認知障礙[14]。在LPS 誘導的AKI 模型中,MD-2 也顯著影響了炎癥反應[15]。MD-2 是Toll 樣受體4 識別LPS 所必需的,同樣參與細胞凋亡的過程[16-17]。本研究通過在HK-2 細胞中轉染oe-JMJD3 質粒,發(fā)現(xiàn)oe-JMJD3 能促進MD-2 表達。
綜上所述,本研究發(fā)現(xiàn)Sco 能緩解膿毒癥相關AKI小鼠腎臟組織的損傷,抑制LPS 誘導的HK-2 細胞凋亡并且這種作用是通過調節(jié)JMJD3 和MD-2 的表達實現(xiàn)的。本研究為膿毒癥相關AKI 的治療提供了新的思路和科學的理論基礎。

