不同途徑感染禽網狀內皮組織增殖病病毒的動態監測
徐鳳霞 , 孫萬里 , 張亞文 , 常 爽 , 王一新 , 趙 鵬
(山東農業大學動物科技學院 , 山東 泰安 271018)
禽網狀內皮組織增殖病(Reticuloendotheliosis,RE)是由禽網狀內皮組織增殖病病毒(Reticuloendotheliosis virus,REV)感染引起的一種嚴重危害養禽業的常見腫瘤病之一[1],是以肝臟和法氏囊等器官組織出現大小不一的灰色結節和彌漫性病變為主要特征的一種病理綜合征[2-3]。雖然雞群感染REV一般不會直接導致死亡,但會引起患雞發生嚴重免疫抑制,進而極易遭受其他病毒或細菌的侵害。近年來研究表明,REV易與其他病毒發生混合感染[4-5],并可通過污染的禽活疫苗進行傳播[6-7],導致雞群在接種污染的疫苗后不僅沒有產生免疫保護效力,甚至增強了REV對無特定病原體(Specific pathogen free,SPF)雞的致病作用。雖然Ren等[8]將提取的表面糖蛋白gp90與胞嘧啶-鳥嘌呤寡脫氧核苷酸(Cytosine phospho guanine oligodeoxynucleotide,CpG-ODN)佐劑一起用于種雞免疫時,確定gp90蛋白疫苗誘導的母源抗體可有效保護大多數雛雞免受REV感染,但迄今尚未有商品化疫苗或藥物可用于RE防控,為最大程度降低REV感染帶來的危害,有針對性的設計凈化方案、完善凈化程序并建立可靠的檢測方法是有效控制該病的重要途徑之一。為此,本試驗利用不同的感染途徑將REV感染雞胚或雛雞,運用反轉錄PCR(Reverse transcription PCR,RT-PCR)、實時熒光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)和間接免疫熒光試驗(Indirect immunofluorescence assay,IFA)3種檢測方法分析感染雞的排毒規律,為未來實施種源凈化提供參考數據。
1 材料與方法
1.1 毒株和實驗動物 REV毒株LN1201為2012年本實驗室從某父母代肉種雞場疑似感染REV的雞血漿中分離得到,已完成全基因組測序(GenBank登錄號:KU641115.1),經RT-qPCR鑒定無馬立克氏病毒(Marek's disease virus,MDV)、傳染性法氏囊病毒(Infectious bursal disease virus,IBDV)和雞傳染性貧血病毒(Chicken infectious anemia virus,CIAV)的污染,經酶聯免疫吸附試驗(Enzyme-linked immunosorbent assay,ELISA)鑒定無禽白血病病毒(Avian leukosis virus,ALV)的污染。SPF雞胚,購自山東濟南斯帕法斯家禽有限公司,生產許可證號為SCXK(魯)2018—0005,雞胚經75%酒精消毒后在山東農業大學家禽腫瘤病與免疫抑制病實驗室孵化箱內孵化至21日齡,之后飼養于山東農業大學南校區動物房負壓隔離器內。LN1201毒株在雞成纖維細胞系(Douglas foster-1,DF-1)上增殖后,按照Reed-Muench法測定其組織半數感染量(50% tissue culture infective dose,TCID50)。
1.2 主要試劑 FITC標記山羊抗小鼠IgG(H+L)抗體,購自北京全式金生物技術有限公司;病毒RNA提取試劑盒,購自美國OMEGA公司;Evo M-MLV 反轉錄試劑盒和SYBR Green ProTaqHS預混型qPCR試劑盒II,均購自湖南艾科瑞生物工程有限公司;REV特異性單克隆抗體11b118小鼠純化腹水,由山東農業大學家禽腫瘤病與免疫抑制病實驗室制備和保存,其效價為1∶8 000;4%多聚甲醛細胞固定液,購自上海碧云天生物技術有限公司。
1.3 主要儀器 PCR儀,購自德國 Eppendorf 公司;電泳槽,購自北京六一儀器公司;凝膠成像儀,購自BIO-RAD公司;熒光定量PCR儀,購自德國羅氏診斷有限公司;恒溫水浴鍋,購自英國Grant公司;超凈臺,購自加拿大Cabinets公司;核酸定量儀,購自Pharmacia Biotech公司;倒置熒光顯微鏡,購自日本NIKON公司。
1.4 試驗設計 將140枚SPF雞胚隨機分為5個組,分別為卵黃囊感染組(50枚)、卵黃囊感染同居組(20枚)、腹腔感染組(30枚)、腹腔感染同居組(20枚)和空白對照組(20枚)。卵黃囊感染組于6胚齡經卵黃囊接種LN1201病毒液,接種劑量為1 500 TCID50/枚;卵黃囊感染同居組將6胚齡SPF雞胚與卵黃囊感染組在同一孵化箱孵化出殼和飼養;腹腔感染組隨機挑選正常孵化后的無REV、MDV、IBDV、CIAV和ALV污染的SPF雞(陰性SPF雞)20只,1日齡時經腹腔接種LN1201病毒液,接種劑量為2 000 TCID50/只;腹腔感染同居組隨機挑選同期孵化的陰性SPF雞10只與腹腔感染組共同飼養;以同期孵化陰性SPF雞作為空白對照組。在為期10周的試驗周期內,每隔7 d進行1次體重測定,并繪制體重增長曲線;觀察雞群死亡情況,計算死亡率并繪制生存曲線。動物試驗經山東農業大學動物倫理委員會批準(SDAUA-2021-038),嚴格按照山東農業大學動物倫理委員會批準的倫理和生物安全準則進行。
1.5 樣品采集 采集各組SPF雞感染后第1、7、14、21、28、35、42、49、56、63、70天時的抗凝血,于3 000 r/min離心2 min分離血漿,無菌置于1.5 mL離心管中備用。
1.6 IFA檢測病毒血癥 DF-1細胞培養于24孔細胞板,待細胞密度為70%~80%時,每孔接種80 μL雞血漿樣品,于37 ℃恒溫培養箱中培養4 h,更換含1%胎牛血清的維持液,繼續培養6~7 d后棄去培養液;貼壁加入PBS以沖洗剩余培養液,緩慢貼壁加入4%多聚甲醛細胞固定液,25 ℃固定5~8 min后棄去固定液;貼壁加入PBS以沖洗剩余固定液,加入250 μL REV特異性單克隆抗體11b118小鼠純化腹水,置于37 ℃恒溫培養箱中孵育60 min;棄去單克隆抗體后以PBS沖洗3遍,加入FITC標記山羊抗小鼠IgG(H+L)抗體250 μL,置于37 ℃恒溫培養箱中避光孵育60 min,PBS沖洗3遍后滴入50%甘油,置于倒置熒光顯微鏡下觀察結果。
1.7 RT-PCR檢測REV核酸陽性率 根據GenBank上發表的REV全基因組序列,使用Primer 6.0軟件設計針對pol基因的RT-PCR引物(表1),用于檢測血漿樣品的REV核酸陽性率。參照病毒RNA提取試劑盒說明書提取分離血漿樣品的病毒核酸進行RT-PCR檢測。RT-PCR首先進行反轉錄,反應程序:37 ℃ 15 min,85 ℃ 5 s,置于4 ℃;然后進入PCR循環,反應程序:95 ℃預變性5 min;95 ℃變性30 s,55 ℃退火20 s,72 ℃延伸30 s,共40個循環;最后72 ℃延伸10 min,置于4 ℃。

表1 用于檢測REV的RT-PCR引物
1.8 RT-qPCR檢測REV核酸陽性率和病毒載量 根據GenBank上發表的REV全基因組序列,使用Primer 6.0軟件設計針對pol基因的RT-qPCR引物(表2),用于檢測血漿樣品的REV核酸陽性率和病毒載量。參照病毒RNA提取試劑盒說明書提取分離血漿樣品的病毒核酸進行RT-qPCR檢測。RT-qPCR反應程序:95 ℃預變性30 s;95 ℃變性5 s,60 ℃退火34 s,共40個循環。
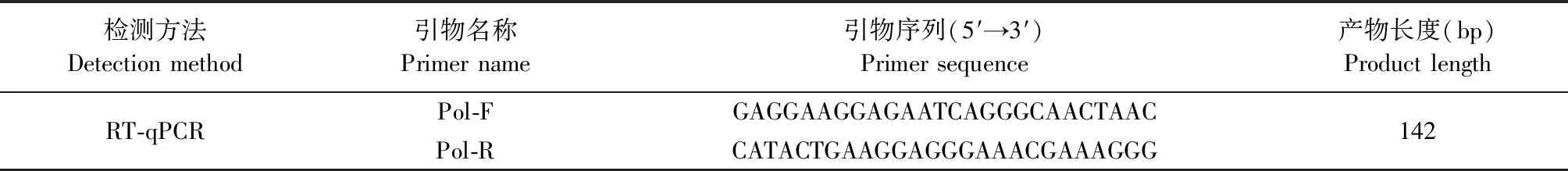
表2 用于檢測REV的RT-qPCR引物
1.9 數據統計與分析 試驗數據采用GraphPad Prism 9.0軟件進行方差分析,P<0.05 認為差異顯著,P>0.05認為差異不顯著。
2 結果
2.1 不同感染方式對SPF雞體重的影響 體重增長曲線如圖2所示,與空白對照組相比,腹腔感染組和卵黃囊感染組的SPF雞在感染后第21~70天體重增長均受到顯著抑制(P<0.05),自感染后第28天起與空白對照組的體重差距呈現逐漸增大趨勢;2種感染方式的同居感染組自感染后第56天起與空白對照組的體重差距呈現逐漸增大的趨勢,但差異均不顯著(P>0.05)。結果表明,SPF雞感染REV可引起增重下降,卵黃囊感染組和腹腔感染組下降更為明顯。
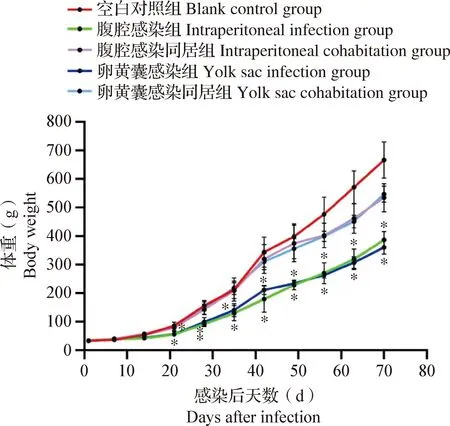
圖1 各組SPF雞的體重增長曲線
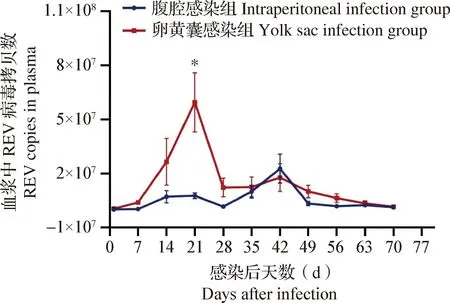
圖2 各組SPF雞血漿中REV病毒載量檢測
2.2 不同感染方式對SPF雞死亡率的影響 死亡率如表3所示,空白對照組SPF雞未出現死亡,卵黃囊感染組SPF雞在感染后第7天出現死亡,腹腔感染組SPF雞在感染后第14天才開始出現死亡;與空白對照組相比,卵黃囊感染組SPF雞的死亡率在感染后第49和63天顯著升高(P<0.05),腹腔感染組SPF雞的死亡率在感染后第42天顯著升高,而2種感染方式的同居組SPF雞死亡率與空白對照組相比均差異不顯著(P>0.05)。結果表明,垂直傳播感染REV更容易引起低日齡SPF雞死亡。
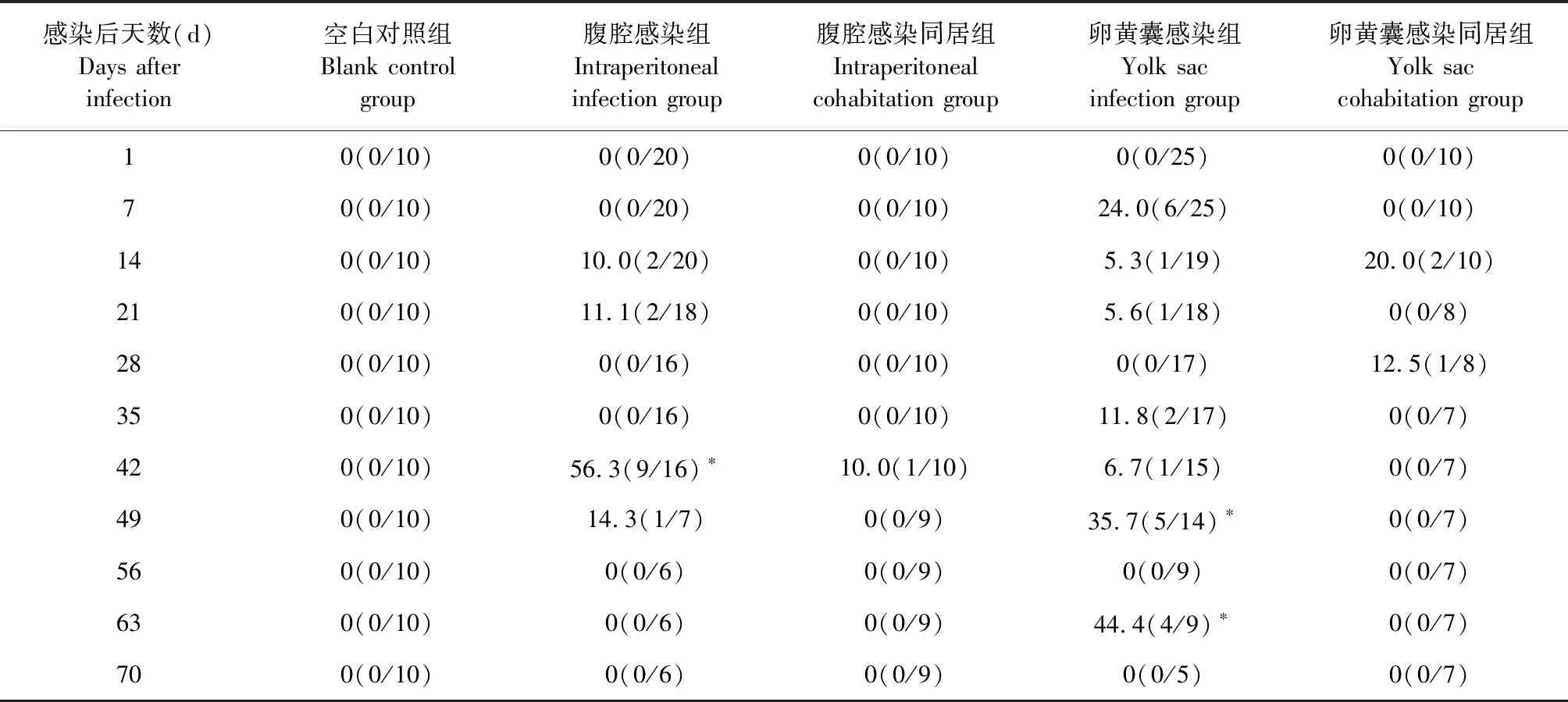
表3 各組SPF雞的死亡率
2.3 不同感染方式對SPF雞REV排毒情況的影響 IFA檢測結果如表4所示,腹腔感染組SPF雞在感染后第7天即可檢測到病毒血癥陽性,陽性率為15.0%(3/20),在感染后第14天時病毒血癥陽性率高達100%;卵黃囊感染組SPF雞病毒血癥陽性率自感染后第1天開始即維持在89.5%~100%;而卵黃囊感染同居組的10只SPF雞在同居的第7天,有2只SPF雞呈病毒血癥陽性;腹腔感染同居組的SPF雞在同居的第21天才開始有病毒血癥陽性出現,僅有1只SPF雞呈病毒血癥陽性。結果表明,通過垂直傳播感染帶毒的雞更容易導致REV早期水平傳播。
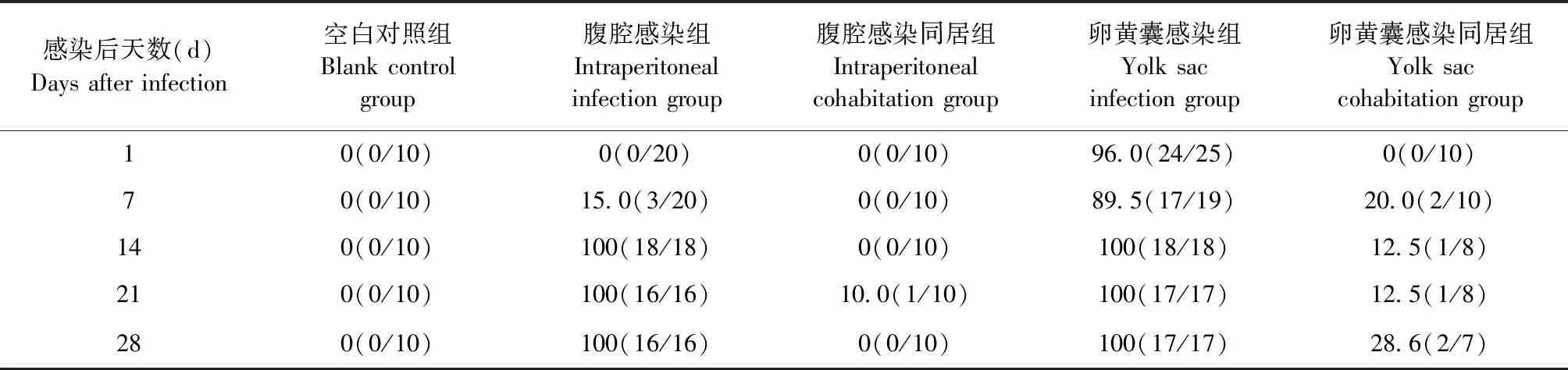
表4 各組SPF雞的病毒血癥陽性率
2.4 不同感染方式對SPF雞血漿中REV陽性率的影響 RT-PCR檢測結果如表5所示,卵黃囊感染組SPF雞自出殼即能檢測到血漿呈REV陽性,陽性率為36.0%;卵黃囊感染同居組SPF雞在同居后第14天時可檢測到血漿中REV核酸陽性,陽性率為12.5%;腹腔感染組SPF雞在感染后第7天可檢測到血漿中REV核酸陽性,陽性率為30.0%;腹腔感染同居組SPF雞在同居后第42天可檢測到血漿中REV核酸陽性,陽性率為11.1%。結果表明,早期感染REV的雞,病毒會在體內不斷增殖,形成持續的帶毒和排毒狀態。
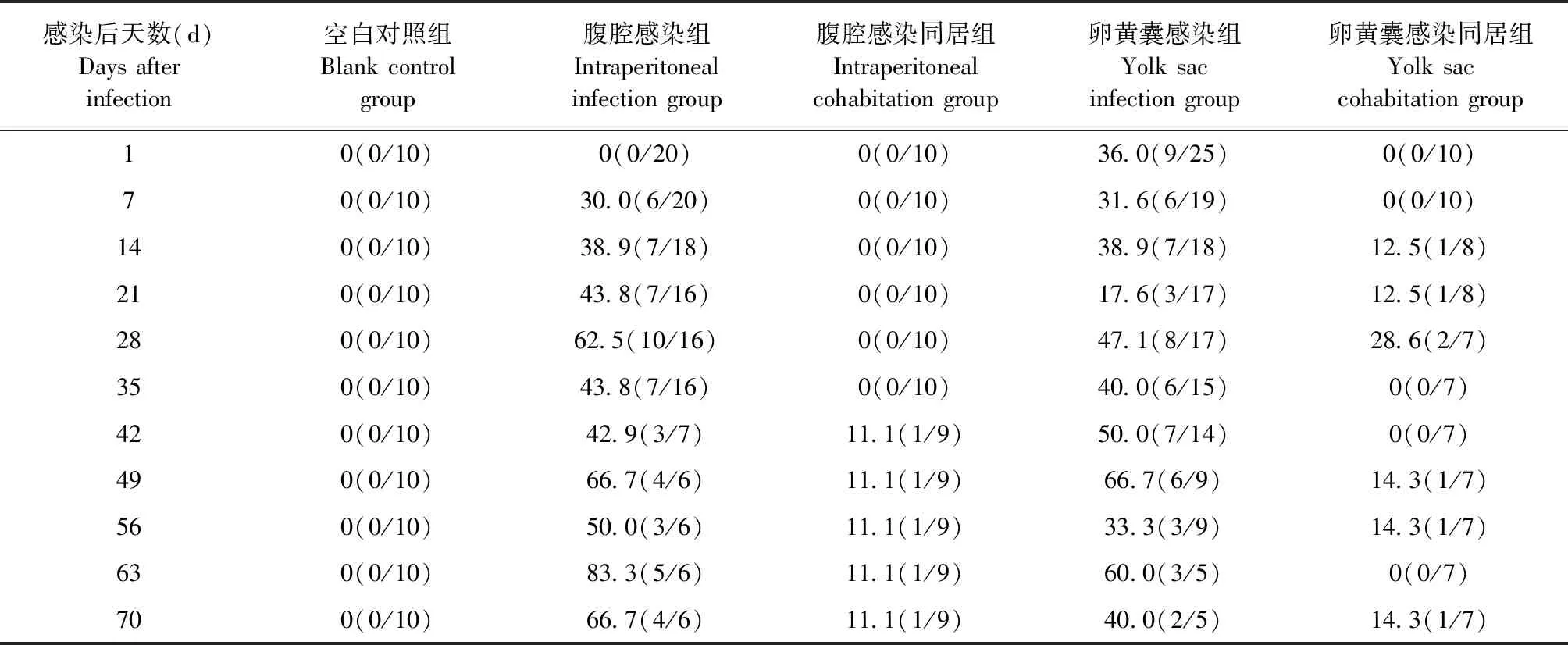
表5 各組SPF雞血漿中REV陽性率
2.5 不同感染方式對SPF雞血漿中REV陽性率和病毒載量的影響 RT-qPCR檢測結果如表6和圖2所示,卵黃囊感染組SPF雞自出殼即為REV全部陽性,血漿中病毒載量在感染后第21天達到第1次高峰,隨后逐漸下降;卵黃囊感染組SPF雞血漿中REV病毒載量在感染后第21天顯著高于腹腔感染組SPF雞(P<0.05);卵黃囊感染同居組SPF雞在同居后第7天可檢測到血液中REV核酸陽性,陽性率為20.0%;腹腔感染組SPF雞在感染后第7天可檢測到血漿中REV核酸陽性,陽性率為80.0%,且血漿中病毒載量在感染后第42天達到高峰;腹腔感染同居組SPF雞在同居后第21天可檢測到血液中REV核酸陽性,陽性率為10.0%。

表6 各組SPF雞血液中REV陽性率
3 討論
RE作為禽類病毒性腫瘤病之一,其廣泛流行給家禽業帶來了嚴重經濟損失[9-10]。雞群感染本病后呈現食欲減退、精神倦怠等非特征性臨床癥狀,常與禽白血病難以區分。研究表明,REV易感染低日齡禽類,引起禽類免疫功能紊亂[6]。該病目前尚無有效治療措施,只能根據本病的感染方式和傳播特點,定期對雞群進行檢測淘汰,從種源控制上降低本病的傳播才能最大限度的發揮種禽生產性能。因此,系統了解不同途徑感染REV后雞群的病毒復制和排毒動態,對種禽企業科學制定REV凈化方案有一定參考價值。
迄今為止,對雞群通過垂直傳播、自然感染和同居感染REV后的排毒規律仍缺乏系統的數據資料。本試驗選擇6胚齡SPF雞胚和1日齡雛雞感染2種方式分別建立了模擬REV垂直傳播和水平傳播感染的模型,同時還分別設置了2種感染方式的同居感染組,綜合運用RT-PCR、RT-qPCR和IFA 三種檢測技術,在系統的動物試驗中對REV開展動態檢測和比較分析。REV感染的危害具有明顯的日齡相關性,越是低日齡的雞感染發病越嚴重[11-12],而經垂直傳播感染造成的危害是其中最嚴重的。本試驗結果顯示,與空白對照組相比,腹腔感染組和卵黃囊感染組SPF雞體重增長在感染后第21~70天均受到顯著抑制(P<0.05);卵黃囊感染組SPF雞的死亡率在感染后第49和63天顯著升高(P<0.05),腹腔感染組SPF雞的死亡率在感染后第42天顯著升高(P<0.05);而卵黃囊感染同居組和腹腔感染同居組SPF雞體重增長和死亡率均無顯著性差異。結果表明,與水平傳播感染相比,REV更容易經垂直傳播和早期腹腔感染而引起SPF雞增重緩慢和死亡。
在對RE實施凈化過程中,育雛過程中進行病毒分離是檢測和淘汰REV陽性雞的重要步驟之一[13]。本試驗通過病毒分離觀察了以不同方式感染REV后雞群病毒血癥情況,卵黃囊感染組SPF雞自出殼就可檢測到REV病毒血癥陽性,陽性率維持在89.5%~100%,并自感染后第21天后一直維持100%陽性,這進一步證實了REV經雞胚垂直傳播容易形成持續性病毒血癥。本試驗腹腔感染組SPF雞在感染后第7天時即可檢測到REV病毒血癥陽性,在感染后第14天時病毒血癥陽性率可高達100%(18/18),且后續表現為持續性的病毒血癥,這與崔帥[14]采用PCR結合核酸斑點雜交對腹腔接種REV的SPF雞進行排毒情況的檢測結果一致。可以看出,早期腹腔感染與垂直感染雞的排毒規律類似,均顯示持續性的病毒血癥。本試驗卵黃囊感染同居組的10只SPF雞在感染后第7天時,有2只呈病毒血癥陽性,但此后陽性率一直較低;腹腔感染同居組SPF雞在感染后第21天時檢出病毒血癥陽性,與卵黃囊感染同居組一樣維持較低陽性率。在連續10周的觀察期內,卵黃囊感染同居組和腹腔感染同居組SPF雞少部分出現一過性的病毒血癥陽性,另一部分并未檢測到REV。
與禽白血病病毒凈化檢測中存在內源性病毒核酸干擾的現象不同[15],通過核酸檢測可以有效檢出REV,目前已有應用RT-qPCR檢測REV的相關報道[16-17],這為通過核酸檢測REV進而實施凈化工作提出了可能。本試驗結合RT-qPCR、RT-PCR和IFA 三種檢測方法對血液中的REV進行檢測,結果顯示,RT-qPCR與IFA的檢測結果高度吻合,而RT-PCR的檢出率顯著低于另二者,表明雞群感染REV后,可考慮聯合應用RT-qPCR和IFA檢測REV以提高凈化淘汰效率。
綜上所述,本試驗通過多種檢測技術分析經不同途徑感染REV后雞群血液中的帶毒情況,發現早期腹腔感染與垂直感染雞的排毒規律類似,均顯示持續性的病毒血癥,聯合應用RT-qPCR和IFA檢測REV適用性強,為將來制定REV凈化方案提供了數據參考。

