酶解法制備阿膠蛋白肽工藝條件優化及抗氧化活性分析
梁 榮,徐 樂,樊 琛,曹樂樂,郭興峰
(聊城大學農學與農業工程學院,山東聊城 252000)
阿膠(Asini Corii Colla)為馬科動物驢(Equus asinusL.)的干燥皮或鮮皮經煎煮、濃縮制成的固體膠[1]。阿膠呈長方形或方形塊,黑褐色,有光澤。質硬而脆,斷面光亮,光照射下呈棕色半透明,氣微、味甘、性平,歸肺、肝、腎經,集治療保健于一體[2],具有治療貧血[3]、提高免疫力[4]、抗炎[5]和美容養顏[6]等功效。阿膠含有蛋白質、肽、氨基酸,還含有豐富的微量元素[7-8],其中蛋白質含量最高,約為60%~80%[9]。阿膠中的蛋白質為膠原蛋白,具有獨特的三股超螺旋結構,三條鏈相互平行而且由鏈間氫鍵相連,具有十分穩定的性質,一般的加工溫度及短時間加熱都難使其分解,很難被人體吸收,食用利用率較低[10]。因此,通過可控酶解技術將阿膠水解成蛋白肽,成為解決這一問題的關鍵[11-12]。
酶解是利用蛋白酶催化作用蛋白質生成氨基酸和多肽的過程,木瓜蛋白酶、嗜熱菌蛋白酶、堿性蛋白酶、中性蛋白酶和肌動蛋白酶是常用的酶。其中,堿性蛋白酶能夠水解肽鍵、酯鍵、酰胺鍵等,且價格低廉、來源廣泛,被廣泛應用于食品行業[13]。酶解法制備生物活性肽的優點在于工藝流程簡單、提取速度快、酶解條件容易控制,制備的生物活性肽性能比較穩定,在酸性條件和較高溫度條件下結構保持完整[13]。經酶解法制備的阿膠蛋白肽具有吸收快速、低耗和不飽和的特點。因此,將阿膠中大分子蛋白轉換成小分子的蛋白肽,更能發揮阿膠的功效[14]。劉元濤等[15]的研究證實,酶解后的阿膠具有更好的提高小鼠免疫力的作用。Pang 等[16]的研究發現,酶解后阿膠的相對分子質量減小且具有顯著的補血升白作用。Wu 等[17]研究發現,模擬人體消化過程酶解阿膠得到得<5000 Da 的組分A 和5000~8000 Da 的組分B,這兩種組分可以刺激貧血小鼠造血,組分A 的效果優于組分B。
機體內的自由基能夠與生物活性分子發生反應,引起細胞或組織的損傷。近年來,開發能夠清除體內過多自由基的抗氧化劑成為食品行業的研究熱點。研究證明很多動植物蛋白水解物不但具有良好的抗氧化活性而且安全、無毒,因此有關抗氧化肽的研究逐漸受到國內外學者的青睞[18]。目前,已從玉米、土豆、蛋清等多種動植物原料中分離鑒定出了抗氧化活性肽[19-20]。然而,有關阿膠蛋白肽在抗氧化功能方面的實驗研究鮮有報道。因此,開展阿膠抗氧化活性蛋白肽的分離鑒定以及作用機理研究是十分必要的。
目前對抗氧化物質的體外活性評價方法主要有自由基(DPPH 自由基、ABTS+自由基、超氧陰離子自由基、羥基自由基等)清除實驗,脂質過氧化抑制實驗和總抗氧化能力的測定等評價方法[21]。其中DPPH 法具有穩定性好、靈敏度高、操作簡單等優點[22];ABTS 法應用廣泛,簡單快速,適用于常規測定。本實驗基于酶標儀-微孔板,建立微量ABTS+自由基清除率和DPPH 自由基清除率實驗,從這兩方面驗證阿膠酶解物的體外抗氧化作用。利用堿性蛋白酶Alcalase 2.4L 制備阿膠抗氧化肽并表征其抗氧化活性,不但能夠提高阿膠的生物利用度,還有助于阿膠新型制劑的研發與生產,為我國傳統中藥的現代化起到積極的推動作用。
1 材料與方法
1.1 材料與儀器
塊狀阿膠 東阿阿膠股份有限公司;堿性蛋白酶(Alcalase2.4L,酶活力2.4 AU-A/g)諾維信中國總部;酪蛋白磷酸蛋白肽 上海麥克林生化科技有限公司;三氯乙酸 上海阿拉丁生化科技股份有限公司;氫氧化鈉 煙臺遠東精細化工有限公司;鹽酸萊陽經濟技術開發區精細化工廠;以上化學試劑均為分析純;2,4,6-吡啶基三嗪、DPPH(1,1-二苯基-2-苦肼基自由基、ABTS([2,2-聯氮-二(3-乙基苯并噻唑-6-磺酸)二銨鹽])上海麥克林生化科技有限公司;谷胱甘肽(還原性)北京索萊寶科技有限公司;過硫酸鉀 北京博奧拓達科技有限公司;NaCl 北京伊諾凱科技有限公司;標準品Dextranstandards 1152上海源葉生物科技有限公司;葡聚糖標準品5000 Da、11600 Da、23800 Da、48600 Da、80900 Da、148000 Da、273000 Da、409800 Da、667800 Da 美國西格瑪奧德里奇公司(Sigma-Aldrich)。
LC-10A 高效液相色譜儀 日本島津公司;BRT105-104-102 串聯凝膠柱(BRT105-104-102,8×300 mm)博瑞糖生物技術有限公司;HHW-ZICU-6OOS 水浴鍋 上海福瑪實驗設備有限公司;ZT-150 高速多功能粉碎機 永康市展帆工貿有限公司;PHS-3C pH 計 上海儀器電科學儀器股份有限公司;JJ-1A 300W 數顯電動攪拌器 金壇區西城新瑞儀器廠;XW-80A 微型漩渦混合儀 上海滬西分析儀器廠有限公司;UV-1800 紫外分光光度計 上海美譜達儀器有限公司;TDZ5-WS 臺式低速離心機上海安亭科學儀器廠;LG-21M 立式高速冷凍離心機四川蜀科儀器有限公司;FD-1-50 冷凍干燥機 北京博醫康儀器有限公司;WTM-1812D 多功能卷式膜小試設備 杭州沃騰膜工程有限公司;1530-00645B 全自動酶標儀 賽默飛世爾科技公司。
1.2 實驗方法
1.2.1 原料預處理 用高速多功能粉碎機將塊狀阿膠粉碎成粉末狀固體,過80 目篩后,于4 ℃條件下保存備用,取部分樣品參照GB 5009.5-2016《食品安全國家標準 食品中蛋白質的測定》[23]中凱式定氮法測定阿膠中蛋白質的含量。
1.2.2 阿膠蛋白的酶解 準確稱取5 g 阿膠粉,溶解于120 mL 水中(4%的底物濃度),80 ℃水浴燉化30 min。冷卻至酶解所需溫度后,用1 mol/L NaOH標準溶液調節pH 到反應所需條件。加入一定量的堿性蛋白酶進行水解,酶解過程中加入1 mol/L 的NaOH 標準溶液,pH 范圍保持在±0.05 以內,并記錄酶解過程中的耗堿量。水解3 h 后,90 ℃水浴滅酶10 min,冷卻后在4 ℃、1×104r/min 條件下離心10 min,收集上清液,用1 mol/L 的HCl 標準溶液調節pH7.00 備用。
1.2.3 水解度(degree of hydrolysis,DH)的測定 蛋白質的水解程度以蛋白質中的肽鍵斷裂百分率表示,pH-stat 法[24]具有操作簡單、連續測定的優點,并且當pH 大于6 時,水解過程中加入堿的量與斷裂的肽鍵的數量有定量的關系,因此采用該法來檢測阿膠蛋白的水解度。
式中:h—單位質量蛋白質中被水解的肽鍵的量(mmol/g);B—消耗的堿液體積,mL;Nb—堿液的濃度,mol/L;1/α—校正系數;Mp—底物中蛋白質的含量,g;htot—底物中蛋白質中的肽鍵總數,mmol/g(阿膠蛋白取11.1[25])。
1.2.4 酶解工藝條件優化 以水解度為評價指標,分別考察單因素實驗中酶解pH、酶解溫度、加酶量(酶與底物比,%)對堿性蛋白酶水解阿膠蛋白質的影響,以pH9、酶與底物比8%、酶解溫度55 ℃為變量因素水平(單因素水平見表1),并在此基礎上,采用正交試驗對酶解工藝條件進行優化,正交試驗因素水平設計見表2。
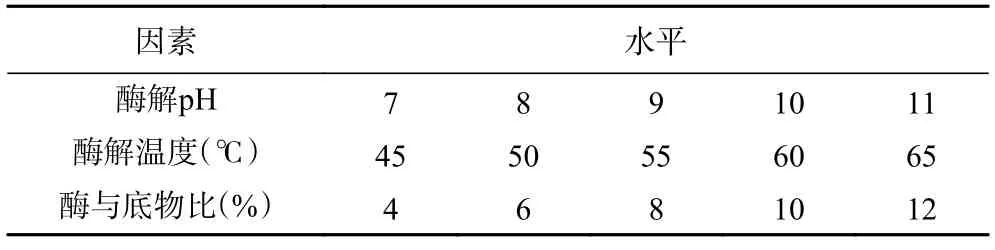
表1 單因素水平設計Table 1 Design of single factor horizontal
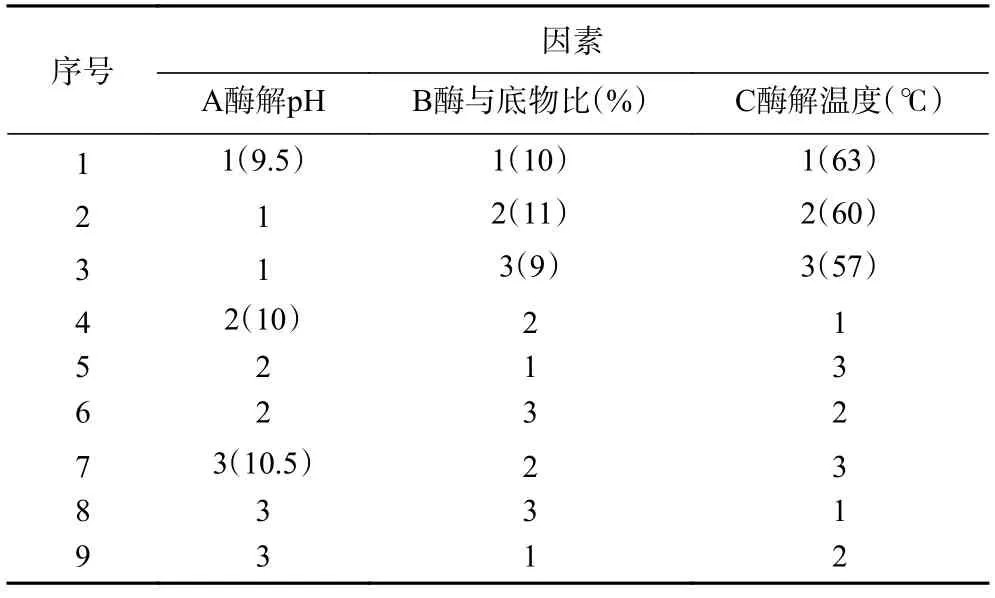
表2 正交試驗因素水平設計Table 2 Factor level of orthogonal experiment
1.2.5 分子量分布的測定 精密稱取樣品和標準品,樣品配制成5 mg/mL 溶液,12000 r/min 離心10 min,上清液用0.22 μm 的微孔濾膜過濾,然后將樣品轉置于1.8 mL 進樣小瓶中。色譜柱:BRT105-104-102串聯凝膠柱(8×300 mm);流動相:0.05 mol/L NaCl溶液;流速:0.6 mL/min,柱溫:40 ℃;進樣量:20 μL;檢測器:示差檢測器RI-10A。
1.2.6 酶解前后抗氧化活性的測定
1.2.6.1 ABTS+自由基清除率的測定 參考王佳琦[26]的方法,用去離子水配制A 液為2.45 mmol/L的K2S2O8溶液和B 液為7 mmol/L 的ABTS 溶液,A液和B 液混合均勻后,避光放置12~16 h。使用前用去離子水稀釋至734 nm 處的吸光度值為0.7。將未酶解和酶解后的樣品配制成濃度梯度為0、2、4、6、8、10 mg/mL,空白組用去離子水代替樣液。分別取濃度梯度的樣品溶液50 μL 于96 孔板上并加入100 μL ABTS 工作液,室溫下放置6 min 后,于734 nm讀取吸光度OD 值。每個樣品平行測量四組數據,取平均值。
式中:Ab 代表空白組的吸光值;As 代表樣品組的吸光度值。
ABTS+-谷胱甘肽標準曲線制作方法:稱取0.0158 g 谷胱甘肽,溶于50 mL 水中,配制成1 mmol/L 的谷胱甘肽標準溶液,用水稀釋成濃度梯度為0.02、0.04、0.06、0.08、0.1 mmol/L 的谷胱甘肽溶液,分別取50 μL 各濃度的谷胱甘肽溶液與100 μL ABTS 工作液反應,于734 nm 讀取吸光度OD 值。以谷胱甘肽溶液濃度為橫坐標,ABTS+自由基清除率為縱坐標繪制標準曲線。谷胱甘肽清除ABTS+自由基的標準曲線在0~0.1 mmol/L 范圍內濃度與吸光度呈良好的線性關系,其方程為:y=532.34x+33.98,R2=0.9016。
1.2.6.2 DPPH 自由基清除率的測定 參考Xu 等[27]的方法,取0.0236 g DPPH 粉用甲醇溶解,轉移到容量瓶中定容至100 mL,依次取100 μL 甲醇溶液、100 μL 濃度梯度分別為0、2、4、6、8、10 mg/mL 的樣品溶液(空白為甲醇溶液)100 μL 的樣品溶液于96 孔板上,再加入100 μL DPPH 溶液,避光30 min后,于515 nm 下讀取吸光度OD 值。每個樣品平行測量四組數據,取平均值。
式中,Ab 代表空白組的吸光值;As 代表樣品組的吸光度值。
DPPH-谷胱甘肽標準曲線制作方法:稱取0.0158 g 谷胱甘肽,溶于50 mL 水中,配制成1 mmol/L的谷胱甘肽標準溶液,用水稀釋成濃度梯度為0.02、0.04、0.06、0.08、0.1 mmol/L 的谷胱甘肽溶液,分別取100 μL 甲醇、50 μL 各濃度的谷胱甘肽溶液與100 μL DPPH 溶液反應,于515 nm 讀取吸光度OD 值。以谷胱甘肽溶液濃度為橫坐標,DPPH自由基清除率為縱坐標繪制標準曲線。谷胱甘肽清除DPPH 自由基的標準曲線在0~0.1 mmol/L 范圍內濃度與吸光度呈良好的線性關系,其方程為:y=199.14x+15.807,R2=0.9863。
1.2.7 阿膠多肽的超濾分離 在室溫條件下,采用截流分子量為30、10、3 和1 kDa 的超濾膜,對經過堿性蛋白酶酶解后的阿膠蛋白肽進行分離純化,分別得到>30 kDa、10~30 kDa、3~10 kDa、1~3 kDa 和<1 kDa 的五組不同分子量的阿膠蛋白肽。在超濾分離過程中,保證流量計的流量范圍在5~7 LPM,進膜壓力表的壓力區間為0~8 bar。分別收集不同分子量的阿膠蛋白肽,于冷凍干燥機中進行干燥,將干燥好的樣品進行密封處理備用。
1.2.8 不同組分阿膠蛋白肽抗氧化活性的測定 通過ABTS+和DPPH 自由基清除率的測定評價阿膠蛋白肽抗氧化活性。阿膠蛋白肽的濃度梯度為2、4、6、8、10 mg/mL。
1.3 數據處理
采用Excel 2019、Origin 2022b 制圖,采用SPSS 21.0 對數據進行極差分析、方差分析、顯著性檢驗,顯著性水平設置為P<0.05。
2 結果與分析
2.1 酶解條件對阿膠蛋白質水解度的影響
圖1 分別為酶解pH、酶解溫度、酶與底物比對堿性蛋白酶水解阿膠蛋白質的影響。凱氏定氮法測得阿膠中蛋白質含量為74.2%,并用此數據計算水解度。由圖1(A)可知,在酶解溫度55 ℃、酶與底物比8%的條件下,不同酶解pH 對阿膠水解度產生影響較大。阿膠的水解度隨著pH 的增大呈上升趨勢,在pH8~10 之間水解度趨于平緩,在酶解pH 為11 時,水解度達到最大值13.57%±0.99%。如圖1(B)所示,當在酶解pH9、酶與底物比8%的條件下,隨酶解溫度的升高,阿膠蛋白水解度呈逐漸上升趨勢,酶解溫度為60 ℃時,達到最大值13.73%±0.10%,在60 ℃以后,溫度升高水解度略有下降。圖1(C)為堿性蛋白酶的酶與底物比(%)對阿膠蛋白質水解度的影響。在酶解pH 9、酶解溫度55 ℃的條件下,阿膠蛋白水解度呈先增加后降低的趨勢,當酶與底物比為10%時阿膠蛋白水解度達到最大值14.27%±0.41%。根據單因素實驗結果選擇的酶解正交試驗因素為酶解pH10,酶解溫度60 ℃及酶與底物比10%。在此參數下符合堿性蛋白酶Alcalase 2.4L 的最適反應條件,且在酶解溫度及酶與底物比的單因素設計中,阿膠水解度能夠達到最大值,有利于下一步正交試驗的開展。
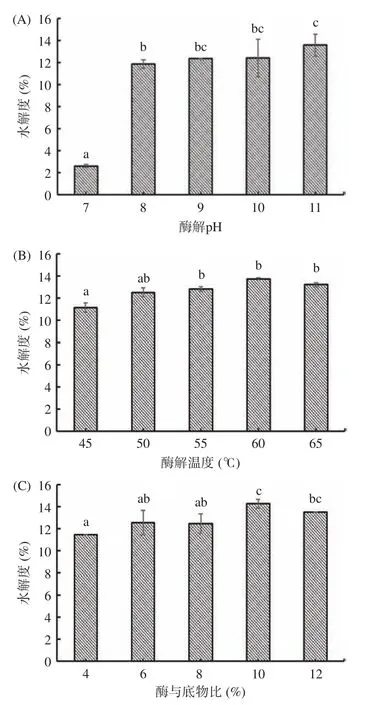
圖1 酶解條件對阿膠水解度的影響Fig.1 Effects of enzymatic hydrolysis conditions on the hydrolysis degree of donkey hide gelatin
2.2 正交試驗優化酶解工藝
2.2.1 正交試驗結果 參考劉振峰等[28]描述的極差分析法,分析試驗結果。由表3 可知,以水解度為指標的因素影響依次為A、C、B,即酶解pH>酶解溫度>酶與底物比,最佳組合為A2B1C3,即酶解pH10,酶與底物比為9%,酶解溫度為63 ℃。正交試驗得出最優條件下的水解度為13.937%,并不是最大值,經驗證最優條件為酶解pH10.5、酶與底物比9%、酶解溫度為63 ℃,此條件下阿膠蛋白的水解度為15.93%±1.32%。
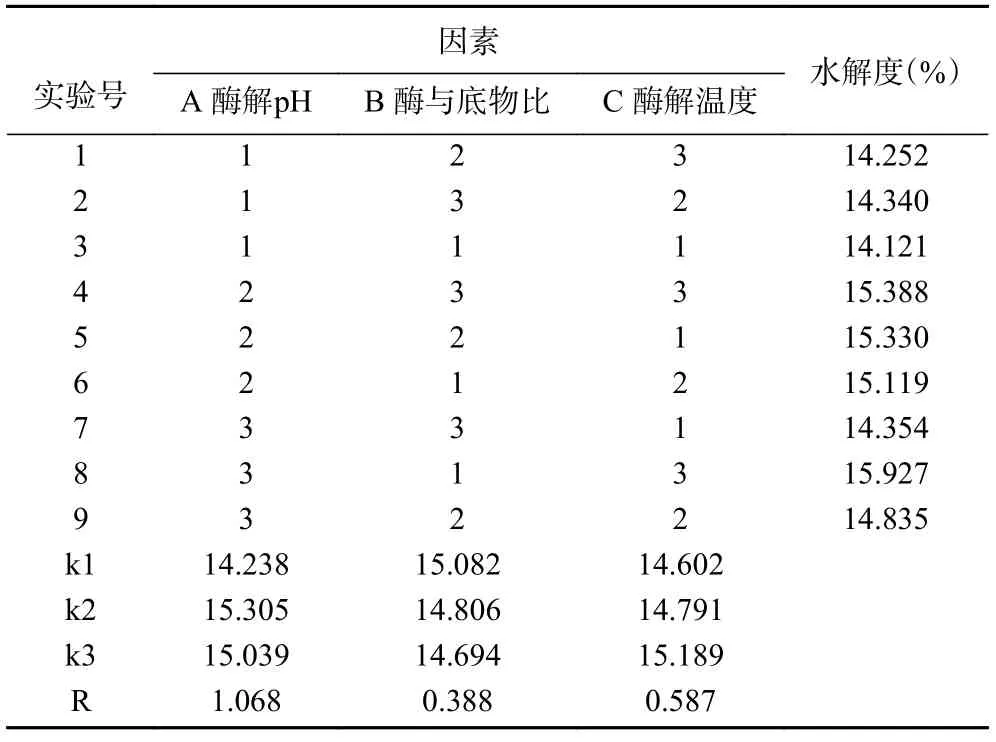
表3 正交試驗結果Table 3 Results of orthogonal experimental
2.3 分子量分布的測定結果
利用高效凝膠色譜法測定酶解前后阿膠蛋白溶液的分子量分布情況。圖2 為校正曲線。峰位分子量(lg Mp-RT)校正曲線方程為:y=-0.1817x+11.622,R2=0.9948;重均分子量(lg Mw-RT)校正曲線方程為:y=-0.1938x+12.182,R2=0.994;數均分子量(lg Mn-RT)校正曲線方程為:y=-0.1795x+11.459,R2=0.9908;根據標準品曲線可計算出樣品的分子量大小。如圖3 所示,酶解前阿膠溶液的出鋒保留時間為41.5、43.5、50.5 min(46.0 min 為流動相的峰),根據標準曲線測定結果,經回歸方程計算發現其分子量絕大部分分布在5000 Da 以上;經酶解后阿膠溶液在保留時間55.5 min 出現了新的峰,分子量為16 Da,且分子量5000 Da 以下的物質增多。結果表明,經過堿性蛋白酶的處理,阿膠大分子蛋白或多肽被進一步水解,分子量減小。阿膠分子質量的降低能夠使其具有較好的溶解性,機體更容易消化吸收,從而提高了阿膠的生物利用度[29]。
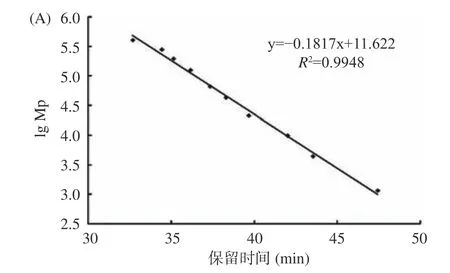
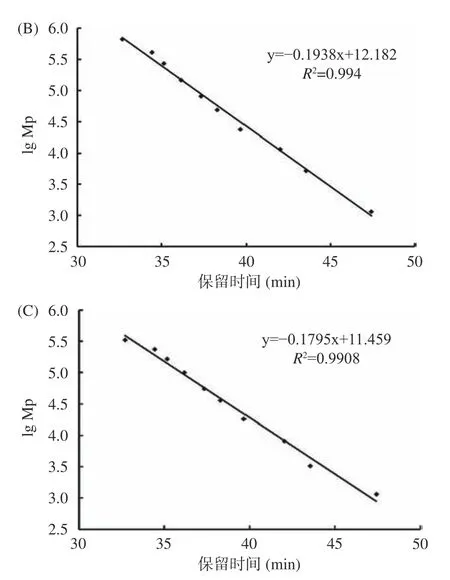
圖2 標準品校正曲線Fig.2 Calibration curves of standards

圖3 阿膠蛋白溶液色譜圖Fig.3 Chromatogram of donkey hide gelatin solution
2.4 抗氧化活性結果分析
2.4.1 阿膠酶解前后抗氧化活性 阿膠未酶解和酶解后的ABTS+自由基清除率見圖4。阿膠未酶解和酶解后的ABTS+自由基清除率的趨勢相同。在濃度為0~10 mg/mL 之間具有量效關系,且具有統計學顯著差異(P<0.05);ABTS+自由基清率隨溶液濃度的增大逐漸升高;在濃度為10 mg/mL 時,未酶解阿膠和酶解后的阿膠蛋白肽溶液清除ABTS+自由基的能力達到最高,分別為75.83%±0.32%和93.16%±0.21%。由圖4 可見,所有同等劑量下阿膠酶解液的ABTS+自由基清除率均高于未酶解的阿膠溶液,與樊雨梅等[30]的結果一致。Oh 等[31]的研究表明,產生這一結果的原因是蛋白原料的酶解產物對ABTS+自由基的清除率與其蛋白原料中的酪氨酸、色氨酸、半胱氨酸、蛋氨酸等抗氧化氨基酸的含量高度相關。
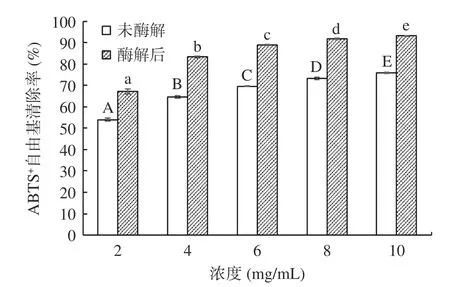
圖4 酶解處理對阿膠蛋白肽的ABTS+自由基清除率的影響Fig.4 Effects of enzymatic hydrolysis on ABTS+ radical scavenging rate of donkey hide gelatin peptides
未酶解阿膠溶液和酶解后阿膠蛋白肽的DPPH自由基清除率見圖5。未酶解阿膠溶液清除DPPH自由基的趨勢呈先下降后上升的趨勢,在阿膠溶液濃度為2 mg/mL 時,對DPPH 自由基的清除率最高,為16.93%±2.41%;在阿膠溶液濃度為6 mg/mL,DPPH 自由基清除率最低,為4.23%±1.74%;在溶液濃度4~6 mg/mL 和8~10 mg/mL 之間具有量效關系,且具有統計學顯著性差異(P<0.05)。酶解后的阿膠蛋白肽對DPPH 自由基的清除率呈上升趨勢,在溶液濃度為10 mg/mL 時,對DPPH 自由基的清除率最高,為39.95%±1.27%;阿膠酶解液濃度在2~4 mg/mL 之間具有量效關系,且具有顯著性差異(P<0.05)。所有同等劑量下酶解后阿膠蛋白肽溶液的DPPH 自由基清除率均高于未酶解的阿膠溶液,這與Wu 等[32]的結果一致。
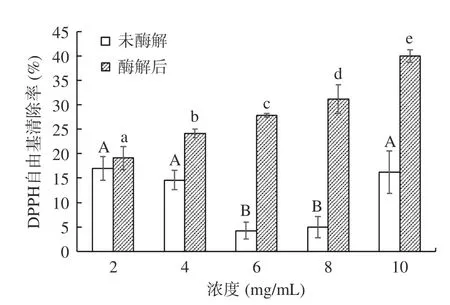
圖5 酶解處理對阿膠蛋白肽的DPPH 自由基清除率的影響Fig.5 Effects of enzymatic hydrolysis on DPPH radical scavenging rate of donkey hide gelatin peptide
2.4.2 不同分子量阿膠蛋白肽抗氧化活性的測定結果 采用堿性蛋白酶酶解得到的阿膠蛋白肽,經過超濾技術將阿膠蛋白肽分離為>30 kDa、10~30 kDa、3~10 kDa、1~3 kDa 和<1 kDa 五個組分。不同組分阿膠蛋白肽ABTS+清除率結果如圖6 所示。隨著阿膠蛋白肽濃度的增大,ABTS+自由基清除率也隨之增大,其變化趨勢與谷胱甘肽對ABTS+自由基清除效果相似。從圖6 可以看出,阿膠蛋白肽以高濃度存在時,其抗氧化活性高。在2~6 mg/mL 濃度范圍內,不同超濾組分的ABTS+自由基清除率隨阿膠蛋白肽濃度增加而顯著(P<0.05)升高,在6~10 mg/mL 濃度范圍內,自由基清除率變化趨勢不明顯。在10 mg/mL 時不同分子量的阿膠蛋白肽清除能力最大,ABTS+自由基清除率由大到小依次為:分子量1~3 kDa,分子量3~10 kDa,分子量>30 kDa,分子量<1 kDa,分子量10~30 kDa。本研究中分子量1~3 kDa的阿膠蛋白肽在10 mg/mL 濃度下具有良好的抗氧化效果,且與其他分子量的阿膠蛋白肽相比差異顯著(P<0.05)。鄭天芝[33]通過對茶渣抗氧化肽的研究,得出分子量1~3 kDa 的茶渣抗氧化肽具有良好的抗氧化效果,與本研究的結論一致。
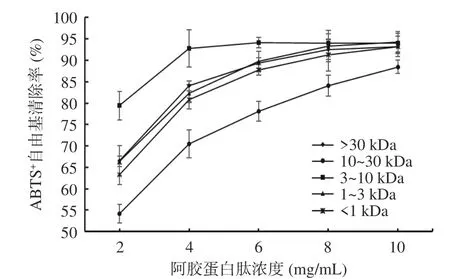
圖6 不同分子量阿膠蛋白肽的ABTS+自由基清除率Fig.6 ABTS+ radical scavenging rate of donkey hide gelatin peptides with different molecular weights
由圖7 可知,不同組分阿膠蛋白肽的DPPH 自由基清除率隨阿膠蛋白肽濃度的增加而增強,且與谷胱甘肽對DPPH 自由基清除率的趨勢大致相同,在2~10 mg/mL 的濃度范圍內具有一定的量效關系。當阿膠蛋白肽的濃度為10 mg/mL 時,DPPH 自由基清除率最強。其中<1 kDa 的阿膠蛋白肽自由基清除率最高為48.7±21.11%,其次為分子量10~30 kDa(41.69%±3.84%),分子量1~3 kDa(37.80%±1.37%),分子量>30 kDa(28.95%±2.89%)。結果表明,在一定濃度條件下,分子量的變化對阿膠蛋白肽清除DPPH 自由基的清除能力有顯著影響,且分子量越小清除能力越強。低分子量的阿膠蛋白肽傾向于與DPPH 自由基反應,這可能會增加多肽或氨基酸小分子去除自由基的能力。相關研究表明,在一定濃度范圍內,食源性肽的分子量越低,其抗氧化活性越強[34]。例如,王寶琴[35]在對榛子抗氧化肽活性分析時發現,分子量最小的榛子抗氧化肽組分(<1 kDa)的DPPH 自由基清除率最強。

圖7 不同分子量阿膠蛋白肽的DPPH 自由基清除率Fig.7 DPPH radical scavenging rate of donkey hide gelatin peptides with different molecular weights
3 結論
本實驗研究獲得了阿膠蛋白肽的最佳酶解工藝,發現酶解后阿膠蛋白肽的抗氧化活性高于未酶解的阿膠,并且小分子的阿膠蛋白肽具有較強的ABTS+及DPPH 自由基清除率,說明阿膠蛋白肽具有良好的體外抗氧化活性。然而本研究未涉及阿膠蛋白肽體內抗氧化活性的檢測及抗氧化機理的探討,這也是今后需要解決的問題及研究方向。本實驗研究為后續開展阿膠蛋白肽抗氧化機理探索奠定良好基礎,也為阿膠新產品的開發提供一定的理論依據。
? The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

