從物質導電情境看學科融合
鄧熠

【摘要】好的微觀想象力會幫助學生理解物理和化學中的很多知識.關于物質的導電性,有很多有意思的問題:為什么有的物質能導電,有的物質不能導電,在導電過程中物體為什么會發熱,超導體又是什么,化學中的電解過程又是怎么發生的.這些問題理解起來卻不簡單,因為電的活動看不見摸不著.此時,學生必須發揮對微觀世界的想象力,能將微觀的運動和變化展現在自己的腦海里,就會對導電有更好的理解.
【關鍵詞】高中物理;導電;帶電粒子
1 原子模型
對電的理解要從微觀的原子開始.任何物體,無論形態,都是由分子和原子構成的,歸根結底都是由原子構成.原子的英文atom出自希臘文“atomos”,意思是不可分割的東西.但通過一系列的實驗,人們發現原子也是可以分割的,它由更小的粒子構成[1].
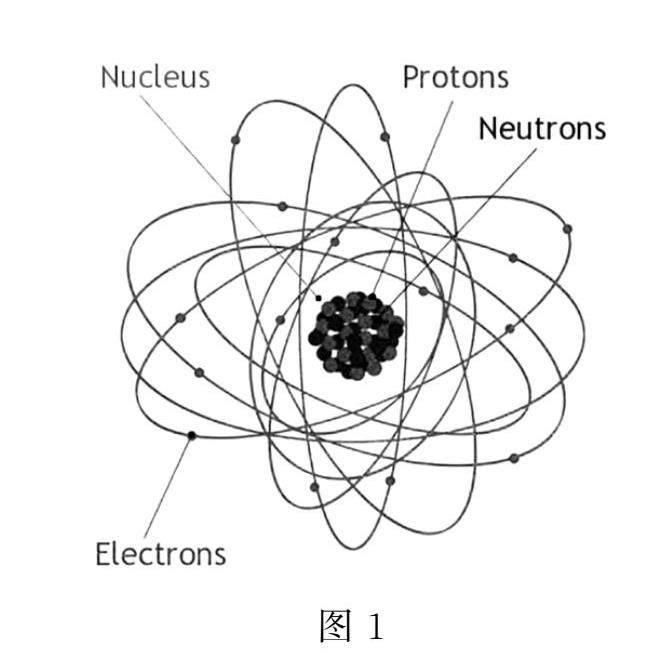
一般認為,原子是由一個原子核和核外運行的數量不等的電子構成(電子在核外不存在一個確定的軌道,它們只是以不同的概率出現在不同的位置,被稱為電子云).原子核很小,其直徑約為原子直徑的100000分之一,原子核相對于原子就如同一個體育場中的小彈珠.1909~1911年,英國物理學家歐內斯特·盧瑟福(Ernest Rutherford)和他的合作者們做了以α粒子(氦核)轟擊金箔的實驗.他們發現絕大部分α粒子穿過金箔,打到對面的熒光屏上產生閃光,但有極少的氦核被反彈了回去.他們由此認為原子里面大部分是空的,有一小部分有很大的質量,足以把氦核彈回去[2].
原子核由若干質子和中子構成,它們又稱為核子(圖1).它們的質量差不多,是一個電子的1800倍,原子的質量幾乎都集中在原子核.質子帶一個單位正電荷,中子不帶電.我們知道,同性電荷相互排斥,在原子核范圍內,電荷之間的庫侖力要比萬有引力強很多,靠萬有引力是無法將核子們聚集在一起的,這時候有一個大家可能沒有聽說的力——強相互作用力,這個力作用范圍很小但強度很大,它只在原子核內起作用,能把核子(質子和中子)黏合在一起而不分崩離析[3].原子核中一定有質子,質子的數量很關鍵,它決定了元素的類型以及相關的化學性質.原子核中是可以沒有中子的,例如,氫元素有三種同位素:氕、氘、氚,它們的原子中,質子數都是1,電子數也都是1,但中子數分別為0、1、2.地球上的絕大部分氫元素為氕,約占99.98%.而常用在原子核反應堆中的重水分子中與氧原子結合的是氘原子.
2 電流的形成
質子和電子分別帶正電和負電,這是所有電現象的根源.原子含有同樣數量的質子和電子,所以表現為電中性.電子帶負電,而原子核帶正電,異種電荷相互吸引,電子就被核束縛住了.倘若束縛強度不大,電子就可以跑很遠,甚至在一些情況下跑到別的核那兒或者四處游蕩;倘若核的束縛力很大,不僅自己的電子跑不遠,可能連別的原子的電子都要搶過來.失去了電子或者俘獲了別的電子后,整體就不是中性的原子了,而是帶電的離子.兩種不同的物質相互摩擦,接觸面的原子核對附近的電子展開搶奪大戰,搶贏了,就帶負電,如毛皮摩擦過的橡膠棒;搶輸了,就丟了電子帶正電,如絲綢摩擦過的玻璃棒.當然,摩擦生電的實際原因要復雜很多[4],如此想象一下可以獲得粗淺的理解,知道電荷并沒有被創生,而只是轉移.
有的原子核對自己的電子束縛能力低,如固體金屬中,一些電子就能四處游蕩成為自由電子,此時金屬陽離子通過金屬鍵網絡形成一個不能移動的骨架(它們會在平衡位置附近振動).沒有電場的時候,電子各個方向亂跑亂碰,不能形成電流[5].加上電場后,自由電子們就像聽到并服從一個號令,開始朝一個方向運動而形成電流(因為帶負電,電子的運動方向與電流方向相反).這些電子在運動時可能偶然撞上晶格,就把部分能量傳遞給晶格,使得后者振動加劇,這可以作為通電導線溫度升高的一個解釋.而溫度升高時,電子在電場力的驅動下定向運動的效果變差,一是電子的無規則運動加劇;二是晶格振動加劇更容易碰上電子而阻礙其定向運動,使得導電性能減弱.相反,如果讓溫度降低,晶格振動減少,自由電子移動起來不易發生碰撞,金屬的導電性能會增加.有時,當溫度降到一定程度,如水銀在-269.03℃時,自由電子通行無阻,產生超導現象.
非金屬則不同,這些單質或者化合物中的電子被原子核們看的牢牢的,即使有外電場作用也不容易跑掉,不能形成電流,所以非金屬往往是絕緣體.除非電場太強撕碎了原來的原子分子結構,形成可以移動的離子——一定強度的高壓電是可以擊穿某些絕緣體的.
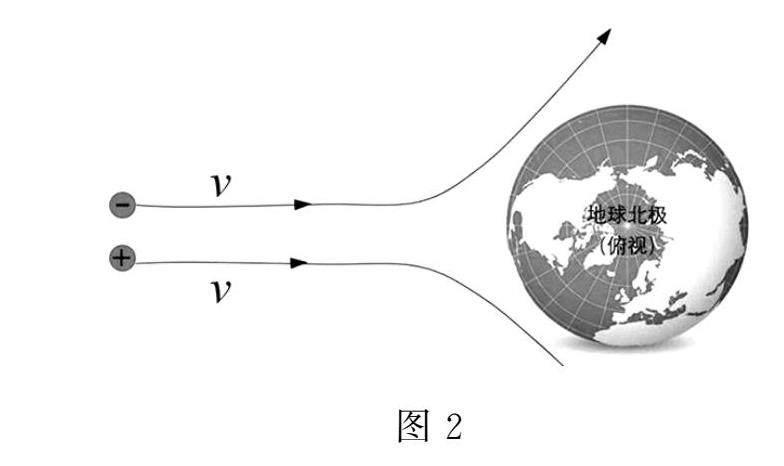
除了自由電子定向移動導電外,正的帶電粒子和帶負電的粒子形成大尺度的不一致時,會在宏觀上表現為電流.太陽向宇宙拋射出很多有正有負的帶電粒子(等離子體),如果正負電荷流量一樣,則它們綜合起來不表現出電流,但在地球附近受到地磁的作用下,特別是赤道等低緯度部分,不同電荷受到不同方向的力(都是洛倫茲力),帶正電的從地球的一邊繞行,帶負電的另一邊繞行,就會形成兩股不同的電流(圖2).而高緯度部分受洛倫茲力影響小,帶電粒子會打到大氣層分子發生反應,產生絢爛的極光[6].
熔融的金屬能導電嗎?通上電的時候,看起來不僅電子可以跑動,金屬陽離子似乎也可以跑動(如果能跑,在同一個電場下它們會朝相反的方向跑),但即使那樣后者的運動是不可持續的,金屬陽離子不能通過導線跑掉,所以導電作用的仍然是自由電子.加上熱運動的阻礙作用,熔融金屬即使能導電性能一般會下降(大家可以思考一下金屬蒸汽會導電嗎).
食鹽(氯化鈉)不一樣,常溫常壓下,氯化鈉是晶體,Cl-和Na+按晶格的形式固定,在平衡位置附近振動(熱運動),它們不能自由移動,所以不導電.但真空中熔融的氯化鈉→晶格被破壞,Cl-和Na+可以移動,若插入兩個惰性電極加上電壓通上電,在電場力的作用下:Cl-朝正極移動,Na+朝負極移動,就可以導電了.
3 電流下的化學反應
繼續討論真空狀態下加熱熔化氯化鈉通電的情況,這個時候不僅有物理變化,還有化學變化[7].在電場力的作用下:Cl-朝正極移動,在正極失去電子變為氯原子.氯原子是不穩定的,它們覺得自己的電子不夠,總想把別人的搶過來,但它周圍都是氯原子,怎么辦?兩個氯原子協商每個原子拿出一個電子作為共享,就會感覺自己周圍又多了一個電子.因為共享一對電子,兩個氯原子被結合在一起,成為氯分子,形成氯氣從熔融的漿體釋放出來;Na+朝負極移動,在負極得到電子,得到金屬鈉.化學反應為2NaCl 熔融,通電?2NaCl2↑.
如果把食鹽放到水里溶解再通上電,情況又會不一樣.食鹽在水里會溶解,晶格被破壞后電離出Cl-和Na+(圖3);除了Cl-和Na+,微觀的粒子還有大量的水分子和少量的由水分子電離生成的OH-,H+.H2O很穩定不容易電離,而OH-和H+一旦碰上就很容易變成了H2O,這是一個平衡過程H2OH++OH-.標準狀態下的水溶液中,無論酸性還是堿性,氫離子的濃度和氫氧根粒子的濃度的乘積是一定的(濃度的乘積對應著碰撞概率,即可能性),為10-14mol/L2.化學反應都是平衡過程,如果生成物不斷被排除出系統,例如氣體、沉淀,甚至人為地去除,就不容易達到平衡而某個方向的反應不斷進行下去.
對氯化鈉溶液通上電,溶液中的帶電粒子就定向移動了,OH-和Cl-帶負電它們往正極跑,H+和Na+例子帶正電它們往負極跑.這個定向移動可以持續以維持電流.正極處,Cl-比OH-容易失去電子,就生成氯氣從溶液跑了出來(先生成原子,然后兩個氯原子共享電子形成氯分子);負極處,H+比Na+容易得到電子,就生成氫氣從溶液跑了出來(先生成氫原子,然后兩個原子通過共享一對電子結合為氫分子);溶液中剩下的微小粒子是OH-和Na+,停止通電烘干就會得到白色的晶體粉末——氫氧化鈉.化學方程式2NaCl+2H2O熔融,通電2NaOH+H2↑+Cl2↑.如果繼續電解Cl-消耗殆盡,這個時候在正極就只好OH-來失去電子了,最后變成水和氧氣,化學反應4OH-+4e→2H2O+O2↑,負極仍然是會有源源不斷的H+來得到電子變成氫氣.現在實際上是在電解水2H2O通電2H2↑+O2↑.
4 結語
微觀想象力會為學生的物理和化學的學習打開一個有趣有效的大門,即使有些想象比較簡單,真實情況要復雜得多,但這可以作為深入討論那些疑問的開始.
參考文獻:
[1]徐敏姬,王偉群.融合科學閱讀發展學科素養——以“人類對原子結構的認識”為例[J].化學教與學,2022(07):2-7.
[2]王衛東.紀念盧瑟福提出原子有核模型100周年[J].物理通報,2011(09):110-114.
[3]曲秀榮.在中學物理教學中教師應注意知識的準確性與延伸性[J].中國科教創新導刊,2008(05):169.
[4]李川.多種起電成因的綜述與討論[J].物理教學,2019,41(08):21-23+43.
[5]蔣煒波,趙堅.對與自由電子相關聯的一些問題的梳理及教學建議——以金屬導體為例[J].物理通報,2021(11):140-145.
[6]楊樺,張艷,孟衛東.太陽風能吹到地球上嗎[J].高中數理化,2011(01):27-28+66.
[7]喻俊,沈甸.水參與的電解反應體系中“電極反應式書寫形式”再議[J].化學教育,2017,38(01):78-80.

