肝細胞癌過繼細胞療法研究進展
赫麗杰 李婷婷 張宇 李景圓 榮耀星 王大慶
【摘要】 肝細胞癌是嚴重威脅人類生存的一類疾病,中國肝細胞癌死亡率居世界第三。由于肝細胞癌發病早期無特異性癥狀,晚期的治療方案又存在復發率高等的種種弊端,因此尋找行之有效的治療新方法迫在眉睫。過繼細胞療法是一種細胞免疫療法,在肝臟多樣化和復雜的免疫微環境中,通過結合腫瘤特異性抗原或是非特異性的調節免疫平衡,過繼細胞療法在肝細胞癌的治療中逐漸發揮出優勢。在這篇綜述中我們闡述了肝細胞癌靶向治療常用生物標志物的形態結構及信號通路,探討總結了近年來過繼細胞療法治療肝細胞癌的研究手段及取得的臨床效果,并對接下來的研究方向進行了展望。
【關鍵詞】 肝細胞癌 生物標志物 自然殺傷細胞 T細胞受體 嵌合抗原受體T細胞
肝細胞癌(HCC)是世界范圍內第二常見的致死性腫瘤疾病,在全球范圍內發病率呈上升趨勢。在我國,HCC發病例數和死亡例數均占全世界總數的50%以上,死亡率居世界第三位。經研究調查,HCC患者5年生存率為18%,發病率占所有肝臟腫瘤疾病中的90%[1]。然而,HCC的早期檢測仍然很困難,因為患病初期患者沒有特異性的癥狀[2]。肝硬化或代謝性疾病,丙型肝炎病毒(HCV)、乙型肝炎病毒(HBV)等是HCC發病的主要原因[3],然而,目前為止對以上原因引起的HCC都沒有研究出行之有效的特異性藥物療法[4],常見的HCC治療方案有根治性治療方案,例如切除、移植、消融和聯合治療;姑息性治療方案,例如經導管動脈化療栓塞術(TACE)、全身療法和支持療法[5],然而根治性治療方案存在復發風險高的弊端,因此,目前HCC的研究重點是開發創新策略和抗腫瘤藥物[6]。免疫療法自提出以來逐漸成了癌癥治療的研究重心,但是,免疫療法并不是對所有癌癥都普遍有效[7]。由于肝臟具有多樣化和復雜的免疫微環境,HCC被認為是一種免疫原性腫瘤[8],晚期HCC常伴有免疫衰竭,調節性T細胞、髓源性抑制細胞和衰竭的T細胞數量增加[9],因此,機體本身無法有效的控制疾病的發展,隨著免疫療法的研究,過繼細胞療法作為HCC的一種新型治療方案而受到關注。常見的過繼細胞療法手段包括嵌合抗原受體T(CAR-T)細胞、自然殺傷(NK)細胞、T細胞受體(TCR)及細胞因子誘導的殺傷細胞(CIK)、樹突狀細胞-細胞因子誘導的殺傷細胞(DC-CIK)。
截至目前,已經發現了多種在HCC早期檢測或治療中發揮作用的生物標志物,本文簡單介紹了常用生物標志物的結構及HCC相關的信號通路,并討論現今HCC過繼細胞療法的研究現狀及治療效果,并對今后過繼細胞療法的研究方向進行了總結和展望。
1 常用生物標志物
GPC3基因位于X染色體,是由580個氨基酸構成的核心蛋白[10]。人類GPC3核心結構域的晶體結構和果蠅直向同源Dally樣蛋白(Dlp)相似,呈現出一個α螺旋結構,但是相較于DLP具有更彎曲的形狀[11]。GPC3在HCC、生殖細胞腫瘤、黑色素瘤中過表達,但在膽管細胞癌、膽囊癌或良性肝組織中不表達,與腫瘤的發生和預后密切相關[12]。此外,GPC3在肝癌發生的早期階段表達,有可能使HCC的早期檢測成為可能[13]。甲胎蛋白(AFP)是分子量為69~70 kDa的一種糖蛋白,由590個氨基酸組成[14],是HCC最廣泛使用的生物標志物之一,然而也有報道指出HCC患者中約20%的病例檢測不到AFP的分泌[15]。
2 HCC相關的信號通路
研究證明,HCC進程中存在c-Myc的過表達,而c-Myc是典型的Wnt信號傳導的目標,而典型Wnt/β-catenin介導的信號通路,可以刺激HCC生長[16]。在HCC患者的疾病進程中,大約95%的患者表現出Wnt/β-catenin失調[17]。β-catenin與淋巴增強因子/T細胞因子(LEF/TCF)轉錄因子家族的成員相關,能夠誘導刺激細胞周期進程和細胞存活的基因表達,促進細胞增殖[18]。Hh信號調節障礙也會促進HCC病程的發展[19]。Hh信號通路依賴于其與細胞表面的Patched蛋白的結合,使Patched蛋白對Smo的抑制能力受到影響,HCC表面抗原與Hedgehog的相互作用有高親和力,能夠與Patched競爭Hedgehog的結合,對于Hedgehog信號存在負反饋[20]。除了Wnt和Hedgehog信號通路外,還可以通過與細胞外基質中的多種相互作用影響細胞增殖,包括Hippo、HGF、IGF和FGF信號通路[21]。
3 過繼細胞療法治療HCC
3.1 CAR-T細胞
CAR-T細胞療法是將T淋巴細胞修飾后,使其具有識別特定抗原的能力并用于腫瘤治療的靶向免疫治療方法[22]。Li等[23]構建了基于hYP7的CAR-T細胞,在異種移植或原位HCC小鼠中,CAR-hYP7-T細胞能夠消除GPC3陽性腫瘤細胞,其機制有可能是降低腫瘤細胞中的Wnt信號傳導,或是通過誘導穿孔素和顆粒酶介導腫瘤細胞凋亡。CAR-T細胞療法在臨床上的研究應用較廣泛,Shi等[24]構建了二代CAR-GPC3 T細胞(4-1BB)治療復發型難治型HCC小患者,招募的13例患者中1年總存活率為42%,其中1例的存活時間達到44.2個月。Sun等[25]報道了1例在肝腫瘤切除后出現了復發和肺轉移的HCC患者接受CAR-GPC3 T細胞治療的臨床研究,在淋巴細胞清除后進行CAR-GPC3 T細胞與索拉非尼聯合治療,結果顯示腫瘤在36個月內沒有擴大,治療12個月之后達到完全緩解狀態,并維持完全緩解狀態超過24個月。為了彌補單一抗原的弊端,Cao等[26]還開發出一種新型雙特異性T細胞接合器CAR-T(CAR-T-BiTE),使其在表達GPC3特異性的同時還分泌針對B7-H3的BiTE,在體外實驗中顯示GPC3-BiTE CAR-T細胞對于表達GPC3/B7H3的細胞系的細胞毒性大于GPC3 CAR-T細胞,并且對于GPC3陰性細胞系也表現出抑制作用。
然而,由于活化的CAR-T細胞上會表達程序性死亡受體1(PD-1),而腫瘤細胞及其微環境能夠表達程序性死亡受體配體1(PD-L1)和PD-L2。PD-1與配體的結合會抑制T細胞活化,造成免疫逃逸[27]。為了尋找應對的解決辦法,Li等[28]建立了一種雙靶點CAR,其具有抗PD-1單鏈片段可變scFv和抗GPC3 scFv的細胞外抗原識別域,以幫助CAR-T細胞識別GPC3并且抵抗PD-1抑制信號,實驗結果顯示雙靶點CAR-T細胞對GPC3高表達的HuH-7細胞表現出更強的消除作用,并且對高表達PD-L1的HuH7細胞毒性增強。能夠使成瘤的NOD/SCID小鼠腫瘤生長速度降低,存活時間顯著延長。
為了應對PD-1及其配體結合抑制CAR-T功能的問題,Li等[29]也構建了一個半合成的鯊魚VNAR噬菌體文庫并分離出抗PD-L1單域抗體(B2),在此基礎上通過與GPC3和B2慢病毒共轉導生產雙特異性CAR-T細胞,Hep3B細胞毒性試驗中顯示,雙特異性CAR-T細胞的細胞毒性顯著高于任何一種單特異性CAR-T細胞,但是在Hep3B異種移植小鼠模型中,出乎意料的是雙特異性CAR-T細胞未能減輕腫瘤負荷,且效果比單特異性CAR-T細胞差。由此看來對于解除PD-1抑制作用的研究還需要繼續深入的探索。
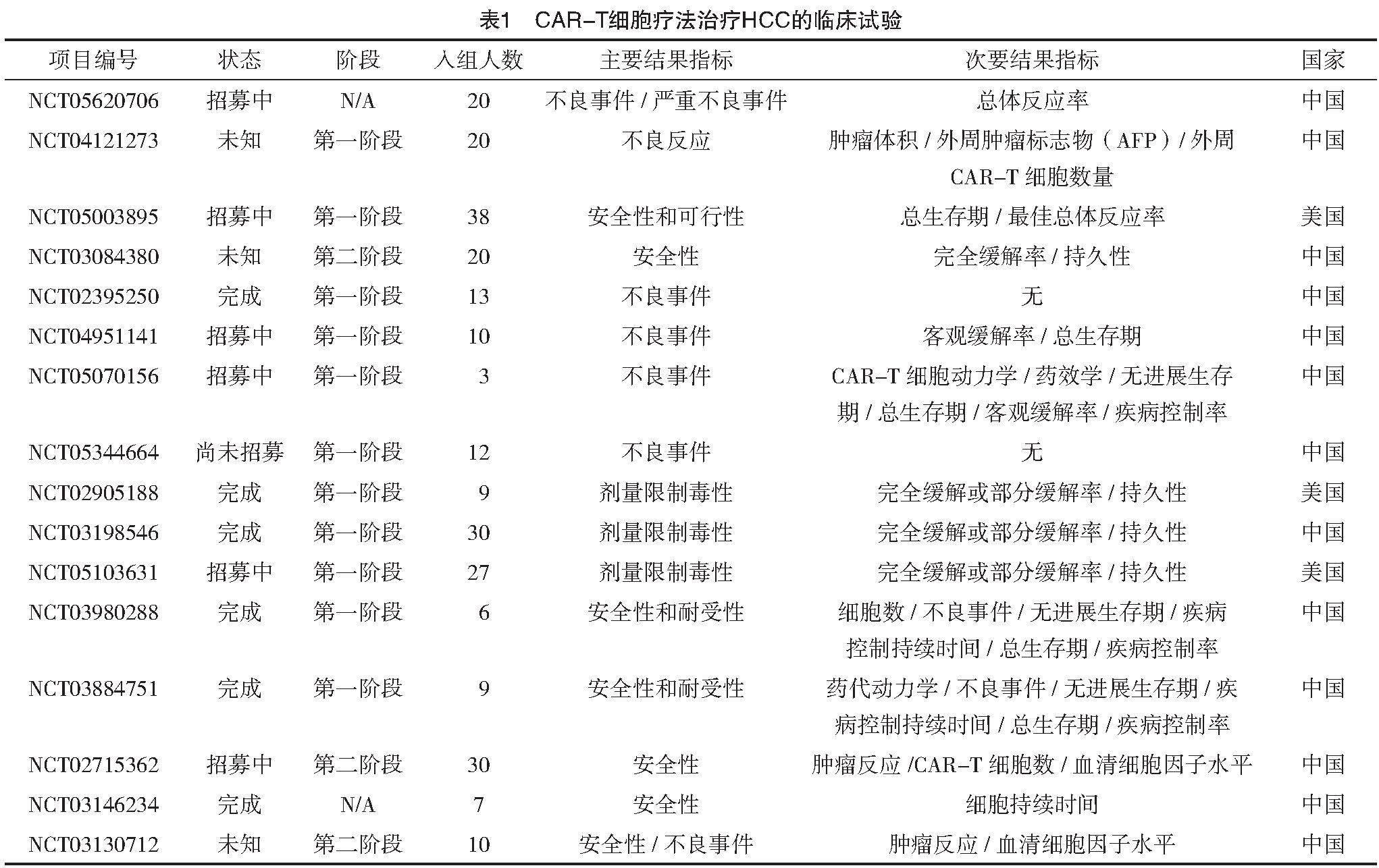
由于CAR-T細胞療法在以往的研究中取得了較為樂觀的進展,因此,針對CAR-T靶向治療,科學界進行了大量的研究。僅以最常見靶位點GPC3為例,截至目前(2023年5月17日)在美國國立衛生院的臨床試驗注冊中心登記的CAR-T細胞療法臨床試驗總結見表1。
3.2 NK細胞
NK細胞是先天性淋巴樣細胞(ILC)的一員,ILC是前線免疫效應細胞,對于宿主防御的早期階段和組織穩態的維持有至關重要的作用[30]。ILC可以在沒有抗原特異性受體的情況下發揮與CD4+輔助細胞(Th)和CD8+細胞毒性T細胞相似并互補的生物學功能[31]。
NK細胞可以通過血流在機體內循環,具有強大的細胞溶解功能,細胞表面存在著多種天然細胞毒性受體如NKP46、KG2D、CD16和KIRs,可為宿主防御微生物感染和腫瘤[32]。研究人員探索了將NK細胞聯合細胞因子共同作用的課題,Arulanandam等[33]利用生產四價多功能抗體細胞接合器的FLEX-NKTM平臺,構建了一個同時含有不誘導NKp46內化的新型人源化NKp46結合劑和人源化GPC3結合劑的雙特異性多功能抗體CYT-303,以介導NK細胞對HCC的定向殺傷。該研究結果顯示與單特異性GPC3或NKp46mAb相比,CYT-303的活性更高,這也印證了NKp46和GPC3的協同作用能夠產生免疫突觸,促進了NK細胞針對腫瘤細胞發揮功能。
白介素-12(IL-12)是一類強效的促炎細胞因子,在免疫細胞對癌細胞的反應中能夠起到促進抗腫瘤反應并調節腫瘤環境的作用[34],然而,全身應用IL-12會引起嚴重的毒性反應,為了解決這一問題,Luo等[35]利用synNotch合成受體構建了能夠定位GPC3的改造的NK92細胞,改造后的GPC3-Syn-IL-12-NK92能夠在腫瘤部位選擇性分泌IL-12,NK92細胞相比于T淋巴細胞壽命較短,因此安全性更高。在體外實驗中發現將GPC3-Syn-IL-12-NK92細胞配合CAR-T細胞與GPC3陽性細胞共培養時,會產生更多的γ干擾素(IFN-γ)和、腫瘤壞死因子-α(TNF-α),異種移植瘤NSG小鼠治療后45 d可以觀察到小鼠腫瘤體積明顯減小。
為了抵抗PD-1及其配體結合的抑制作用,Chen等[36]將PD-L1變體(L3C7c-Fc)與GPC3-CAR-NK細胞相結合,構建了靶向GPC3的GPC3-CAR-NK細胞,結果顯示L3C7c-GPC3-CAR-NK不受PD-L1抑制作用影響,增強了CAR-NK細胞的治療效果。
Zhao等[37]通過基因工程技術構建了三個具有不同鉸鏈和跨膜區域的GPC3-CAR-NK細胞,結果顯示具有CD8α鉸鏈區和4-1BB跨膜結構域的GPC3-04-CAR-NK殺瘤效率最高,與HepG2細胞共培養實驗也觀察到培養液上清中的IFN-γ表達量升高,也驗證了GPC3-04-CAR-NK的殺傷作用。
近年來對于NK細胞的研究表現為能夠在輔助其他治療手段的情況下有效的減緩腫瘤的發展,然而應用上還存在許多的弊端,首先是壽命較短的特性,這一特性能防止NK細胞在循環中存在的時間過長,提高了安全性,但是也冒著抗腫瘤活性作用時間短的風險,需要找到一個適宜的用藥時間。其次NK細胞發揮作用是以非特異性的形式,這使得NK細胞不能精準的僅作用于腫瘤組織。因此,在臨床研究中常將NK細胞和其他治療手段聯用達到增強臨床療效的目的,目前的相關研究絕大部分也都報道了可喜的成果,有望使更多的HCC患者從中受益。
3.3 TCR-T細胞
近年來,科學家圍繞過繼細胞療法開發出不同的治療手段,其中TCR改造的T細胞在腫瘤治療領域受到了廣泛的關注。TCR包含四個作用于連接啟動信號轉導的CD3多肽鏈,TCR的功能單元是由六種蛋白組成的八聚體復合物[38],能夠通過腫瘤特異性抗原和腫瘤相關抗原及主要組織相容性復合體限制肽識別靶向腫瘤細胞[39]。
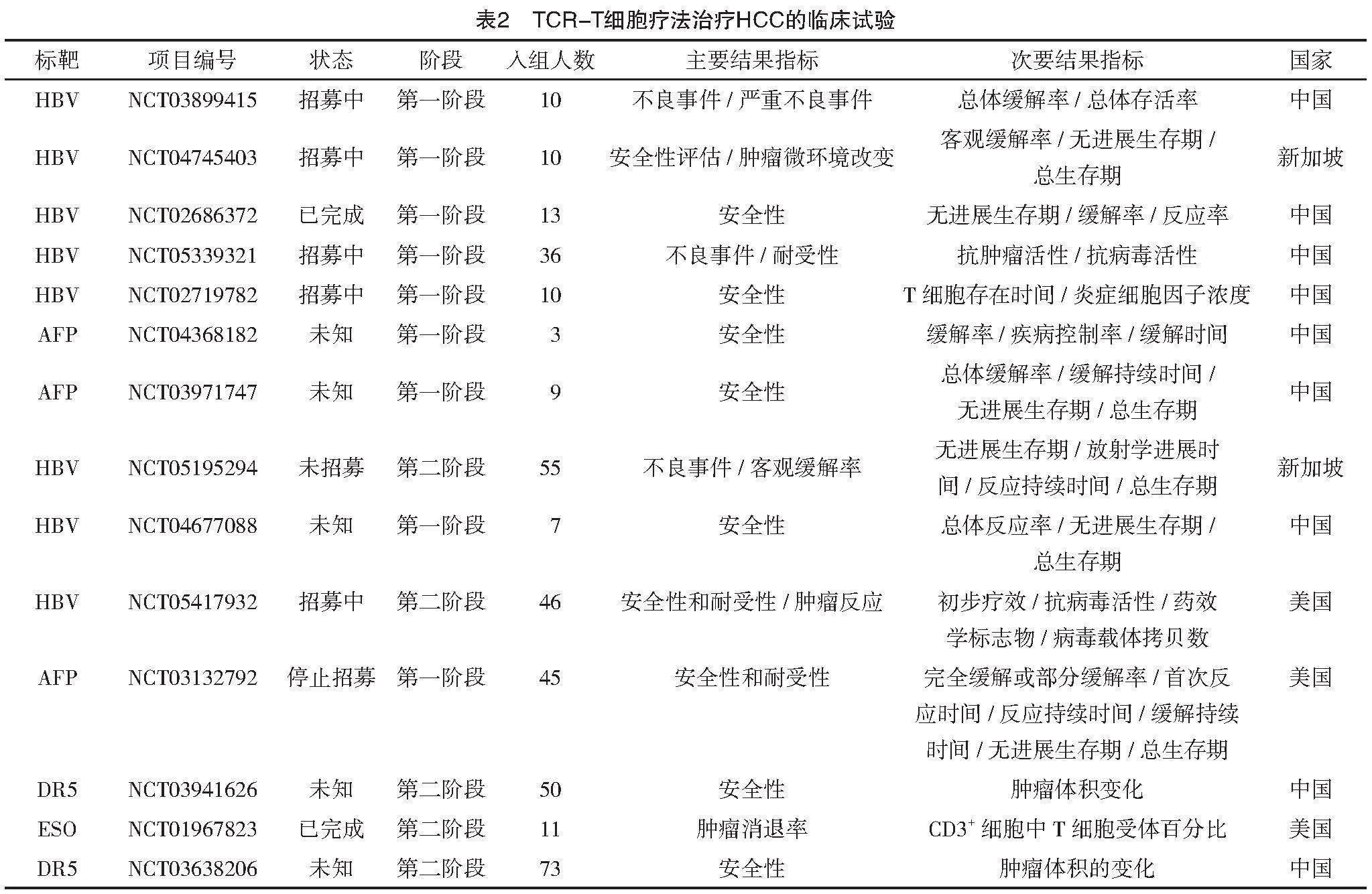
通過搜索美國國立衛生院的臨床試驗注冊中心網站發現,目前采用TCR改造的T細胞手段治療HCC的臨床研究主要圍繞著針對HBV相關HCC患者的HBV-TCR重定向T細胞治療及AFP特異性T細胞受體轉導T細胞,截至目前相關研究約14項,主要在中國、美國、新加坡開展,絕大部分研究仍處于第一階段,主要驗證TCR改造T細胞的安全性和耐受性,見表2。
在我國,HBV相關HCC占HCC病例的75%~80%,因此,目前使用HBV特異性TCR-T細胞治療HCC的研究較為熱門[40]。Meng等[41]構建了表達HBV的特異性TCR T細胞,靜脈回輸治療8例HBV相關HCC患者。結果顯示輸注后有1例患者短暫的出現丙氨酸氨基轉移酶、天門冬氨酸氨基轉移酶及膽紅素升高,這些現象在第二次TCR-T輸注后約80 d恢復正常。經過治療后7例患者循環乙型肝炎表面抗原和HBV DNA水平出現降低或穩定,1例患者肝臟腫瘤持續27.7個月顯著縮小,3例患者顯示出更長的疾病進展時間和生存期。研究結果證實了HBV特異性TCR-T細胞療法是一種技術上可行且安全的治療方法,并且在晚期HBV相關HCC患者中具有潛在的治療價值。此外,Morteza等[42]還驗證了HBV特異性TCR-T細胞治療肝移植后HCC復發的潛力,為使其不受免疫抑制藥物的影響,他們通過電穿孔特定mRNA突變CnB和IMPDH來保持HBV特異性TCR-T細胞的多功能性,同時減少排斥的風險。結果顯示治療后肝移植后HCC復發患者出現血清AFP水平波動并出現腫瘤消退的臨床體征。體外共培養結果顯示CnB和IMPDH的突變體的瞬時過表達能夠有效地抵消免疫抑制藥物的作用,但是由于mRNA電穿孔過表達細胞的突變并不能持續突變,因此對抑制作用的抵抗只能維持3~5 d。Yang等[43]也通過mRNA電穿孔獲得HBV特異性瞬時功能性T細胞,在肝移植后的HCC復發患者臨床應用中已經驗證了其具有良好的耐受性。
除此之外,AFP也是TCR-T細胞研究的熱門靶點之一,Liu等[44]構建了靶向AFP13的HLA-A*02呈遞肽的TCRm,對6例確診為晚期HCC的患者進行細胞輸注治療,沒有觀察到明顯的不良事件或細胞因子釋放綜合征,其中1例患者的原發性腫瘤和肺部轉移瘤消退。
3.4 腫瘤殺傷免疫細胞
CIK是體外擴增的異質性混合淋巴細胞群,能夠表達CD3+、CD56+和NK細胞受體等[45]。通過細胞因子混合物刺激單核細胞并培養2~4周后,這些細胞能夠擴增高達1 000倍,從而輕松地獲得大量的細胞用于后續的治療。Yang等[46]將人類CIK對J7細胞腫瘤模型小鼠進行尾靜脈注射,結果顯著抑制了腫瘤的生長。Wu等[47]將癌癥相關抗原粘蛋白1(MUC1)和GPC-3的抗體與識別T細胞的CD3抗體化學偶聯,形成偶聯CIK的雙特異性抗體,將其作用于2例HCC患者的臨床治療中,結果顯示治療后能夠維持一段時間的病情穩定,此后通過抗PD-1抗體治療獲得完全緩解。這也再次印證了通過阻斷PD-1/PD-L1通路從而阻斷免疫抑制通路,可以提高CIK的抗腫瘤活性[48]。
Haber等[49]對經皮乙醇注射、射頻消融或手術切除后的230例HCC患者使用CIK進行免疫治療,患者無復發生存期延長至14個月,總生存期延長,無額外的嚴重不良事件。總結治療效果發現CIK治療對于較小的腫瘤有更加突出的療效。Ji等[50]也將116例原發性HCC患者分為兩組,58例患者進行射頻消融術(RF)和TACE治療,58例患者在RFA和TACE治療的基礎上還進行CIK治療,治療后RFA-TACE-CIK組患者體內的CD3+、CD4+、NK細胞水平顯著升高,平均總生存期和5年生存期明顯長于RFA-TACE組患者。由于大多數癌癥患者體內T細胞亞群功能失衡,而CIK治療能夠逆轉患者的這種免疫抑制狀態,聯合常規治療手段進行CIK治療可增強患者的免疫功能,對HCC療效顯著。
樹突狀細胞(DC)可以攝取、加工和呈遞腫瘤抗原,抑制腫瘤細胞的免疫逃逸[51],具有激活初始T細胞的能力,能起到特異性的抗腫瘤免疫作用[52]。大量研究證實,DC能夠增強CIK的活性及增殖能力,誘導其分泌更高濃度的細胞因子如IL-2、IFN-γ等[53]。隨著DC-CIK免疫療法機制研究的逐步開展,在癌癥過繼細胞療法中DC-CIK療法也占據了一席之地,Xu等[54]對36例接受根治性切除術后的原發性HCC患者進行了DC/CIK-CD24免疫治療,接受4次治療的患者相比于接受2次治療的患者,4年生存率上升至52.6%,復發時間得到延緩,與基線相比,患者血清中CD3+、CD4+、CD56+T細胞有所增加,該結果驗證了DC-CIK療法調節機體免疫平衡的能力,聯合手術治療對患者的生存率能夠產生顯著的提升。Zhou等[55]將71例晚期HCC患者分為兩組,其中35例患者僅口服索拉非尼治療,36例患者口服索拉非尼的同時進行DC-CIK治療,結果發現DC-CIK聯合索拉非尼的患者相比于僅口服索拉非尼的患者肝功能得到有效改善,中位生存時間由13.8個月上升至18.6個月,治療6個月的有效率由16.7%上升為51.4%,臨床獲益率由41.9%上升至88.6%。
由于手術切除等常規手段存在復發等弊端,也為了恢復腫瘤患者體內免疫功能,CIK及DC-CIK療法應運而生,最近的研究表明,在常規治療手段的基礎上聯合使用CIK或DC-CIK治療可以增加T細胞和NK細胞的數量,恢復機體的免疫平衡,產生大量具有抗腫瘤活性的細胞來發揮抗腫瘤作用,從而延長患者的總生存期,在腫瘤細胞治療中發揮了協助的優勢。
4 結論與展望
由于常規治療手段效果不甚滿意,免疫療法勢必成為HCC治療的研究重點之一。過繼細胞療法作為一種新興的治療手段,逐漸成為臨床研究的熱點,然而作為一種發展中的治療手段,過繼細胞療法治療HCC的臨床研究絕大部分還處于第一階段,少數處于第二階段。關注的主要結果指標聚焦于不良事件和安全性。過繼細胞療法存在的弊端是,其對不表達特異性靶點的一部分腫瘤細胞作用不大,同時還存在腫瘤細胞通過不表達特異性靶點來逃避藥物作用的情況,這就造成了治療的不徹底并留下了隱患。為了彌補這一弊端,接下來的研究應該發展多抗原靶點免疫療法,以及免疫療法配合常規療法,以針對腫瘤組織中不表達特異性靶點的那一部分腫瘤細胞或抗原逃逸現象。同時,復雜的腫瘤微環境及器官移植患者免疫抑制藥物的使用都會影響過繼細胞療法的療效,針對這些問題,還需要進一步的研究。例如PD-1與配體的結合會抑制免疫細胞的活化,為防止這一現象,大量阻斷PD-1及其配體通路的研究正在開展,值得加以注意。
參考文獻
[1] LLOVET J M,ROSSI J Z,PIKARSKY E,et al.Hepatocellular carcinoma[J].Nat Rev Dis Prim,2016,2:16018.
[2] OGEL A,MEYER T,SAPISOCHIN G,et al.Hepatocellular carcinoma[J].Lancet,2022,400(10360):1345-1362.
[3] TZARTZEVA K,OBI J,RICH N E,et al.Surveillance imaging and alpha fetoprotein for early detection of hepatocellular carcinoma in patients with cirrhosis: a meta-analysis[J].Gastroenterology,2018,154:1706-1718.
[4] ITO T,NGUYEN M H.Perspectives on the underlying etiology of HCC and its effects on treatment outcomes[J].J Hepatocell Carcinoma,2023,10:413-428.
[5] YANG Y Q,WEN Z Y,LIU X Y,et al.Current status and prospect of treatments for recurrent hepatocellular carcinoma[J].World J Hepatol,2023,15(2):129-150.
[6] MOSSENTA M,BUSATO D,BO M D,et al.Novel nanotechnology approaches to overcome drug resistance in the treatment of hepatocellular carcinoma: glypican 3 as a useful target for innovative therapies[J].Int J Mol Sci,2022,23(17):10038.
[7] MURCIANO-GOROFF Y R,WARNER A B,WOLCHOK J D,et al.The future of cancer immunotherapy: microenvironment-targeting combinations[J].Cell Res,2020,30(6):507-519.
[8] KUBES P,JENNE C.Immune responses in the liver[J].Rev Immunol,2018,36:247-277.
[9] SHI J H,LI G Y,LIU L L,et al.Establishment and validation of exhausted CD8+ T cell feature as a prognostic model of HCC[J].Front Immuno,2023,14:1166052.
[10] LI N,SPETZ M R,HO M.The role of glypicans in cancer progression and therapy[J].J Histochem Cytochem,2020,68(12):841-862.
[11] AKKERMANS O,BOURGEOIS C D,PEREGRINA C.GPC3-Unc5 receptor complex structure and role in cell migration[J].Cell,2022,185(21):3931-3949.
[12] NING J,JIANG S,Li X,et al.GPC3 affects the prognosis of lung adenocarcinoma and lung squamous cell carcinoma[J].BMC Pulm Med,2021,21:199.
[13] YAO M,WANG L,FANG M,et al.Advances in the study of oncofetal antigen glypican-3 expression in HBV-related hepatocellular carcinoma[J].Biosci Trends,2016,10:337-343.
[14] CIEMNY J G,SZYMANSKI M,KUSZERSKA A,et al.The role of alpha-fetoprotein (AFP) in contemporary oncology: the path from a diagnostic biomarker to an anticancer drug[J].Int J Mol Sci,2023,24(3):2539.
[15] ?ZDEMIR F,BASKIRAN A.The importance of AFP in liver transplantation for HCC[J].J Gastrointest Cancer,2020,51:1127-1132.
[16] KOLLURI A,HO M.The role of glypican-3 in regulating Wnt, YAP, and hedgehog in liver cancer[J].Front Oncol,2019,9:708.
[17] WAGHMARE I, McCAW A P. Regulation of Wnt distribution and function by Drosophila glypicans[J]. J Cell Sci,2022,135(3):jcs259405.
[18] ZHANG L B,ADU I K,ZHANG H F,et al.The WNT/β-catenin system in chronic kidney disease-mineral bone disorder syndrome[J].Int Urol Nephrol,2023,5(10):2527-2538.
[19] CHOW K M,YAU W L,NG L.Novel molecular targets in hepatocellular carcinoma[J].World J Clin Oncol,2020,11(8):589-605.
[20] WU A,TURNER K A,WOOLFSON A,et al.The hedgehog pathway as a therapeutic target in chronic myeloid leukemia[J].Pharmaceutics,2023,15(3):958.
[21] FLEMING B D,HO M.Development of Glypican-3 targeting immunotoxins for the treatment of liver cancer: an update[J].Biomolecules,2020,10(6):934.
[22] LI X H,ZHOU J,ZHANG W W,et al.Pan-cancer analysis identifies tumor cell surface targets for CAR-T cell therapies and antibody drug conjugates[J].Cancers (Basel),2022,14(22):5674.
[23] LI D,LI N,ZHANG Y F,et al.Persistent polyfunctional chimeric antigen receptor T cells that target glypican 3 eliminate orthotopic hepatocellular carcinomas in mice[J].Gastroenterology,2020,158(8):2250-2265.
[24] SHI D H,SHI Y P,KASEB A O,et al.Chimeric antigen receptor-glypican-3 T-cell therapy for advanced hepatocellular carcinoma: results of phase Ⅰ trials[J].Clin Cancer Res,2020,26(15):3979-3989.
[25] SUN H W,XING C Y,JIANG S F,et al.Long term complete response of advanced hepatocellular carcinoma to glypican-3 specific chimeric antigen receptor T-cells plus sorafenib, a case report[J].Front Immunol,2022,13:963031.
[26] CAO G Z,ZHANG G Z,LIU M X,et al.GPC3-targeted CAR-T cells secreting B7H3-targeted BiTE exhibit potent cytotoxicity activity against hepatocellular carcinoma cell in the in vitro assay[J].Biochem Biophys Rep,2022,31:101324.
[27] LEMOINE J,RUELLA M,HOUOT R,et al.Born to survive: how cancer cells resist CAR T cell therapy[J].J Hematol Oncol,2021,14:199.
[28] LI D Z,QIN J,ZHOU T,et al.Bispecific GPC3/PD-1 CAR-T cells for the treatment of HCC[J].Int J Oncol,2023,62(4):53.
[29] LI D,ENGLISH H J,HONG J.A novel PD-L1-targeted shark VNAR single-domain-based CAR-T cell strategy for treating breast cancer and liver cancer[J].Mol Ther Oncolytics,2022,24:849-863.
[30] MARIOTTI F R,SUPINO D,LANDOLINA N,et al.IL-1R8: a molecular brake of anti-tumor and anti-viral activity of NK cells and ILC[J].Semin Immunol,2023,66:101712.
[31] VIVIER E,ARTIS D,COLONNA M,et al.Innate lymphoid cells: 10 years on[J].Cell,2018,174:1054-1066.
[32] SABETKAM S,KALARESTAGHI H,MAZLOUMI Z,et al.The dysfunction of natural killer cells is essential for the development of type 1 diabetes[J].Pathol Res Pract,2023,247:154556.
[33] ARULANANDAM A,LIN L,CHANG H M,et al.Derivation and preclinical characterization of CYT-303, a novel NKp46-NK Cell Engager Targeting GPC3[J].Cells,2023,12(7):996.
[34] TRINCHIERI G.Interleukin-12 and the regulation of innate resistance and adaptive immunity[J].Nat Rev Immunol,2003,3:133-146.
[35] LUO H,WU X Q,SUN R X,et al.Target-dependent expression of IL12 by synNotch receptor-engineered NK92 cells increases the antitumor activities of CAR-T cells[J].Front Oncol,2019,9:1448.
[36] CHEN L,LIU S Y,ADAH D.Soluble programmed death ligand-1-induced immunosuppressive effects on chimeric antigen receptor-natural killer cells targeting Glypican-3 in hepatocellular carcinoma[J].Immunology,2023,169(2):204-218.
[37] ZHAO J F,LIN L J,LUO Y H,et al.Optimization of GPC3-specific chimeric antigen receptor structure and its effect on killing hepatocellular carcinoma cells[J].Bioengineered,2021,12(1):3674-3683.
[38] CHEN C,LIU X,CHANG C Y,et al.The interplay between T cells and cancer: the basis of immunotherapy[J].Genes (Basel),2023,14(5):1008.
[39] MANFREDI F,CIANCIOTTI B C,POTENZA A,et al.TCR redirected T cells for cancer treatment: achievements, hurdles, and goals[J].Front Immunol,2020,11:1689.
[40] KULIK L,EL-SERAG H B.Epidemiology and management of hepatocellular carcinoma[J].Gastroenterology,2019,156:477-491.
[41] MENG F P,ZHAO J F,TAN A T,et al.Immunotherapy of HBV-related advanced hepatocellular carcinoma with short-term HBV-specific TCR expressed T cells: results of dose escalation, phase Ⅰ trial[J].Hepatol Int,2021,15(6):1402-1412.
[42] MORTEZA H,MEIYIN L,ADELINE C,et al.Immunosuppressive drug-resistant armored T-cell receptor T cells for immune therapy of HCC in liver transplant patients[J].Hepatology,2021,74(1):200-213.
[43] YANG F,ZHENG X F,KOH S,et al.Messenger RNA electroporated hepatitis B virus (HBV) antigen-specific T cell receptor (TCR) redirected T cell therapy is well-tolerated in patients with recurrent HBV-related hepatocellular carcinoma post-liver transplantation: results from a phase Ⅰ trial[J].Hepatol Int,2023,17(4):850-859.
[44] LIU C,LIU H,DASGUPTA M,et al.Validation and promise of a TCR mimic antibody for cancer immunotherapy of hepatocellular carcinoma[J].Sci Rep,2022,12(1):12068.
[45] SCHMIDT-WOLF I G,LEFTEROVA P,JOHNSTON V,et al.Propagation of large numbers of T cells with natural killer cell markers[J].British Journal of Haematology,1994,87(3):453-458.
[46] YANG C K,HUANG C H,HU C H,et al.Immunophenotype and antitumor activity of cytokine-induced killer cells from patients with hepatocellular carcinoma[J/OL].PLoS One,2023,18(1):e0280023.https://pubmed.ncbi.nlm.nih.gov/36598909/.
[47] WU T,ZHANG L Z,ZENG Z,et al.Complete response to PD-1 inhibitor in primary hepatocellular carcinoma patients post-progression on Bi-specific antibody conjugated CIK cell treatment: a report of two cases[J].Onco Targets Ther,2021,14:5447-5453.
[48] DAI C,LIN F,GENG R,et al.Implication of combined PD-L1/PD-1 blockade with cytokine-induced killer cells as a synergistic immunotherapy for gastrointestinal cancer[J].Oncotarget,2016,7(9):10332-10344.
[49] HABER P K,PUIGVEH? M,CASTET FLORIAN.Evidence-based management of hepatocellular carcinoma: systematic review and meta-analysis of randomized controlled trials (2002-2020)[J].Gastroenterology,2021,161(3):879-898.
[50] JI Q,FU Y D,ZHU X W,et al.Effect of RFA and TACE combined with postoperative cytokine-induced killer cell immunotherapy in primary hepatocellular carcinoma[J].J BUON,2021,26(1):235-242.
[51] LU D,LI T,YANG Z Q,et al.DC-CIK combined with chemotherapy on the efficacy, immune function, and life quality in colorectal cancer patients after radical resection[J].Am J Transl Res,2023,15(4):2793-2801.
[52] BRYANT C E,SUTHERLAND S,KONG B,et al.Dendritic cells as cancer therapeutics[J].Semin Cell Dev Biol,2019,86:77-88.
[53] DONG M,ZHANG G Z,MENG J,et al.MMP9-associated tumor stem cells, CCL1-silenced dendritic cells, and cytokine-induced killer cells have a remarkable therapeutic efficacy for acute myeloid leukemia by activating T cells[J].Stem Cells Int,2023,2023:2490943.
[54] XU K Y,MENG Z J,MU X X,et al.One single site clinical study: to evaluate the safety and efficacy of immunotherapy with autologous dendritic cells, cytokine-induced killer cells in primary hepatocellular carcinoma patients[J].Front Oncol,2020,10:581270.
[55] ZHOU Z,QIN H,WENG L X,et al.Clinical efficacy of DC-CIK combined with sorafenib in the treatment of advanced hepatocellular carcinoma[J].J BUON,2019,24(2):615-621.

