拮抗劑方案中卵泡期黃體生成素變化幅度對不孕癥患者卵巢反應性及妊娠結局的影響*
安 靜,石盼盼,張 祥,陳宥藝,楊 洋,趙 靜
(西安市人民醫院/西安市第四醫院生殖醫學中心,西安 710004)
體外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)已廣泛應用于不孕癥的治療,其核心環節是通過控制性超促排卵(controlled ovarian hyperstimulation,COH)獲得優質的卵子來取得最佳治療結局,而患者個體化COH方案的制訂需要正確評估外源性促性腺激素(gonadotropin,Gn)刺激下卵巢的反應性。既往將基礎性激素、抗苗勒管激素(anti-mullerian hormone,AMH)、竇卵泡數(antral follicle count,AFC)作為卵巢反應性評估的常用指標,自2011年起有學者提出卵泡輸出率(follicular output rate,FORT)[1]、卵巢敏感指數(ovarian sensitivity index,OSI)[2-3]和卵泡-卵母細胞指數(follicle-to-oocyte index,FOI)[4]等評估卵巢反應性的新指標。在實際COH過程中,傳統指標對卵巢反應性的評估存在局限性,而新指標雖然被證明對卵巢反應性及輔助生殖技術(assisted reproductive technology,ART)結局有指導作用,但由于這類指標是根據ART結局進行回顧分析獲得,對正在進行的COH意義不大。隨著拮抗劑方案的深入應用,黃體生成素(luteinizing hormone,LH)在卵泡發育、卵子成熟、黃體形成和維持等各方面的作用[5-6]已經被證實。但既往研究中對拮抗劑方案下LH水平與ART相關性的報道大多停留在對人絨毛膜促性腺激素(human chorionic gonadotropin,HCG)注射日LH水平的探討,且結論不一,忽略了COH早期的LH水平變化。本研究基于卵巢正常反應不孕癥患者拮抗劑方案COH過程中卵泡期LH變化幅度進行分組,分析不同LH波動情況卵巢對Gn的反應性及對新鮮周期移植妊娠結局的影響,從而為臨床工作中早期評估卵巢反應性提供理論依據。
1 資料與方法
1.1 一般資料
選取2019年1月至2021年12月本院生殖醫學中心行IVF-ET治療的277例不孕癥患者。納入標準:(1)符合IVF-ET助孕標準;(2)年齡20~40歲;(3)BMI 18~28 kg/m2;(4)拮抗劑方案促排卵并完成新鮮周期移植;(5)月經周期21~35 d。排除標準:(1)合并內分泌疾病者,如多囊卵巢綜合征;(2)合并子宮內膜病變者(包括子宮內膜增生、宮腔粘連、宮腔占位性病變);(3)合并中重度子宮內膜異位癥及子宮腺肌癥者;(4)子宮畸形者;(5)復發性流產者。
1.2 方法
1.2.1診療過程
1.2.1.1拮抗劑方案促排卵
月經第2~3天參考患者年齡、BMI、基礎內分泌及AFC給予Gn 100~225 U啟動促排卵,Gn種類包括注射用重組人卵泡刺激素(recombinant follicle stimulating hormone,r-FSH,瑞士默克雪蘭諾公司)、注射用尿促卵泡刺激素(urine-derived follicle stimulating hormone,u-FSH,珠海麗珠醫藥集團股份有限公司)。促排卵過程中根據B超監測卵泡生長情況,結合激素檢查結果適時調整Gn用量并加用促性腺激素釋放激素(gonadotropin-releasing hormone,GnRH)拮抗劑(瑞士默克雪蘭諾公司)0.25 mg/d,持續至HCG注射日。當卵泡平均直徑達到標準時給予GnRH激動劑(德國輝凌公司)0.2 mg及HCG(珠海麗珠醫藥集團股份有限公司)4 000 U聯合扳機。36 h后行超聲引導下經陰道后穹隆穿刺取卵術。
1.2.1.2胚胎培養及胚胎移植策略
取卵術后第3天移植1~2枚胚胎,或第5天移植1枚囊胚,剩余胚胎繼續培養或冷凍保存。胚胎移植后進行常規黃體支持,移植后12~14 d測量HCG水平,移植后28~30 d行經陰道B超檢查確定是否宮內妊娠。
1.2.2分組
檢測COH過程中不同時間節點血清激素水平。均于上午8:00前進行血液檢測,檢查前未注射促排卵藥物。計算Gn啟動后LH變化幅度(Gn啟動后第4天LH-基礎LH),并據此將患者分為3組:高LH組(大于納入患者LH變化水平的第67位百分位數,n=91)、中LH組(處于納入患者LH變化水平的第33~67位百分位數,n=93)和低LH組(小于納入患者LH變化水平的第33位百分位數,n=93)。
1.2.3觀察指標及定義
(1)基本臨床特征,包括年齡、體重、BMI、AFC、不孕年限、基礎卵泡刺激素(follicle stimulating hormone,FSH)、雌二醇、睪酮、LH、不孕類型;(2)COH過程中的Gn使用情況(包括Gn時間、總量、啟動劑量)、HCG注射日激素水平(包括HCG注射日雌二醇、LH、孕酮)及卵巢反應性指標(包括FORT、FOI、OSI);(3)實驗室結局[包括獲卵數、成熟卵(metaphase II,MII)卵子數、雙原核受精數、成胚數及優質胚胎數]和新鮮周期移植妊娠結局(移植日內膜厚度、臨床妊娠率、生化妊娠率、早期流產率)。生化妊娠:胚胎移植后12~14 d血HCG>5 U/L;臨床妊娠:胚胎移植后28~30 d行B超檢查顯示宮內孕囊及胎芽;FORT=HCG注射日16~22 mm卵泡數/AFC×100%;FOI=獲卵數/AFC;OSI=獲卵數/Gn總量×1 000。
1.3 統計學處理
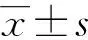
2 結 果
2.1 基本臨床特征比較
3組體重、BMI、AFC、基礎LH水平有明顯差異(P<0.05),其他指標無明顯差異(P>0.05),見表1。

表1 3組基本臨床特征比較[M(Q1,Q3)]
2.2 Gn使用情況、HCG注射日激素水平及卵巢反應性指標比較
3組Gn時間、總量、啟動劑量比較,差異均有統計學意義(P<0.05);進一步兩兩比較顯示,高LH組Gn時間最短,Gn總量和啟動劑量最少,與其他兩組比較均有明顯差異(P<0.016),見表2。3組HCG注射日雌二醇水平、FORT、OSI比較,差異均有統計學意義(P<0.05);進一步兩兩比較顯示,高LH組HCG注射日雌二醇水平、OSI最高,FORT最低,且與低LH組比較有明顯差異(P<0.016);但3組HCG注射日LH、孕酮水平、FOI均無明顯差異(P>0.05),見表3。

表2 3組Gn使用情況比較

表3 3組HCG注射日激素水平及卵巢反應性指標比較[M(Q1,Q3)]
2.3 實驗室及新鮮周期移植妊娠結局比較
3組獲卵數、MII卵子數、雙原核受精數、成胚數及優質胚胎數比較,差異均有統計學意義(P<0.05);進一步兩兩比較顯示,高LH組獲卵數、MII卵子數、雙原核受精數、成胚數及優質胚胎數均高于其他兩組,差異有統計學意義(P<0.016);但3組臨床妊娠率、生化妊娠率及早期流產率比較,差異均無統計學意義(P>0.05),見表4。

表4 3組實驗室及臨床結局比較[M(Q1,Q3)]
3 討 論
目前臨床上常用AMH、AFC和基礎 FSH水平評估IVF周期的卵巢反應情況[7-8],FORT、FOI和OSI等新指標也受到關注,且已被認為與IVF結果存在正相關關系[9],尤其OSI較其他指標能更好地代表卵巢反應性[10],與臨床妊娠的關系更密切。但目前關于這些卵巢反應性指標的研究多為回顧性總結,雖然能評估患者已結束周期的卵巢反應情況并對下一周期具有一定的指導作用,但對于正在進行的COH周期結局無法作出預測,而在現實臨床工作中需要通過卵巢反應性實時調整Gn,并對患者預后有相應的預期。
FSH和LH是下丘腦-垂體-性腺軸激素,在生殖細胞形成過程中起著關鍵作用[11-12],共同觸發卵子發生和卵母細胞減數分裂成熟[13]。已證實FSH為早卵泡期卵泡發育的主要影響因素,LH則被認為主要參與卵泡發育晚期與卵子成熟及排出,目前LH相關研究多探討晚卵泡期LH水平與妊娠結局的相關性,而LH在早卵泡期的作用被忽略。因此,本研究收集Gn啟動后第一次復查血清LH水平,并計算其與COH前基礎LH水平的差值后進行統計分析。Gn啟動后第一次復查時機作為患者COH過程中第一次觀察卵巢反應性的節點,此時尚未使用拮抗劑干預LH水平,Gn用藥后LH、FSH、雌二醇水平在一定程度上可以反映卵巢的反應性,而既往臨床上也多通過此時雌二醇的升高程度評估卵巢的反應性并進行Gn藥物調整。本研究結果顯示,早期LH出現不同程度的降低,且高LH組Gn后雌二醇水平最高。
早期LH下降可能是由FSH作用下早卵泡期雌激素輕度上升對垂體產生的反饋調節引起,但隨著COH過程的進行,雌二醇因大量卵泡生長而升高,LH受體在晚卵泡期需求量增大及雌二醇的正反饋作用,導致LH隨后增高,參與調控卵泡成熟及排出過程。隨著拮抗劑被證明可用于快速且可逆地抑制LH釋放,抑制早發排卵[14],使用GnRH拮抗劑方案已逐漸成為主流[15-17]。大量學者進行了生殖過程中LH作用的相關研究。ARROYO等[18]綜合多項研究,明確了LH對卵母細胞成熟及胚胎發育的作用機制;SUN等[19]研究發現,LH水平與獲得的卵母細胞、成熟卵母細胞、胚胎和優質胚胎數量呈正相關;還有研究表明,卵泡期LH水平波動對卵母細胞的形態和功能變化有明顯影響,并進一步影響其減數分裂狀態和受精能力[20-22];此外,最新的Delphi共識中指出,卵泡的發育取決于LH水平變化的方向和速率,而非某一特定時間點的LH水平[23]。
本研究通過COH過程第一觀察節點LH的變化水平來判斷卵巢對Gn的反應性,能更早評估卵巢反應性并預估可能的結局,有利于及時進行藥物調整及醫患溝通,在臨床COH過程中達到醫患雙方滿意的最佳結局。結果顯示,LH下降幅度最大的高LH組在最短的Gn時間內,使用最少的Gn量,但獲卵數、MII卵子數、雙原核受精數、成胚數及優質胚胎數均最高,且與其他兩組比較差異有統計學意義(P<0.016)。而高LH組的FORT處于低水平,可能因為納入患者雖然排除了多囊卵巢綜合征,但部分仍然具備超聲學上的多囊卵巢綜合征征象,而FORT以AFC作為計算標準,故高LH組雖然有較高的獲卵數,FORT卻并不高。OSI在高LH組中最高,且與其他兩組有明顯差異(P<0.016)。新鮮周期移植的生化妊娠率在高LH組、中LH組及低LH組中分別為57.14%、 56.99%和63.44%;臨床妊娠率分別為56.04%、 53.76%和62.37%,早期流產率分別為13.73%、4.00%和3.45%。相較于其他兩組,低LH組有較高的HCG注射日LH水平、生化妊娠率及臨床妊娠率,較低的早期流產率,而高LH組有較低的HCG注射日LH水平,較高的早期流產率,雖然3組間無明顯差異(P>0.05),但也提示卵泡發育及胚胎著床可能存在LH“窗值”,在促排卵過程中保持適當的LH水平對新鮮周期移植妊娠結局是有意義的[24],這與既往研究提示HCG注射日LH≥4 mIU/mL組妊娠結局較好的結論相似[25-26]。因本研究納入的周期均進行了新鮮周期移植且獲得結局,故未進行累計妊娠率的統計。優質胚胎及胚胎數量多是良好妊娠結局的保障[27-29],高LH組擁有較高的成胚數及優質胚胎數,這也從側面預測其可能獲得的高累計妊娠率。
綜上所述,卵巢正常反應不孕癥患者拮抗劑方案COH過程卵泡期LH下降幅度不同組別間新鮮周期移植臨床妊娠率無明顯差異,但高LH組可以在更短的時間里獲取更好的胚胎數量及質量,推測在COH早期LH下降幅度可在一定程度上影響卵巢反應性、胚胎結局及累計妊娠率;此外,高LH組有較高的早期流產率,提示在卵泡后期添加外源性LH具有一定的臨床意義,且在后續新鮮周期移植策略及黃體支持上需要謹慎。但由于本研究納入樣本量較小,后續仍需擴大樣本量,并進一步觀察后期添加LH的影響。

