應用T1與T2加權比值探討0~2歲嬰幼兒創傷性腦損傷灰質髓鞘的改變
張澤棟 孫惠苗 靳波 李倩云 楊宏
摘要 目的: 應用T1與T2加權比值探討0~2歲嬰幼兒創傷性腦損傷(TBI)腦灰質髓鞘的改變。 方法: 基于常規T1加權和T2加權圖像計算得到T1與T2加權比值圖,并提取90個大腦灰質區域的T1與T2加權比值,比較37例嬰幼兒TBI(TBI組)與43名健康對照者(HC組)腦灰質髓鞘的差異。采用兩獨立樣本 ?t 檢驗和Mann.Whitney ??U 檢驗比較TBI組與HC組腦灰質髓鞘T1與T2加權比值的差異,并對所得 ?P 值進行假發現率(FDR)矯正;為了捕獲灰質在快速髓鞘化階段的區域差異,將0~2歲的嬰幼兒按照每6個月為1組分為4組。應用二次擬合曲線建立TBI組與HC組灰質T1與T2加權比值隨年齡變化的發育軌跡圖。 結果: TBI組雙側中央旁回、雙側補充運動區及左側海馬等22個腦區的T1與T2加權比值低于HC組( P <0.05)。7~12月亞組中,TBI組雙側尾狀核、雙側殼核等8個腦區T1與T2加權比值低于HC組( P <0.05)。19~24月亞組中,TBI組雙側海馬、雙側海馬旁回等包括顳枕葉在內的52個腦區T1與T2加權比值低于HC組( P <0.05)。0~2歲嬰幼兒及亞組(7~12月組、19~24月組)中,TBI組雙側尾狀核、雙側殼核、右側顳橫回,左側梭狀回及左側補充運動區的T1與T2加權比值均低于HC 組( P <0.05)。HC組發育軌跡表現為0~2 歲內T1與T2加權比值持續上升;TBI組發育軌跡表現為0~16月T1與T2加權比值快速上升,之后下降。從發育軌跡可知,TBI組T1與T2加權比值整體低于HC組。 結論: T1與T2加權比值可作為評估TBI嬰幼兒腦灰質髓鞘改變的代替指標,TBI組T1與T2加權比值的發育軌跡低于HC組,且在19~24月最明顯。T1與T2加權比值提示脫髓鞘和髓鞘異常發育,可為TBI患兒腦灰質研究提供新思路。
關鍵詞 ?創傷性腦損傷;嬰幼兒;T1與T2加權比值;灰質髓鞘
doi: ?10.12102/j.issn.1672.1349.2024.10.033
創傷性腦損傷(traumatic brain injury,TBI)是指外部機械力對大腦造成的獲得性腦損傷 ?[1] 。在兒童中,嬰幼兒TBI發生率最高 ?[2] 。跌倒、運動、鈍器創傷及機動車事故是兒童TBI的主要原因 ?[3] 。TBI可對大腦灰質與白質產生直接機械沖擊,引起壓迫、撕裂、剪切等,直接損傷受傷部位細胞和血管 ?[4.5] ,進而導致髓鞘損傷和脫髓鞘改變 ?[6.8] ,且這種脫髓鞘可擴散到遠端,超出初始損傷的部位,導致感覺、運動、認知和自主神經功能受損 ?[9] 。因此,評估嬰幼兒髓鞘損傷具有重要的臨床意義。
灰質內髓鞘形成是出生后大腦發育的重要過程,且0~2歲內髓鞘化速度最快 ?[10.12] ,髓鞘形成可保證有效的信號傳輸和結構支持 ?[13.15] ,調節發育過程中突觸形成 ?[16] ,具有一定的區域特異性 ?[17.19] 。應用常規磁共振成像(MRI)技術評估嬰幼兒的髓鞘形成可能受限,由于嬰幼兒大腦MRI對比度低,髓鞘損傷的細微改變較難檢測到。由于嬰兒大腦中水分含量較高,常 規序列如液體衰減反轉恢復序列(fluid ?attenuated ?inversion recovery,FLAIR)和彌散加權成像(diffusion weighted imaging,DWI)檢查,可能導致患有髓鞘相關 損傷的嬰兒漏診,如缺氧缺血性損傷(hypoxic.ischemic injury,HII) ?[20.21] 。隨著人們將研究聚焦于量化灰質結構,尤其是灰質內髓鞘形成時,量化兒童灰質髓鞘含量取得了一定成果,如相關研究應用髓鞘水分數(myelin water fraction,MWF)和磁化轉移(magnetization transfer,MT)表征了兒童皮質髓鞘的形成 ?[17,22] 。雖然這些技術可評估髓鞘含量,但存在一定的局限性,MWF在定量信息方面功能強大,但掃描時間較長,不適合在兒童中應用 ?[23] ;MT是量化髓鞘含量的間接指標,不一定與髓鞘含量直接相關 ?[4] 。
T1與T2加權比值是一種有效評估大腦髓鞘含量的測量方法。該方法基于常規T1加權序列(T1WI)和T2加權序列(T2WI)圖像,提高了髓鞘信號的對比度和敏感性 ?[24] 。與其他評估髓鞘的方法(如MT/MWF)相比,T1與T2加權比值未增加總掃描時間,且后處理過程相對簡單 ?[25.26] 。這種方法開始應用于灰質內髓鞘含量的評估 ?[27.29] ,之后廣泛應用于白質髓鞘含量的相關研究中 ?[30.31] 。相關研究證實了T1與T2加權比值可作為反映TBI后灰質髓鞘含量變化的可靠指標 ?[32.33] 。另有研究表明,孤獨癥譜系障礙(autism spectrum disorder,ASD)高風險嬰兒在幾個早期髓鞘區域(如視覺、后扣帶回、楔前皮質)的T1與T2加權比值低于健康對照組,且較高的T1與T2加權比值與較高的發育水平得分相關 ?[27] 。目前,T1與T2加權比值應用于TBI嬰幼兒腦灰質髓鞘改變的研究較少。本研究應用T1與T2加權比值探討0~2歲嬰幼兒TBI腦灰質髓鞘的改變,現報道如下。
1 資料與方法
1.1 一般資料
選取2021年1月—2023年5月在山西省兒童醫院確診的TBI患兒(TBI組)。TBI組納入標準:外力導致的非穿透性腦損傷;年齡0~2歲;接受檢查時間距離腦外傷時間≤7 d;有完整的MRI檢查數據;所有患兒監護人均簽署知情同意書,自愿參與本研究。TBI組排除標準:其他神經系統疾病,包括多動癥、精神分裂癥、癲癇癥、腦腫瘤。收集年齡、性別與TBI組匹配 的同期健康對照者(HC組)。HC組納入標準:年齡 0~2歲;完整的MRI檢查數據;所有健康對照者監護人均簽署知情同意書,自愿參與本研究。HC組排除標準:12個月內有TBI史、腦震蕩史、任何導致的多發性創傷外傷史;有神經或精神類疾病史。所有檢查對象均在鎮靜情況下完成檢查。本研究經醫院倫理委員會批準(批準文號:IRB.KYSB.2023.028)。
1.2 檢查方法
采用5%水合氯醛按1 mL/kg灌腸檢查對象,佩戴聽力保護裝置,檢查對象待熟睡后掃描。采用美國GE DISCOVERY MR750W 3.0T磁共振儀,頭部矩陣線圈。T1WI:重復時間(TR)1 750 ms,回波時間(TE) 27.3 ms;T2WI:TR 5 231 ms,TE 128.7 ms;成像中的視野大小(FOV)200 mm×200 mm,矩陣256×256,層厚/層間距5.0 mm/1.2 mm,激勵次數2次。
1.3 數據處理
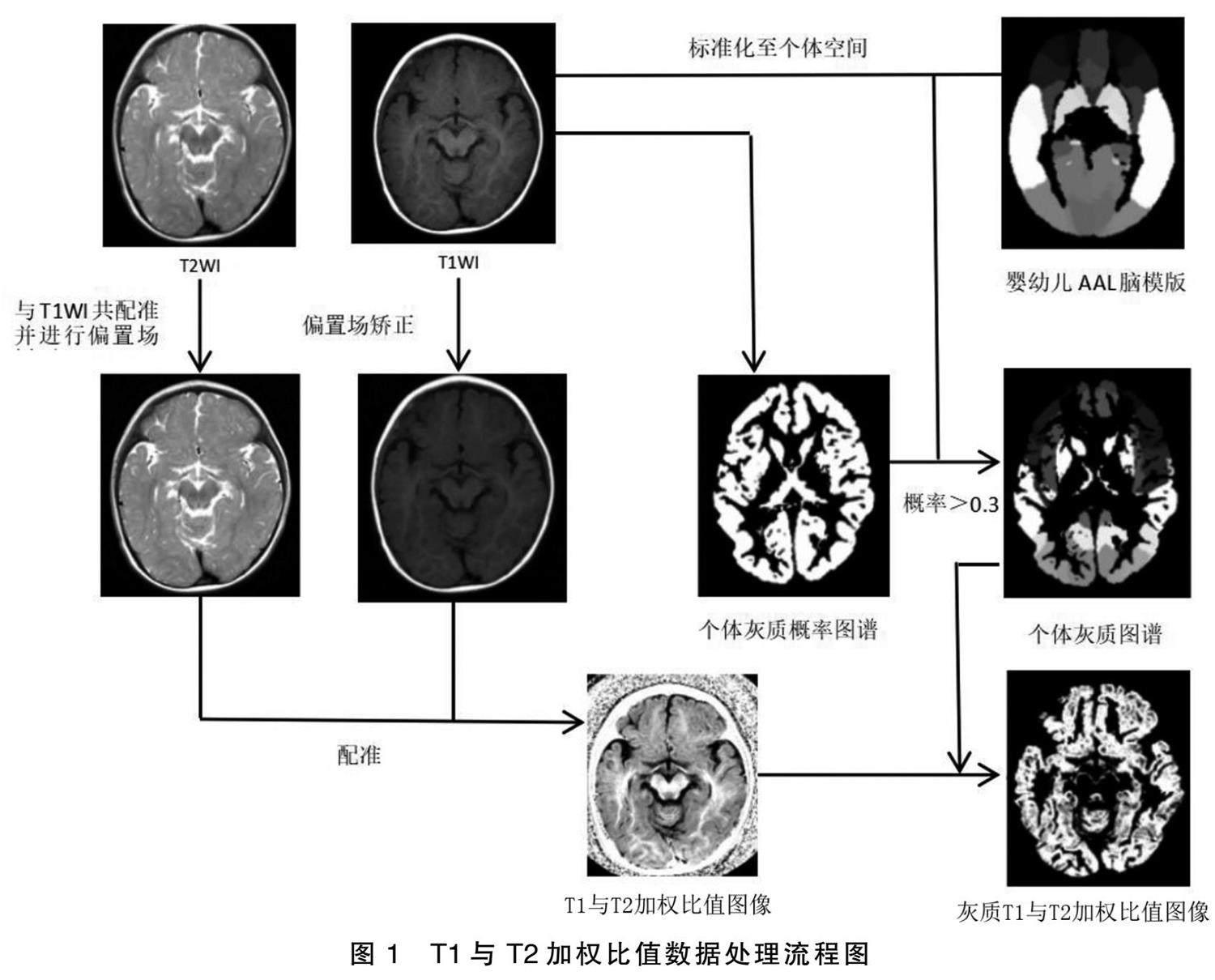
使用MATLAB2021 SPM12進行數據處理,詳見圖1。1)手動矯正原點:對T1WI、T2WI圖像進行手動原點矯正,包括調節左右腦至對稱,起始點被手動調節為前聯合。2)將研究對象的T1加權圖像與T2加權圖像進行嚴格配準。3)對T1加權圖像與T2加權圖像進行偏置場矯正,糾正由于患兒位置、減少掃描儀等因素所致的圖像質量差異。4)利用上述步驟得到的T1與T2加權比值圖像。5)利用SPM12分割功能對T1WI數據進行分割,得到灰質、白質、腦脊液的概率圖。在灰質圖譜中,將>0.3的概率作為個體灰質掩膜。6)將嬰幼兒自動解剖標記(anatomical automatic labeling,AAL)圖譜模板(UNC 0.1.2 Infant Atlases ?[34] ,NITRC:UNC 0.1.2 Infant Atlases:Tool/Resource Info)標準化至個體空間,并根據個體灰質掩膜得到個體灰質圖譜。7)利用T1與T2加權比值圖像與個體灰質圖譜計算得到基于感興趣區(ROI)分析得到的平均T1與T2加權比值。AAL模板共116個區域,本研究屬于大腦90個灰質區域。采用二次擬合曲線建立T1與T2加權比值隨年齡變化的發育軌跡。
1.4 統計學處理
應用SPSS 26.0統計軟件進行數據分析。采用Mann.Whitney ?U 檢驗、 χ ?2檢驗或Fisher確切概率法進行TBI組與HC組人口學資料比較;符合正態分布的定量資料以均數±標準差( x ?± s )表示,非正態分布的定量資料以中位數、四分位數[ M ( P ??25 , P ??75 )]表示,兩獨立樣本 t 檢驗和Mann.Whitney ?U 檢驗用于比較TBI組與HC組灰質T1與T2加權比值的組間差異。對所得的 P 值進行假發現率(FDR)矯正,以 P <0.05為差異有統計學意義。
2 結 果
2.1 兩組一般資料比較
TBI組入組38例,HC組入組44名,兩組各1例因為圖像質量無法進行相關圖像后處理被排除,最終TBI組納入37例,HC組納入43名。根據樣本分布及各個階段數據,后續分析以每6個月進行分組:0~6月、7~12月、13~18月、19~24月。TBI組與HC組月齡、性別比較,差異均無統計學意義( P >0.05)。詳見表1、表2。
2.2 TBI組與HC組雙側大腦各腦區T1與T2加權比值比較
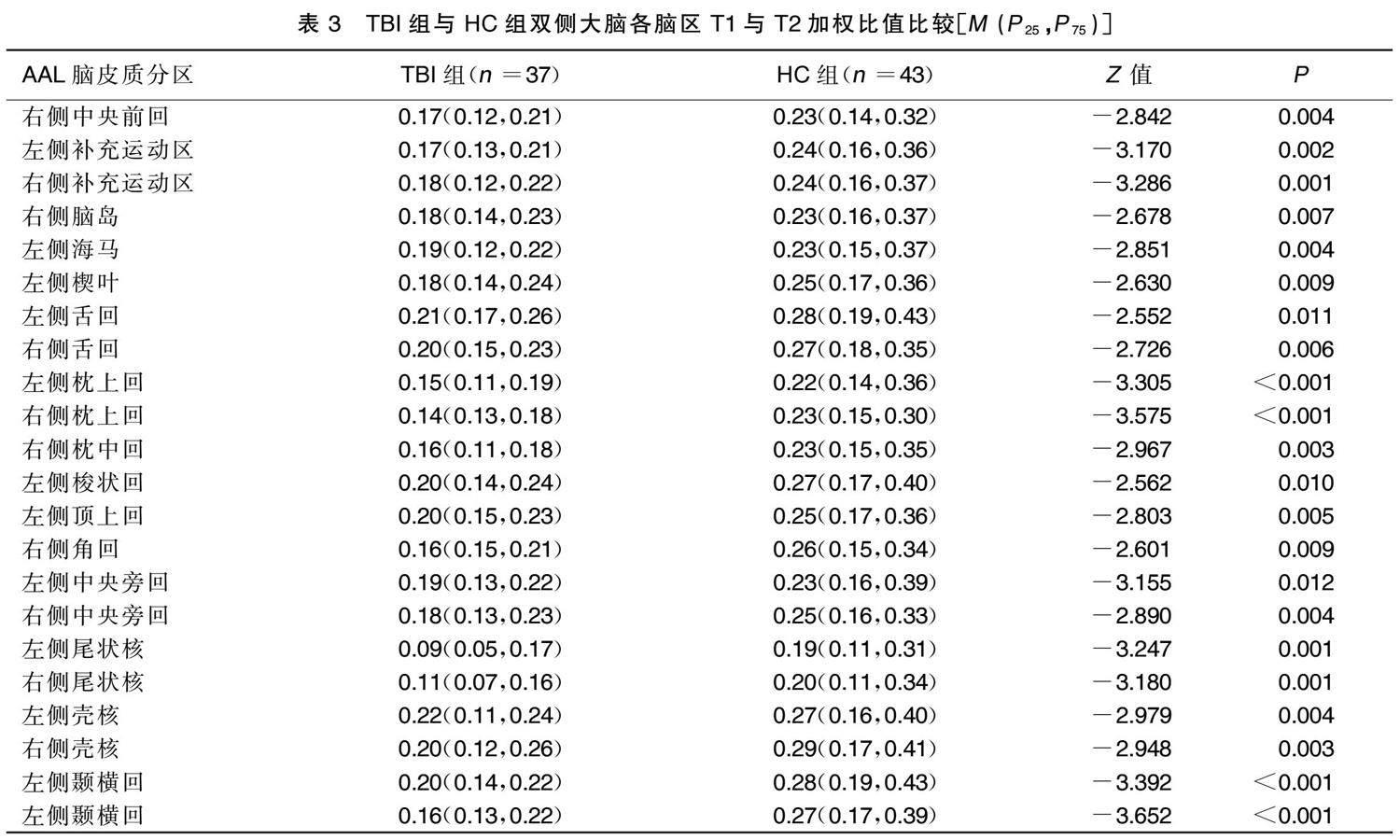
TBI組右側中央前回,雙側中央旁回、雙側補充運動區、左側梭狀回、左側頂上回、右側角回、雙側顳橫回、雙側枕上回、右側枕中回、雙側舌回、雙側尾狀核、雙側殼核、右側腦島、左側海馬、左側楔葉T1與T2加權 比值均低于HC組,差異均有統計學意義( P <0.05)。 詳見表3。
2.3 ?各亞組TBI組和HC組T1與T2加權比值的差異
0~6月亞組、13~18月亞組中,TBI組和HC組雙側大腦各腦區T1與T2加權比值比較,差異均無統計學意義( P >0.05)。7~12月亞組中,TBI組雙側尾狀核、雙側殼核、右側顳橫回、左側梭狀回、左側補充運動區、右側頂下緣角回的T1與T2加權比值均低于HC組( P <0.05)。19~24月亞組中,TBI組雙側中央前回、雙側中央后回、雙側尾狀核、雙側殼核、雙側梭狀回、雙側補充運動區、雙側海馬、雙側海馬旁回、雙側顳葉等52個灰質區域的T1與T2加權比值均低于HC組( P <0.05)。7~12月亞組、19~24月亞組,TBI組雙側尾狀核、雙側殼核、右側顳橫回、左側梭狀回、左側補充運動區的T1與T2加權比值均低于HC組( P <0.05)。詳見表4、表5及圖2。
2.4 T1與T2加權比值的發育軌跡圖
0~2歲TBI組與HC組全腦灰質平均T1與T2加權比值的發育軌跡圖見圖3。TBI組和HC組代表性腦區T1與T2加權比值的發育軌跡圖見圖4。HC組發育軌跡表現為0~2歲內T1與T2加權比值持續上升,TBI組發育軌跡表現為0~16月T1與T2加權比值快速上升,之后下降。從發育軌跡圖可知,TBI組T1與T2加權比值整體低于HC組。
3 討 論
雖然髓鞘常與大腦白質有關,但灰質內也含有大量的髓鞘纖維,且主要位于更深的皮質層 ?[35] ,部分原因是白質髓鞘可擴散到皮質神經網的外圍 ?[36] 。與白質的成熟一樣,灰質髓鞘形成可能在神經發育及認知、行為功能的完善中發揮著重要作用 ?[14] ,尤其在0~2歲是嬰幼兒認知發展最快和發生神經認知障礙風險最高的階段 ?[37] 。TBI導致大腦灰質產生不同程度的脫髓鞘改變和髓鞘重新形成的障礙,從而使患兒產生認知缺陷和認知障礙 ?[38] 。因此,有效評估嬰幼兒腦灰質髓鞘損傷意義重大,可提示臨床及早干預,更好地改善嬰幼兒預后。
3.1 TBI嬰幼兒不同腦區灰質髓鞘T1與T2加權比值的改變
本研究探討了0~2歲嬰幼兒TBI后腦灰質髓鞘的改變,結果顯示,0~2歲中,TBI組雙側中央旁回、雙側補充運動區及左側海馬等22個腦區的T1與T2加權比值低于HC組;7~12月亞組中,TBI組雙側尾狀核、雙側殼核等8個腦區T1與T2加權比值低于HC組;19~24月亞組中,TBI組雙側海馬、雙側海馬旁回及左側前扣帶回與旁扣帶回等包括顳枕葉在內的52個腦區的T1與T2加權比值低于HC組;0~6月亞組、13~18月亞組未發現TBI組與HC組雙側大腦半球各腦區的T1與T2加權比值存在明顯差異,分析可能是由于2歲以內嬰幼 兒不同灰質髓鞘的發育速度存在差異 ?[39] 或各組的樣本量有限。
本研究結果還發現,0~2歲嬰幼兒及亞組(7~12月組、19~24月組)中,TBI組雙側尾狀核、雙側殼核、右側顳橫回、左側梭狀回及左側補充運動區的T1與T2 加權比值均低于HC組;0~2歲嬰幼兒及亞組(19~ 24月組)TBI組中央前回、中央后回、中央旁回、枕葉等腦區的T1與T2加權比值低于HC組;7~12月亞組中這些腦區并無明顯差異。有研究表明,1歲時觀察到軀體感覺皮質(中央后回)、運動皮質(中央前回)和視覺皮質(枕葉)的成熟,顳葉的成熟時間更長 ?[17] 。提示7~12月,軀體感覺運動皮質及視覺皮質可能未成熟。
本研究在 0~2歲嬰幼兒及亞組(7~12月組、19~ 24月組)均觀察到TBI組雙側尾狀核、雙側殼核的T1與T2加權比值低于HC組。有研究顯示,正常發育兒童的灰質髓鞘含量與灰質體積呈正相關 ?[39] 。相關研究表明,0~2歲健康嬰幼兒尾狀核和殼核的灰質體積增大 ?[39.40] ,生長速度過快導致其更易受到損害 ?[40] 。上述研究結果提示,尾狀核和殼核可能是TBI嬰幼兒腦灰質髓鞘損傷的易損腦區。有研究表明,0~1歲海馬體積增長較慢,1~2歲海馬體積迅速增長 ?[39] 。本研究結果顯示,7~12月亞組中,兩組海馬的T1與T2加權比值無明顯差異;0~2歲嬰幼兒及亞組(19~24月組)海馬的T1與T2加權比值均有明顯差異。空間上,海馬接近充滿液體的顳角,發生腦創傷時更易積累剪切力 ?[41] ,海馬較皮質、灰質更易發生機械性損傷 ?[42] 。研究表明,TBI后兒童和青少年的海馬體積減小 ?[43] ,與兒科腦損傷神經病理學證據一致 ?[44] 。結合本研究提示海馬可能是TBI腦灰質髓鞘損傷的易損腦區。
腦損傷后執行功能的障礙與紋狀體功能異常有關,進入基底節的多數皮質信號通過紋狀體傳輸。紋狀體分為3個亞區,包括尾狀核、殼核和伏隔核,分別與認知、運動和動 機過程有關 ?[45] 。本研究結果顯示,0~ 2歲嬰幼兒及亞組(7~12月組、19~24月亞組)中,TBI組雙側尾狀核的T1與T2加權比值均低于HC組,提示TBI嬰幼兒尾狀核髓鞘有不同程度的損傷。相關研究表明,TBI尾狀核功能連接發生改變,認知障礙主要表現為執行功能、處理速度和記憶功能,尤其是執行功能的障礙,執行功能包括信息處理、沖突監測和行動控制 ?[46] 。本研究同時發現,19~24月組中,TBI組前扣帶回與旁扣帶回的T1與T2加權比值低于HC組,提示TBI嬰幼兒前扣帶回與旁扣帶回的髓鞘含量減少。前扣帶回與尾狀核密切連接 ?[47] ,前扣帶回在認知控制中發揮核心作用,當潛在行動之間發生沖突時,前扣帶回被強烈激活,如Stroop任務 ?[48] 。前扣帶回涉及的認知過程包括獎勵處理、沖突監測和行動選擇 ?[49] 。患有注意力缺陷多動障礙(attention deficit hyPeractivity disorder,ADHD)的兒童在執行Stroop任務時無法激活前扣帶回,表明其認知障礙可能是由于抑制常規反應時,前扣帶未激活造成的 ?[50] 。結合本研究結果提示,尾狀核和前扣帶回的髓鞘損傷可能導致它們之間的連接中斷,從而導致前扣帶回無法激活。TBI和ADHD可能有類似的灰質損傷機制,但疾病的灰質之間是否有關需要隨訪或進一步的研究證實。
本研究結果顯示,0~2歲嬰幼兒及亞組(7~12月組、19~24月組)中,TBI組雙側殼核的T1與T2加權比值均低于HC組,提示TBI嬰幼兒殼核的髓鞘損傷。殼核在學習和運動技能中發揮著重要作用,特別是在軀體運動的啟動和執行過程中 ?[51] 。19~24月亞組中,TBI組左側蒼白球的T1與T2加權比值低于HC組。殼核與蒼白球是參與主動抑制的功能網絡,與自上而下的運動控制有關 ?[50] 。這些基底節通過抑制丘腦活動,進而阻止運動 ?[52.53] 。TBI后殼核與蒼白球損傷導致的執行功能障礙表現為難以抑制沖動和習慣性行為 ?[54] 。結合本研究結果提示,當嬰幼兒殼核和蒼白球損傷時,患兒可能有學習、運動及主動抑制方面的功能障礙。
本研究結果顯示,0~2歲嬰幼兒及亞組(7~12月組、19~24月組)中,TBI組左側梭狀回的T1與T2加權比值降低,提示TBI患兒的髓磷脂含量減少。相關研究顯示,梭狀回在面部和視覺認知過程中發揮著重要作用 ?[55.56] 。角回一般與閱讀困難和語義性失語有關 ?[57.58] 。有研究發現,反復TBI的患兒在角回18氟代脫氧葡萄糖(18F.FDG) PET攝取量減少 ?[59] 。本研究結果顯示,0~2歲嬰幼兒及亞組(19~24月組)中,TBI組角回的T1與T2加權比值均降低,提示TBI嬰幼兒可能出現相應的神經認知功能障礙。既往研究表明,兒童輕度TBI后4周,角回與梭狀回在默認模式網絡(default mode network,DMN)的功能連接降低 ?[60] ,相應區域的灰質體積減小 ?[61] 。該DMN參與社會認知和知覺認知過程 ?[62] 。結合本研究結果提示,角回和梭狀回髓鞘的損傷可能是嬰幼兒腦外傷后觀察到認知困難的基礎。目前的研究尚未明確DMN連接的變化是腦損傷的直接影響還是損傷后的代償機制 ?[60] 。
補充運動區主要參與執行過程中的運動規劃 ?[63] 。一項研究表明,TBI后患兒補充運動區的損傷與肢體的運動性失用有關 ?[64] 。另一項功能磁共振靜息態技術研究表明,腦創傷后帕金森綜合征的患兒與動作相關的任務中,補充運動區與初級感覺運動皮質(運動執行)和頂下回(動作提取和運動想象)皮質區的激活減低 ?[63] 。本研究結果顯示,0~2歲嬰幼兒及亞組(7~12月組、19~24月組)中,TBI組左側補充運動區的T1與T2加權比值低于HC組,提示TBI嬰幼兒可能存在運動規劃方面的障礙。
本研究結果顯示,0~2歲嬰幼兒及亞組(19~24月組)中,兩組海馬的T1與T2加權比值存在差異,且TBI組低于HC組,提示TBI組嬰幼兒海馬髓鞘可能丟失。既往定量核磁共振研究表明,言語和情景記憶可能與TBI兒童的海馬體積減小有關 ?[65.66] ,且海馬結構的損傷程度與記憶障礙的嚴重程度相關 ?[67] 。有研究表明,正常發育兒童的灰質髓鞘含量與灰質體積呈正相關 ?[39] 。上述研究結果均提示,TBI嬰幼兒海馬髓鞘的改變可能導致海馬體積減小,且與嬰幼兒、兒童言語和情景記憶障礙有關。海馬結構損傷可能中斷海馬與杏仁核的聯系,從而使兒童表現出記憶、學習和情緒功能的障礙 ?[68] 。
本研究結果顯示,19~24月亞組中,TBI組海馬旁回與中央旁回T1與T2加權比值低于HC組。除與記憶功能有關外,海馬在步態功能中發揮著重要作用,海馬和鄰近的海馬旁回形成了空間表征系統,應用于跟蹤在空間中的自我運動 ?[69.70] 。相關研究表明,海馬與平衡、步態控制和尋路運動功能存在聯系 ?[71.72] 。中央旁回是執行運動任務的控制中心,是大腦內側表面的初級感覺和運動皮質的延續,通常與步態執行有關,當中央旁回損傷時表現步長的不對稱性 ?[73] 。有研究表明,青少年TBI后的步態障礙與海馬、海馬旁回及中央旁回的體積減小有關 ?[73] 。Gilmore等 ?[39] 研究認為,正常發育兒童的灰質髓鞘含量與灰質體積呈正相關。上述研究結果提示,TBI后海馬旁回及中央旁回髓鞘損傷可 能導致嬰幼兒步態障礙,揭示了神經損傷的基礎。
3.2 T1與T2加權比值的發育軌跡
本研究應用二次擬合曲線建立了TBI組與HC組全腦和有代表性腦區灰質T1與T2加權比值的發育軌跡,結果表明,與HC組持續快速增長的發育軌跡不同,TBI組的發育軌跡表現為在0~16月T1與T2加權比值快速上升,之后到2歲下降。從發育軌跡圖可知,TBI組T1與T2加權比值整體低于HC組。有研究顯示,髓鞘形成與灰質體積增長速率存在定性關系,健康嬰幼兒腦總體灰質體積在出生后第1年增加108%,第2年增加19% ?[39] 。表明灰質髓鞘在第1年快速增長,第2年增長速度變慢。從發育軌跡圖可知,19~24月時,TBI組和HC組T1與T2加權比值差異最大,表明19~24月的TBI嬰幼兒經過快速髓鞘化后可能導致明顯的髓鞘損傷。從發育軌跡可知,0~16月殼核T1與T2比值迅速增加。有研究表明,3~13月健康嬰幼兒殼核灰質體積顯著增長 ?[40] 。
本研究存在以下不足:1)樣本量有限,局限于橫斷面數據探索嬰幼兒TBI后髓鞘的改變及發育軌跡。今后將進行大樣本量、隨訪追蹤進行嬰幼兒和兒童TBI后灰質及白質髓鞘改變的縱向拓展研究。2)雖然髓鞘形成較大程度上決定了T1與T2加權比值;然而某些因素,如炎癥、水腫、代謝、萎縮或鐵積累可能對T1與T2加權比值產生影響 ?[74] 。3)TBI后顱腦損傷的嚴重程度根據格拉斯哥昏迷評分(Glasgow Coma Score,GCS)分為輕度、中度和重度 ?[75] ,本研究未考慮到這一點,今后將探討GCS評分和T1與T2加權比值的相關性,幫助臨床盡早干預,改善預后。4)本研究關于TBI后髓鞘損傷的改變與患兒認知、行為和執行運動障礙之間的關聯處于推理階段,今后需采用認知發育量表進一步深入研究。
綜上所述,基于T1與T2加權比值的方法研究了TBI嬰幼兒灰質髓鞘結構的改變,結果顯示,尾狀核、殼核和海馬可能為TBI嬰幼兒腦灰質髓鞘損傷的易損腦區,提示了TBI后髓鞘損傷可能導致嬰幼兒出現神經認知、運動及執行功能障礙;TBI組嬰幼兒的整體T1與T2加權比值低于HC組,且在19~24月最明顯。T1與T2加權比值可作為評估TBI嬰幼兒腦灰質髓鞘改變的替代指標,為TBI患兒腦灰質的研究提供了新思路。
參考文獻:
[1] ?CAPIZZI A, WOO J,VERDUZCO.GUTIERREZ M.Traumatic brain injury:an overview of epidemiology,pathophysiology,and medical management[J].The Medical Clinics of North America,2020,104(2):213.238.
[2] ?KEENAN H T, CLARK A,HOLUBKOV R, et al .Longitudinal developmental outcomes of infants and toddlers with traumatic brain injury[J].JAMA Network Open,2023,6(1):e2251195.
[3] ?LINDSEY H M, WILDE E A,CAEYENBERGHS K, et al .Longitudinal neuroimaging in pediatric traumatic brain injury:current state and consideration of factors that influence recovery[J].Frontiers in Neurology,2019,10:1296.
[4] ?ALIZADEH A, DYCK S M,KARIMI.ABDOLREZAEE S.Traumatic spinal cord injury:an overview of pathophysiology,models and acute injury mechanisms[J].Frontiers in Neurology,2019,10:282.
[5] ?JOHNSON V E, STEWART W,SMITH D H.Axonal pathology ?in traumatic brain injury[J].Experimental Neurology,2013,246:35.43.
[6] ?DENNIS E L, JIN Y,VILLALON.REINA J E, et al .White matter disruption in moderate/severe pediatric traumatic brain injury:advanced tract.based analyses[J].NeuroImage:Clinical,2015,7:493.505.
[7] ?ROBERTS R M, MATHIAS J L,ROSE S E.Relationship between diffusion tensor imaging(DTI) findings and cognition following pediatric TBI:a meta.analytic review[J].Developmental Neuropsychology,2016,41(3):176.200.
[8] ?HUNTEMER.SILVEIRA A, PATIL N,BRICKNER M A, et al .Strategies for oligodendrocyte and myelin repair in traumatic CNS injury[J].Frontiers in Cellular Neuroscience,2021,14:619707.
[9] ?FISCHER I, DULIN J N,LANE M A.Transplanting neural progenitor cells to restore connectivity after spinal cord injury[J].Nature Reviews Neuroscience,2020,21:366.383.
[10] ?DUBOIS J, DEHAENE.LAMBERTZ G,KULIKOVA S, et al .The early development of brain white matter:a review of imaging studies in fetuses,newborns and infants[J].Neuroscience,2014,276:48.71.
[11] ?LEBEL C, WALKER L,LEEMANS A, et al .Microstructural maturation of the human brain from childhood to adulthood[J].NeuroImage,2008,40(3):1044.1055.
[12] ?REYNOLDS J E, GROHS M N,DEWEY D, et al .Global and regional white matter development in early childhood[J].NeuroImage,2019,196:49.58.
[13] ?BAUMANN N, PHAM.DINH D.Biology of oligodendrocyte and myelin in the mammalian central nervous system[J].Physiological Reviews,2001,81(2):871.927.
[14] ?LIU S, LI A,ZHU M F, et al .Genetic influences on cortical myelination in the human brain[J].Genes,Brain,and Behavior,2019,18(4):e12537.
[15] ?MCDOUGALL S, VARGAS RIAD W,SILVA.GOTAY A, et al .Myelination of axons corresponds with faster transmission speed in the prefrontal cortex of developing male rats[J].eDeuro,2018,5(4):ENEURO.0203.18.2018.
[16] ?MOUNT C W, MONJE M.Wrapped to adapt:experience.dependent myelination[J].Neuron,2017,95(4):743.756.
[17] ?DEONI S C L, DEAN D C,REMER J, et al .Cortical maturation and myelination in healthy toddlers and young children[J].Neuro Image,2015,115:147.161.
[18] ?NIEUWENHUYS R. The myeloarchitectonic studies on the human cerebral cortex of the Vogt.Vogt school,and their significance for the interpretation of functional neuroimaging data[J].Brain Structure and Function,2013,218(2):303.352.
[19] ?VAN DER KOUWE A J W, BENNER T,SALAT D H, et al .Brain morphometry with multiecho MPRAGE[J].Neuro Image,2008,40(2):559.569.
[20] ?LIAUW L, VAN DER GROND J,VAN DEN BERG. HUYSMANS A A, ?et al .Hypoxic.ischemic encephalopathy:diagnostic value of conventional MR imaging pulse sequences in term.born neonates[J].Radiology,2008,247(1):204.212.
[21] ?RUTHERFORD M A, WARD P,MALAMATENTIOU C.Advanced MR techniques in the term.born neonate with perinatal brain injury[J].Seminars in Fetal and Neonatal Medicine,2005,10(5):445.460.
[22] ?ENGELBRECHT V, RASSEK M,PREISS S, et al .Age.dependent changes in magnetization transfer contrast of white matter in the pediatric brain[J].American Journal of Neuroradiology,1998,19(10):1923.1929.
[23] ?SOUN J E, LIU M Z,CAULEY K A, et al .Evaluation of neonatal brain myelination using the T1. and T2.weighted MRI ratio[J].Journal of Magnetic Resonance Imaging,2017,46(3):690.696.
[24] ?GLASSER M F, VAN ESSEN D C.Mapping human cortical areas in vivo based on myelin content as revealed by T1. and T2.weighted MRI[J].The Journal of Neuroscience,2011,31(32):11597.11616.
[25] ?GANZETTI M, WENDEROTH N,MANTINI D.Whole brain myelin mapping using T1. and T2.weighted MR imaging data[J].Frontiers in Human Neuroscience,2014,8:671.
[26] ?UDDIN M N, FIGLEY T D,SOLAR K G, et al .Comparisons between multi.component myelin water fraction,T1w/T2w ratio,and diffusion tensor imaging measures in healthy human brain structures[J].Scientific Reports,2019,9:2500.
[27] ?DARKI F, NYSTRM P,MCALONAN G, et al .T1.weighted/T2.weighted ratio mapping at 5 months captures individual differences in behavioral development and differentiates infants at familial risk for autism from controls[J].Cerebral Cortex,2021,31(9):4068.4077.
[28] ?GRYDELAND H, WALHOVD K B,TAMNES C K, et al .Intracortical myelin links with performance variability across the human lifespan:results from T1. and T2.weighted MRI myelin mapping and diffusion tensor imaging[J].The Journal of Neuroscience,2013,33(47):18618.18630.
[29] ?SHAFEE R, BUCKNER R L,FISCHL B.Gray matter myelination of 1 555 human brains using partial volume corrected MRI images[J].Neuro Image,2015,105:473.485.
[30] ?FILIMONOVA E, AMELINA E,SAZONOVA A, et al . Assessment of normal myelination in infants and young children using the T1w/T2w mapping technique[J].Frontiers in Neuroscience,2023,17:1102691.
[31] ?朱琳琳, 王苗苗,李賢軍,等.應用T1與T2加權比探討阿爾茨海默病患者腦白質纖維髓鞘的改變[J].磁共振成像,2023,14(3):36.41.
[32] ?GORDON E M, MAY G J,NELSON S M.MRI.based measures of intracortical myelin are sensitive to a history of TBI and are associated with functional connectivity[J].Neuro Image,2019,200:199.209.
[33] ?MAHONEY S O, CHOWDHURY N F,NGO V, et al .Mild traumatic brain injury results in significant and lasting cortical demyelination[J].Frontiers in Neurology,2022,13:854396.
[34] ?SHI F, YAP P T,WU G R, et al .Infant brain atlases from neonates to 1. and 2.year.olds[J].PLoS One,2011,6(4):e18746.
[35] ?FIELDS R D. Neuroscience.myelin.more than insulation[J].Science,2014,344(6181):264.266.
[36] ?SHAW P, KABANI N J,LERCH J P, et al .Neurodevelopmental trajectories of the human cerebral cortex[J].The Journal of Neuroscience,2008,28(14):3586.3594.
[37] ?KNICKMEYER R C, GOUTTARD S,KANG C, et al .A structural MRI study of human brain development from birth to 2 years[J].The Journal of Neuroscience,2008,28(47):12176.12182.
[38] ?AU A K, CLARK R S B.Paediatric traumatic brain injury:prognostic insights and outlooks[J].Current Opinion in Neurology,2017,30(6):565.572.
[39] ?GILMORE J H, SHI F,WOOLSON S L, et al .Longitudinal development of cortical and subcortical gray matter from birth to 2 years[J].Cerebral Cortex,2012,22(11):2478.2485.
[40] ?CHOE M S, ORTIZ.MANTILLA S,MAKRIS N, et al .Regional infant brain development:an MRI.based morphometric analysis in 3 to 13 month olds[J].Cerebral Cortex,2013,23(9):2100.2117.
[41] ?MAYER A R, MEIER T B,DODD A B, et al .Prospective study of gray matter atrophy following pediatric mild traumatic brain injury[J].Neurology,2023,100(5):e516.e527.
[42] ?GEDDES D M, LAPLACA M C,CARGILL R S.Susceptibility of hippocampal neurons to mechanically induced injury[J].Experimental Neurology,2003,184(1):420.427.
[43] ?TASKER R C, SALMOND C H,WESTLAND A G, et al .Head circumference and brain and hippocampal volume after severe traumatic brain injury in childhood[J].Pediatric Research,2005,58(2):302.308.
[44] ?KOTAPKA M J, GENNARELLI T A,GRAHAM D I, et al .Selective vulnerability of hippocampal neurons in acceleration.induced experimental head injury[J].Journal of Neurotrauma,1991,8(4):247.258.
[45] ?HABER S N. The primate basal Ganglia:parallel and integrative networks[J].Journal of Chemical Neuroanatomy,2003,26(4):317.330.
[46] ?UNSCHULD P G, JOEL S E,LIU X Y, et al .Impaired cortico.striatal functional connectivity in prodromal Huntington′s disease[J].Neuroscience Letters,2012,514(2):204.209.
[47] ?YETERIAN E H, VAN HOESEN G W.Cortico.striate projections in the rhesus monkey:the organization of certain cortico.caudate connections[J].Brain Research,1978,139(1):43.63.
[48] ?KERNS J G, COHEN J D,MACDONALD A W, et al .Anterior cingulate conflict monitoring and adjustments in control[J].Science,2004,303(5660):1023.1026.
[49] ?SHENHAV A, BOTVINICK M M,COHEN J D.The expected value of control:an integrative theory of anterior cingulate cortex function[J].Neuron,2013,79(2):217.240.
[50] ?BUSH G, FRAZIER J A,RAUCH S L, et al .Anterior cingulate cortex dysfunction in attention.deficit/hyperactivity disorder revealed by fMRI and the Counting Stroop[J].Biological Psychiatry,1999,45(12):1542.1552.
[51] ?PACKARD M G, KNOWLTON B J.Learning and memory functions of the Basal Ganglia[J].Annual Review of Neuroscience,2002,25:563.593.
[52] ?SCHMIDT R, LEVENTHAL D K,MALLET N, et al .Canceling actions involves a race between basal Ganglia pathways[J].Nature Neuroscience,2013,16:1118.1124.
[53] ?PRAN P, CATANI S,FALLETTA CARAVASSO C, et al .Supplementary motor area activation is impaired in severe traumatic brain injury Parkinsonism[J].Journal of Neurotrauma,2014,31(7):642.648.
[54] ?RAO V, LYKETSOS C.Neuropsychiatric sequelae of traumatic brain injury[J].Psychosomatics,2000,41(2):95.103.
[55] ?KANWISHER N, MCDERMOTT J,CHUN M M.The fusiform face area:a module in human extrastriate cortex ?specialized for face perception[J].The Journal of Neuroscience,1997,17(11):4302.4311.
[56] ?BUCKNER R L, KRIENEN F M.The evolution of distributed association networks in the human brain[J].Trends in Cognitive Sciences,2013,17(12):648.665.
[57] ?BEAUVOIS M F, SAILLANT B,MEININGER V, et al .Bilateral tactile aphasia:a tacto.verbal dysfunction[J].Brain,1978,101(3):381.401.
[58] ?BANG S A, SONG Y S,MOON B S, et al .Neuropsychological,metabolic,and GABAA receptor studies in subjects with repetitive traumatic brain injury[J].Journal of Neurotrauma,2016,33(11):1005.1014.
[59] ?TUERK C, DGEILH F,CATROPPA C, et al .Pediatric moderate.severe traumatic brain injury and gray matter structural covariance networks:a preliminary longitudinal investigation[J].Developmental Neuroscience,2021,43(6):335.347.
[60] ?IYER K K, ZALESKY A,BARLOW K M, et al .Default mode network anatomy and function is linked to pediatric concussion recovery[J].Annals of Clinical and Translational Neurology,2019,6(12):2544.2554.
[61] ?WANG X Y, HAN Z Z,HE Y, et al .Where color rests:spontaneous brain activity of bilateral fusiform and lingual regions predicts object color knowledge performance[J].NeuroImage,2013,76:252.263.
[62] ?TUERK C, DGEILH F,CATROPPA C, et al .Altered resting.state functional connectivity within the developing social brain after pediatric traumatic brain injury[J].Human Brain Mapping,2020,41(2):561.576.
[63] ?JANG S H, SEO J P.Motor execution problem due to injured corticofugal tracts from the supplementary motor area in a patient with mild traumatic brain injury[J].American Journal of Physical Medicine & Rehabilitation,2017,96(10):e193.
[64] ?PUGH K R, MENCL W E,SHAYWITZ B A, et al .The angular gyrus in developmental dyslexia:task.specific differences in functional connectivity within posterior cortex[J].Psychological Science,2000,11(1):51.56.
[65] ?YEATES K O, LURIA J,BARTKOWSKI H, et al .Postconcussive symptoms in children with mild closed head injuries[J].The Journal of Head Trauma Rehabilitation,1999,14(4):337.350.
[66] ?BIGLER E D, FINUF C,ABILDSKOV T J, et al .Cortical thickness in pediatric mild traumatic brain injury including sports.related concussion[J].International Journal of Psychophysiology,2018,132:99.104.
[67] ?HERGERT D C, SICARD V,STEPHENSON D D, et al .Test.retest reliability of a semi.structured interview to aid in pediatric traumatic brain injury diagnosis[J].Journal of the International Neuropsychological Society,2022,28(7):687.699.
[68] ?DRIJKONINGEN D, CHALAVI S,SUNAERT S, et al .Regional gray matter volume loss is associated with gait impairments in young brain.injured individuals[J].Journal of Neurotrauma,2017,34(5):1022.1034.
[69] ?EPSTEIN R A .Parahippocampal and retrosplenial contributions to human spatial navigation[J].Trends in Cognitive Sciences,2008,12(10):388.396.
[70] ?MOSER E I, KROPFF E,MOSER M B.Place cells,grid cells,and the brain′s spatial representation system[J].Annual Review of Neuroscience,2008,31:69.89.
[71] ?PAYLOR R, ZHAO Y,LIBBEY M, et al .Learning impairments and motor dysfunctions in adult Lhx5.deficient mice displaying hippocampal disorganization[J].Physiology & Behavior,2001,73(5):781.792.
[72] ?RIVAS J, GAZTELU J M,GARCA.AUSTT E.Changes in hippocampal cell discharge patterns and Theta rhythm spectral properties as a function of walking velocity in the guinea pig[J].Experimental Brain Research,1996,108(1):113.118.
[73] ?ZIELINSKI B A, GENNATAS E D,ZHOU J, et al .Network.level structural covariance in the developing brain[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(42):18191.18196.
[74] ?GLASSER M F, COALSON T S,HARMS M P, et al .Empirical transmit field bias correction of T1w/T2w myelin maps[J].Neuro Image,2022,258:119360.
[75] ?TEASDALE G, JENNETT B.Assessment of coma and impaired consciousness.A practical scale[J].Lancet,1974,2(7872):81.84.
(收稿日期:2023.12.05)
(本文編輯 薛妮)

