帕金森病的研究之旅


帕金森病是一種運動功能障礙疾病,患者典型特征包括:多部位(如手、手臂、腿、下巴或頭部等)不自主搖晃(震顫)、運動遲緩、肌肉僵硬(收縮時間延長),有時還伴發全身平衡和協調能力降低而導致摔倒概率增加。帕金森病患者除運動異常外,還常伴發睡眠障礙、認知功能減弱、情緒紊亂、自主神經功能異常和疼痛等其他癥狀。
帕金森病是第二常見的神經退行性疾病,第一為阿爾茨海默病(又名老年癡呆癥)。所謂神經退行性疾病是指大腦出現結構或功能的漸進性喪失,最終出現一系列異常表現。帕金森病發病率隨年齡增長而增加,65 歲以上人群發病率為2%~3%,與之對應,50歲之前發病率較低,但目前這種趨勢正在變化,早發性帕金森病患者(50歲以下)逐年增多。
帕金森病癥狀漸進式出現。發病初期不明顯,偶爾出現單個手臂震顫;隨著時間推移,癥狀逐漸嚴重,顫抖部位和頻率逐漸增加、動作開始遲緩、身體平衡能力下降等;進一步發展造成身體每況愈下,出現行動困難、依賴輪椅到臥床,最終死亡。帕金森病患者診斷后平均預期壽命為7至15年。
2015年全球共有620萬帕金森病患者,預測2050年可達2000萬。我國隨著老年化社會到來,帕金森病人數也在快速增加,因此熟悉帕金森病相關知識具有重要的現實意義。
一、帕金森醫生
有關帕金森病癥狀的描述很早就已出現,包括古希臘、古印度和我國古代文獻都有震顫的記載。1817年,英國外科醫生詹姆斯·帕金森(James Parkinson)在一本66頁小冊子《震顫麻痹論》中對該病癥狀首次進行全面和詳細描述:非自主震顫、肌肉力量減弱、有前軀傾向、步態不穩,但感官和智力未明顯改變。帕金森還首次明確這是一種神經系統疾病,命名為 “顫抖性麻痹”或“驚厥性麻痹”。1868年至1881年間,法國著名神經病理學家讓·馬丁·夏科特(Jean Martin Charcot)對該病開展了進一步研究,對癥狀進行更加精準的描述,并于1872年建議將該病命名帕金森病,隨后得到學術界廣泛認可并延續至今。雖然近年來許多科學家建議基于該病發生機制命名,但帕金森病一詞由來已久,因此仍然沿用。
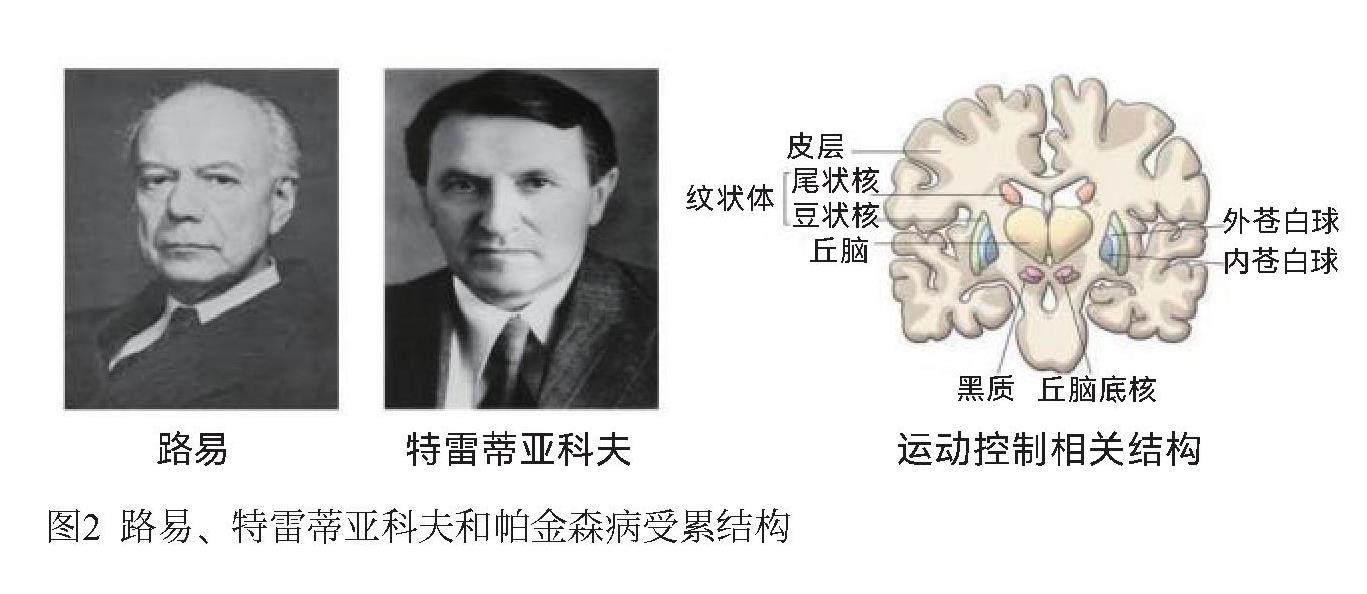
二、大腦特定區域的結構異常
帕金森發表《顫抖性麻痹》一文初衷在于激勵后來研究者能揭示該疾原因,進而尋到治療之法。遺憾的是隨后幾十年少有關注,僅有研究也無非在臨床癥狀描述上縫縫補補,直到20世紀初才有所改觀,在發病機制和治療方面取得一定進展。
1912年,德裔美籍神經學家弗雷德里克·路易(Frederic Lewy)發現帕金森病患者大腦神經元中存在異常的顆粒狀結構,稱為路易體(Lewy body)。然而直到20世紀90年代才確定路易體主要源于α-突觸核蛋白(α-synuclein)錯誤折疊進而聚集的結果。十九世紀末,研究人員根據臨床跡象推測帕金森病發生部位應該位于大腦黑質(substantia nigra, SN)區域。1919年,蘇聯神經病學家康斯坦丁·特雷蒂亞科夫(Konstantin Tretiakoff)在帕金森病患者大腦黑質區域觀察到顏色變淺,主要是因為大量神經元丟失。
與此同時,帕金森病的治療手段也在積極探索中。十九世紀末,夏科特和學生發現顛茄提取物具有緩解帕金森病患者震顫的功效,后續發現多種植物提取物也具有類似療效。20世紀40年代,他們發現這是源于抑制乙酰膽堿活性的緣故,因此合成一系列人工抗膽堿化合物并應用于臨床,但療效遠不及預期,在缺乏其他方案前提下至少聊勝于無。外科醫生于1939年首次嘗試通過損傷大腦基底結構或脊髓來緩解震顫,患者癥狀得到一定緩解,但手術風險過高,許多情況下直接導致患者癱瘓,因此實際應用非常慎重,通常是不得已而為之。
總之,20世紀50年代末,帕金森病的治療手段和臨床效果都非常有限,神經遞質多巴胺的發現改變了這一狀況。
三、神奇多巴胺
故事要從瑞典藥理學家阿爾維德·卡爾森(Arvid Carlsson)談起。1923年1月25日,卡爾森出生于瑞典烏普薩拉一個富裕的中產家庭,父母都擁有良好學術背景,在濃厚家庭氛圍熏陶下,卡爾森走上學術道路,于1941年進入隆德大學醫學專業。隆德大學并不大,但在學術方面異常優秀,曾涌現出多位著名教授,對卡爾森投身科研發揮重要激勵作用。盡管當時歐洲大陸在第二次世界大戰中激戰正酣,但作為中立國的瑞典并未卷入戰爭,卡爾森的學業因此未受明顯影響。
1944年,卡爾森進入藥理系阿爾格倫(Gunnar Ahlgren)教授實驗室,開啟藥理學生涯。在阿爾格倫指導下,卡爾森先后研究麻醉劑和止痛劑作用機理原理以及鈣離子代謝。在卡爾森看來,這些研究意義均“不大”,唯一價值在于使自己逐漸踏入藥理學領域。1951年,卡爾森憑借鈣離子代謝研究獲得隆德大學博士學位,留校擔任藥理學助理教授。1952年,卡爾森申請藥理學副教授時遭遇重大打擊,評審委員會認為鈣離子代謝研究非藥理學主流(后證實這一看法完全錯誤),“毫無前途”可言,因此拒絕。落選的卡爾森面臨艱難抉擇,繼續堅守藥理學但需轉換方向,或放棄藥理轉臨床。經過激烈思想斗爭,卡爾森選擇了妥協,在隆德大學附屬醫院獲得一個內科醫生職位。隨后一年多,卡爾森過上另一種生活,臨床工作也帶來巨大樂趣,但他仍對基礎研究念念不忘,最終選擇回歸。
1954年,卡爾森向隆德大學藥理學教授貝里斯特倫(Sune Bergstrom,由于前列腺素發現分享1982年諾貝爾生理學或醫學獎)尋求幫助,期望進入一家主流藥理學實驗室深造。在貝里斯特倫推薦下,卡爾森于1954年8月作為訪問學者來到美國國立心臟研究所(今天美國國立心臟、肺和血液研究所),跟隨生物化學家布羅迪(Bernard Beryl Brodie)開展研究。卡爾森被安排研究利血平(Reserpine)對5-羥色胺(5-hydroxytryptamine, 5-HT)的影響。利血平是一種來自印度蘿芙木(Rauwolfia serpentina)的生物堿,在古印度被看作“神藥”廣泛應用,1950年批準作為抗精神病和抗高血壓藥物,藥理學家們十分關注這一藥物作用機理。5-羥色胺又名血清素,是20世紀50年代初發現的一種神經遞質,具有廣泛分布和多種生理功能,如凝血和神經抑制等。卡爾森的利血平研究收獲頗豐,一方面終于走上藥理學的所謂主流,另一方面為后續重大突破奠定堅實基礎。此舉奠定了卡爾森將來的研究方向。
1955年初,卡爾森回到隆德大學,如愿獲得藥理學副教授職位,不久還附帶了三個有利條件:優良實驗平臺;獲得基金支持;招到研究生。因此,卡爾森準備大干一場,重點就是挖掘利血平作用機制。卡爾森發現兔子注射利血平后自發運動能力喪失,利用高靈敏神經遞質檢測儀發現兔子大腦多種神經遞質消失,但不清楚那種遞質消失是造成運動異常的主要原因。卡爾森又為這些兔子分別注射多種神經遞質前體物,結果發現注射左旋多巴的兔子基本恢復運動能力,說明左旋多巴可有效彌補利血平造成的特定神經遞質缺失。
左旋多巴是由酪氨酸羥基化生成,并可進一步脫羧生成多巴胺,多巴胺加羥基成為去甲腎上腺素,去甲腎上腺素獲得一個甲基成為腎上腺素(圖3)。多巴胺、去甲腎上腺素、腎上腺素都屬胺類,擁有相同母核鄰苯二酚(又名兒茶酚),因此統稱兒茶酚胺。1946年,瑞典藥理學家馮尤勒(Ulf Svante von Euler)確定去甲腎上腺素是一種重要神經遞質,而多巴胺是去甲腎上腺素合成過程的中間產物。卡爾森發現利血平注射后兔子大腦去甲腎上腺素并未完全耗竭,相反多巴胺消耗殆盡;注射左旋多巴后兔子大腦去甲腎上腺素濃度升高并不明顯,但多巴胺顯著上升。基于這一事實,卡爾森提出多巴胺并非單純去甲腎上腺素合成中間產物,而是一種重要神經遞質。卡爾森并非首位發現大腦中存在多巴胺的人,卻是第一位將多巴胺看作神經遞質的科學家,奠定卡爾森在神經生理學領域的重要地位。卡爾森進一步發現利血平造成的兔子表現與帕金森病癥狀非常相似,當多巴胺恢復正常后運動障礙緩解,因此推測多巴胺減少可能與帕金森病發生相關。
四、左旋多巴應用
卡爾森的發現激發匈牙利藥理學家奧萊·霍尼凱維奇(Oleh Hornykiewicz)的巨大興趣。1960年,霍尼凱維奇解剖帕金森病患者大腦結構發現基底神經節紋狀體中多巴胺含量急劇減少,并且多巴胺減少越多,患者癥狀越嚴重,說明卡爾森推測的正確性,結合動物模型實驗可以得出補充左旋多巴有望治療帕金森病。1964年,霍尼凱維奇說服臨床醫生為三位帕金森病患者使用左旋多巴治療,獲得意想不到的奇效;隨后開展大規模臨床試驗,進一步證實這一治療方案可行性;1967年,左旋多巴最終被美國FDA批準應用于帕金森病治療。
左旋多巴于1911年由波蘭裔美國生物化學家卡西米爾·芬克(Casimir Funk)首次合成,一直未得到大家重視,直到發現可應用于帕金森病治療后才名聲大噪。之所以不直接應用多巴胺而用左旋多巴,原因在于前者無法跨越血腦屏障,而后者可以。然而,左旋多巴生產過程會伴隨右旋多巴,為后續分離帶來巨大挑戰。隨著左旋多巴需求劇增,制藥領域也在積極嘗試解決這一難題。同樣是20世紀60年代,美國化學家諾爾斯(William Knowles)發明一種神奇催化劑,可近乎完美地只生產左旋多巴。這一突破使左旋多巴生產量急劇增加同時價格大幅度降低,真正實現有效藥物進入尋常百姓家目標。神經遞質多巴胺的發現、左旋多巴大規模生產和應用都是帕金森歷史上具有里程碑意義的大事,卡爾森因此榮獲2000年諾貝爾生理學或醫學獎,霍尼凱維奇分享沃爾夫醫學獎,諾爾斯榮獲2001年諾貝爾化學獎。
現在,增加多巴胺數量或活性成為帕金森病臨床治療基本策略,除左旋多巴外還有多種藥物。
(一)多巴脫羧酶抑制劑。多巴脫羧酶是催化多巴生成多巴胺的關鍵酶,是左旋多巴在大腦發揮藥效的基礎,但該酶在血清中也存在,因此會減少左旋多巴數量。卡比多巴和芐絲肼是兩種常用多巴脫羧酶抑制劑,它們不穿過血腦屏障,因此避免血清中左旋多巴的損失,并不影響其在大腦中活性,通常會和左旋多巴聯合用藥。
(二)兒茶酚-O-甲基轉移酶抑制劑。兒茶酚-O-甲基轉移酶可失活多巴胺,抑制其活性對提升左旋多巴利用具有重要意義,常用的如奧匹卡朋、恩他卡朋和托卡朋等。
(三)單胺氧化酶B抑制劑。單胺氧化酶B催化多巴胺失活,抑制其活性可增加多巴胺活性,常用的如司來吉蘭、雷沙吉蘭和沙非酰胺等。
(四)多巴胺激動劑。通過促進多巴胺和受體結合而增加活性,從而提升治療效果。常用的如普拉克索和羅匹尼羅等。
五、深度腦刺激
左旋多巴和相關藥物的神奇療效一度為眾多帕金森病患者帶來希望,但隨著大規模應用,問題也隨之出現,那就是嚴重副作用,部分甚或比疾病本身還嚴重,若放棄(無論主動還是被動)將面臨無藥可用境地,不得不靜靜等待疾病進展而最終死亡。此時,手術治療帕金森病方案重回研究人員視野。
1960 年代末,美國神經生物學家馬倫·德隆(Mahlon DeLong)開始研究大腦基底神經節與運動的關系。1980 年代初期,研究人員發現化學物質甲基苯基四氫吡啶(MPTP)可造成動物出現帕金森病類似癥狀,為帕金森病動物模型制備提供重要便利。1987年,德隆發現MPTP造成的猴子帕金森病癥狀源于丘腦底核過度激活,推測抑制該區域可減緩帕金森病進展;隨后德隆為MPTP誘導的帕金森病猴子注射丘腦底核失活物質,結果運動遲緩、肌肉僵硬和顫抖癥狀均得到極明顯緩解。
法國神經外科專家阿利姆·路易斯·貝納比德(Alim Louis Benabid)一直希望找到一種治療帕金森病的安全有效方法。1987年,貝納比德接診一位帕金森病患者,經多巴胺治療無效后決定嘗試電刺激大腦深部特定位置來緩解癥狀。貝納比德將電極插入丘腦位置后發出電脈沖,同時患者保持清醒以及時反饋感受,避免不當刺激造成患者其他損傷。貝納比德首先使用通常的50 赫茲電流刺激,但患者無任何反應;進一步使用100赫茲刺激,奇跡發生了,患者震顫停止。貝納比德最初以為操作失誤造成的意外結果,但患者反應非常有效,重復操作獲得相同結果。后續大規模實驗證明該方案的可行性。1993年,靶向丘腦深部刺激治療帕金森病震顫獲歐洲批準,1997年獲美國批準。
貝納比德認為刺激大腦更精準區域可能效果更佳,獲悉德隆研究成果后決定將區域聚焦于丘腦底核。1995 年,貝納比德為三位嚴重帕金森病患者執行靶向丘腦底核的腦深部刺激并獲得更理想效果,從而使這種改進方法于1998年獲歐洲批準,2002年獲美國批準。至今已有幾十萬患者接受這種療法,在減少運動障礙和提高生活質量方面有重要益處。德隆和貝納比德因此分享2014年拉斯克臨床醫學研究獎,兩人又先后榮獲生命科學突破獎。
本文作者郭曉強是河北體育學院運動人體科學系副教授。

