培養學生化學學科科學探究核心素養的路徑與實踐
作者簡介:張克龍,浙江省瑞安市教育發展研究院院長,特級教師,正高級教師。
課題項目:本文系浙江省教研室2022年立項課題“化學學科基于學科理解的學習任務設計研究”的階段性研究成果。課題編號:G2022097。
摘要:在高中化學教學中,教師應結合《普通高中化學課程標準(2017年版2020年修訂)》的要求,形成科學探究素養發展路徑,明確學習目標,從創設真實情境,展現學生概念理解,發現和提出有探究價值的問題;依據問題的假設出發,開展科學探究,獲取證據,培養創新精神;合作交流,證據推理,深化概念理解,形成模型認知;實踐應用,訓練高階思維,形成結構化認識,發展科學態度與社會責任等科學探究核心素養入手,探討培養學生科學探究核心素養的實踐策略。
關鍵詞:科學探究;核心素養;高中化學;元素周期律
《普通高中化學課程標準(2017年版2020年修訂)》(以下通稱“新課標”)提出了“科學探究”的化學核心素養,具體要求是:能發現和提出有探究價值的問題;能從問題的假設出發,依據探究目的,設計探究方案,運用化學實驗、調查等方法進行實驗探究。新課標指出,科學探究有四要素,分別是“問題”“證據”“建模”“交流”。科學探究是指基于問題、形成猜想和假設、設計實驗與制訂方案、獲取和處理信息、基于證據得出結論并作出模型認知,以及對科學探究過程和結果進行交流、評估、反思的能力。
一、結合新課標要求,形成發展路徑,明確學習目標
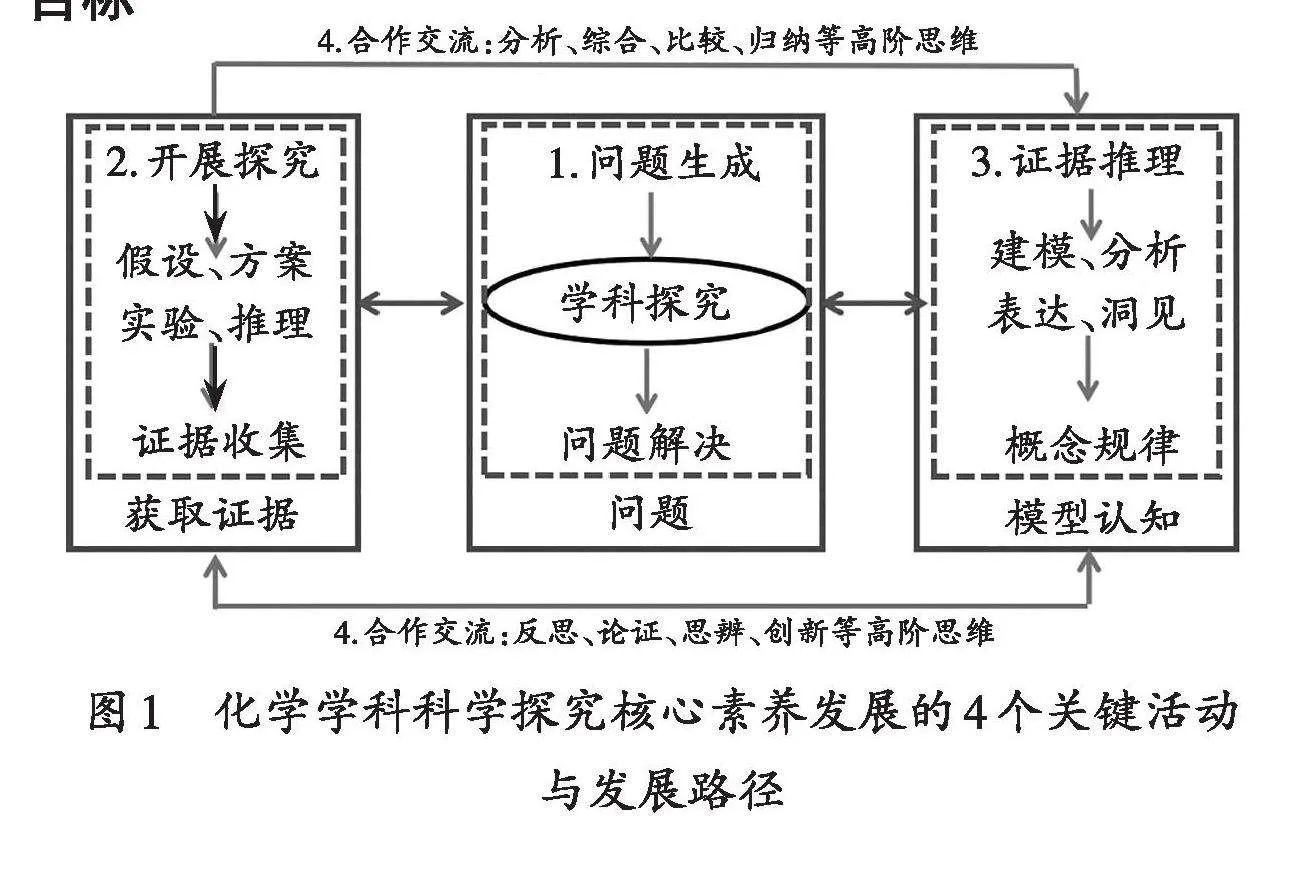
筆者在教學實踐中整合新課標對科學探究活動以及科學探究素養的論述,提出并踐行化學學科科學探究核心素養發展的路徑(見上頁圖1)。
學生的科學探究核心素養是在包含上頁圖1中四個要素的科學探究活動中得到發展與診斷。合作交流與高階思維這個要素是從社會和認知層面回應科學探究核心素養發展過程中的科學思維、創新精神、科學態度與社會責任,以及積極向上的科學精神。
元素周期律是人教版高中化學教材必修第一冊第四章第二節的內容,是對元素性質呈現周期性變化規律的揭示,是高中化學學習中重要而又基礎的核心概念,它對學生的元素性質觀、原子結構觀及周期性變化的認識方式可以起到核心聯結和整合的作用。學生通過學習元素周期律,能加深對元素化合物性質的理解與記憶,并將知識體系中零散、繁多的元素知識結構化、系統化,為后續物質性質的學習提供指導。課前,學生已經初步掌握了對比、分析、歸納等邏輯方法并能簡單應用,也具備一定的實驗能力,但是本節課知識容量大,對學生的應用、分析、綜合、評價等能力要求較高。因此,根據新課標中對元素周期律內容與學業的要求,本課時學習目標可設計如下:
1.通過“數(據)、(圖)形”轉化認識到原子核外電子排布、原子半徑和主要化合價隨著原子序數的遞增呈現周期性的變化;以第三周期元素為代表,認識到同周期元素的金屬性、非金屬性等隨元素原子序數遞增而呈周期性變化的規律,建構元素周期律。
2.通過探究第三周期元素性質遞變,引導學生形成科學的探究思路,掌握科學的探究方法,感受證據推理的嚴謹性、科學性,發展學生的科學探究核心素養。
3.通過系列實驗探究活動,培養學生的實驗觀察能力、設計能力、操作能力和嚴謹的科學態度,激發學生的學習積極性。
那么,如何在“元素周期律”的教學中,既能達成上述學習目標,又能落實科學探究素養呢?
二、創設真實情境,展現已有認知,生成高質量問題
學生素養發展是建立在知識生長基礎上的。問題生成的質量直接決定學生在課堂展現已有概念認識。概念理解、形成概念結構化認識與模型認知水平,影響學生高階思維訓練的程度,以及問題解決的質量。
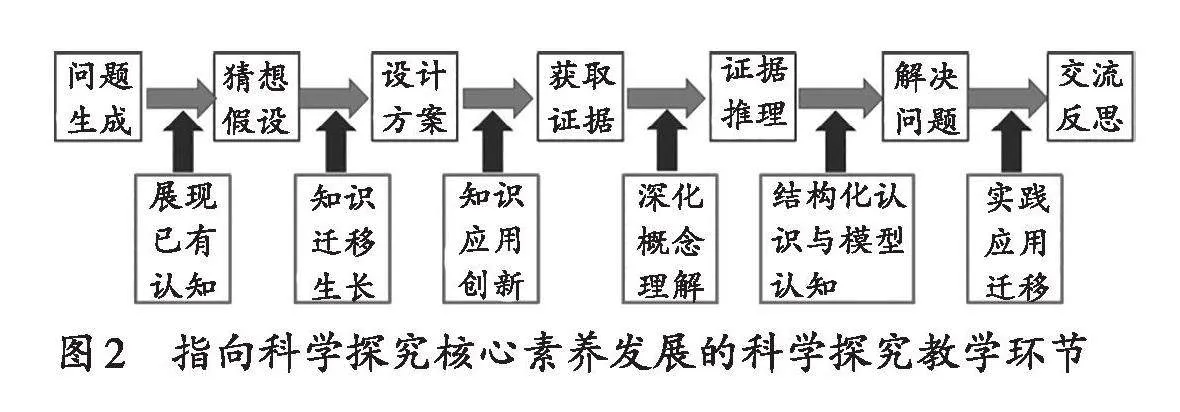
圖2是筆者由上頁圖1的科學探究核心素養發展路徑演繹出來的發展學生科學探究核心素養的科學探究活動教學環節圖。由圖2可知,基于科學探究核心素養發展的科學探究活動,包含課堂上學生知識生長的三個過程:展現已有概念認識、深化概念理解、新概念結構化認識與模型認知。
為生成高質量的問題,筆者以元素周期律的發現史話為真實情境,在激發學生的學習興趣和探索熱情基礎上,促進學生展現已有概念認識,發現和提出有探究價值的問題。
(一)科學史話,創設真實情境
材料一:1875年,法國化學家布瓦博德朗在閃鋅礦中發現了新元素并命名為“鎵”,他測得鎵密度為4.7 g/cm3。門捷列夫在得知這一發現后指出鎵正是他預言的“類鋁”,但他認為鎵密度應該是5.9 g/cm3~6.0 g/cm3,并致信布瓦博德朗。當時布瓦博德朗認為只有他本人才擁有鎵,門捷列夫怎么會知道這種金屬密度呢?他重新提純了鎵,最后測得鎵密度果然是5.94 g/cm3,他大為驚訝,在自己的一篇論文中寫道:“我認為沒有必要再來說明門捷列夫這一理論的巨大意義了。”
材料二:展示門捷列夫按照相對原子質量由小到大進行排列時,在鈣元素與鈦元素之間留下的空位周期表。門捷列夫將其預言為“類硼”,其相對原子質量應該是45左右,并給出該元素部分物理、化學性質。1879年,瑞典化學家尼爾森發現了該元素并將它命名為“鈧”,該元素相對原子質量,單質的密度、物理性質和化學性質與門捷列夫的預言相符。
門捷列夫還成功預言鍺(“類硅”)元素的存在及性質。
【問題1】門捷列夫預言這些元素的存在與性質,依據是什么?
【問題2】布瓦博德朗支持門捷列夫的元素周期律理論,認為鎵元素應該位于同族元素鋁的下面,你認為他還需要提供哪些證據?
【設計意圖】問題1利用科學史話“門捷列夫的預言”創設真實情境,讓學生感受到科學家求真、質疑、開拓創新的科學精神,明確元素周期律的功能和價值,從而激發學生的學習興趣和探索熱情;問題2考查學生的演繹思維,要求學生模仿科學家的思維方式,根據同族元素的相似性和遞變性,尋找鎵與鋁相似的性質,為學生探究物質的性質提供了方法導引。
(二)數圖轉換,尋找規律,生成問題
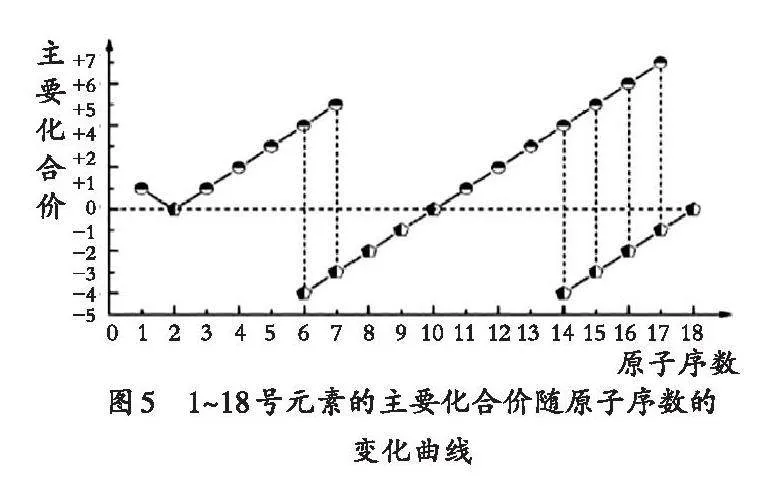
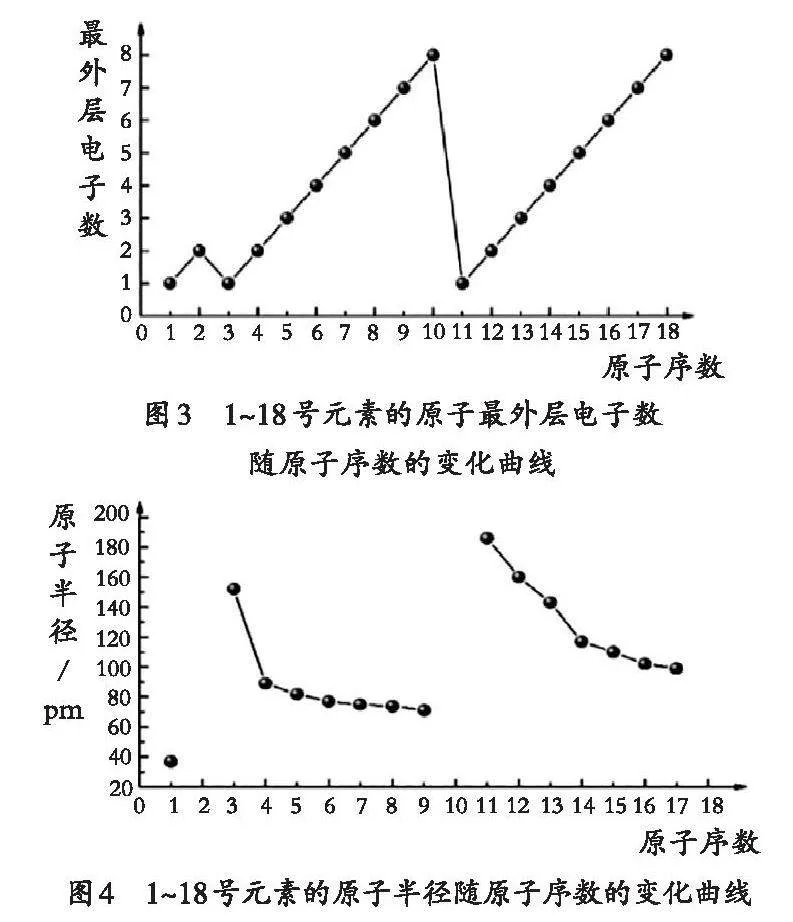
【任務1】請認真閱讀教材中表4和表5的信息,在學案上繪制短周期元素原子的最外層電子數、原子半徑、主要化合價(最高正價與最低負價)隨原子序數變化的三張圖,并尋找變化規律。學生通過討論活動,繪制以下三張圖(見圖3、圖4、圖5)。
【任務2】 完成教材思考與討論欄目內容。
【問題1】主族元素(O、F除外)最高正價與族序數關系如何?最低化合價怎樣確定?
【問題2】為何O、F沒有像第三周期的S和Cl那樣的最高正價?
【設計意圖】通過繪制二維坐標圖象,學生自主發現元素的原子核外電子排布、原子半徑和主要化合價都隨著原子序數的遞增呈現周期性變化的規律,生成了本節課有探究價值的高質量問題“探究第三周期元素性質的變化規律”,同時幫助學生初步建立“位—構—性”的思維模型。
三、開展科學探究,進行證據推理,培養創新精神
開展科學探究活動的目的不只是問題解決,更重要的是發展科學探究核心素養。因此,探究第三周期元素性質的變化規律,教師需結合學生的認知發展情況,由學生做出猜想,明確實驗目的與實驗原理,開展實驗,獲取證據及查閱相關資料,并進行證據推理,進而形成同周期元素性質的遞變規律,發展創新意識和證據推理的核心素養。具體設計如下:
【任務1】預測和探究Na、Mg、Al的金屬性強弱。
【問題1】結合原子核外電子排布規律,預測Na、Mg、Al的金屬性強弱。
【問題2】比較元素金屬性強弱的實驗方法有哪些?
【任務2】 設計實驗探究Na、Mg、Al的金屬性強弱。
【學生活動】學生按照實驗方案科學性、簡約性、可操作性以及需要控制的變量等角度設計方案,進行下列分組實驗。
【學生實驗】
(1)將除去氧化膜的Mg條、Al片分別投入2 mL稀鹽酸中,觀察現象。
(2)將除去氧化膜的Mg條、Al片分別投入2 mol/L的NaOH溶液中,觀察現象。
(3)向3毫升 1 mol/L的AlCl3溶液中滴加氨水,直到不再產生白色沉淀為止,將沉淀分裝在兩支試管中,分別滴加NaOH溶液和鹽酸,觀察現象。
(4)用MgCl2溶液代替AlCl3溶液做上述實驗。
(5)觀察現象,并進行比較。
【問題1】比較NaOH、Mg(OH)2、Al(OH)3堿性強弱,什么叫“兩性氫氧化物”?
【問題2】根據以上實驗結果,比較Na、Mg、Al的金屬性強弱。
【問題3】從Na、Mg、Al這三種金屬原子的電子層結構變化中解釋它們金屬性的遞變。
【設計意圖】實證Na、Mg、Al元素金屬性的遞變規律,再用原子結構解釋性質遞變規律,增進學生對結構決定性質的本原性認識,促進學生證據推理和創新精神的發展。
【任務3】預測和探究Si、P、S、Cl非金屬性強弱。
【問題1】結合原子核外電子排布規律,預測Si、P、S、Cl非金屬性強弱。
【學生活動】學生閱教材中的“信息獲取(2)”——非金屬元素Si、P、S、Cl最高價含氧酸的酸性強弱比較表,發現元素非金屬性強弱遞變規律。
【設計意圖】進一步收集證據,發現非金屬元素最高價氧化物對應的水化物酸性的強弱,發現元素非金屬性的強弱遞變規律,引發學生進一步探究硅的性質。
【任務4】探究硅的金屬性與非金屬性。
【過渡】還有其他比較非金屬性強弱的方法嗎?你有哪些事實證據?
【問題1】Al雖然是金屬,但是已經表現出一定的非金屬性,而Si和Al是緊緊相近的元素,那么,Si又會表現出怎樣的性質呢?有兩性嗎?
【學生活動】教師展示Si固體單質,并敲下一小塊Si,讓學生說一說Si的特征,如顏色,質地,熔、沸點,導電能力,生活中用作半導體材料,常溫下性質穩定,等等。
【問題2】從物理性質看,Si是一種典型的非金屬嗎?Si單質具有兩性嗎?
【猜想】能否通過與HCl、NaOH溶液反應去證明Si是否具有兩性?
【實驗】 取少量Si粉分別與水、2 mol/L的HCl、2 mol/L的NaOH作用,發現Si只與NaOH加熱后有氣泡,點燃氣體有爆鳴聲,說明是H2。
【問題3】Si與NaOH溶液反應與Al相似,Si的金屬性比Al強還是弱?
【問題4】怎樣證明H2SiO3的酸性比H3PO4弱?請設計實驗證明。
【實驗】取少量Si與NaOH溶液反應后的溶液于試管中,加H3PO4(磷酸),用激光筆照射可觀察到丁達爾現象,靜置后得到沉淀,該沉淀可溶于NaOH溶液。
【設計意圖】本環節展示了Si單質的實物,提供了教材中沒有的Si單質物理性質等信息資料,豐富了學生的觀察和思考視角,豐富了證據。學生從Si的物理性質可以初步推測它不是典型的金屬,也不是典型的非金屬,猜測Si可能具有兩性;根據Al、Si在周期表中的位置關系和提供的信息材料,引發學生分析、思考相關的問題,再通過相應的實驗探究活動,尋找Al、Si元素性質的相似性和遞變性的證據,發展學生科學探究素養,訓練學生質疑、猜想、設計等高階思維。
【任務5】探究S和Cl的非金屬性強弱。
【問題1】除了比較H2SO4與HClO4的酸性外,還有其他方法證明Cl的非金屬性比S強嗎?請設計實驗證明。
【學生回答】可通過非金屬單質之間能否發生置換反應的實驗來證明。
【分組實驗】在少量新制氯水中滴加H2S溶液,發現有乳白色渾濁出現。
【問題2】課后自己查閱資料:還有什么能證明P、S、Cl非金屬性強弱?
【設計意圖】通過開展教材中沒有的實驗探究,使學生發現S、Cl的非金屬強弱,證實同周期元素從左到右非金屬性的遞變規律;課后,讓學生查閱資料,拓寬學生視野,豐富元素非金屬性強弱的比較方式,發展學生證據推理能力與培養創新精神。
四、多元合作交流,發展高階思維,逐步形成模型認知
開展科學探究,獲取證據之后,在形成第三周期元素周期律初步結論前,教師還需要引導學生開展合作交流,要求她們按照“猜想假設、實驗方案設計、證據收集”的順序撰寫科學探究報告。教師應指導學生不僅要寫出獲得的正確結論,還需應用分析、綜合、比較、反思、論證、思辨、創新等高階思維活動,逐一對實驗獲得的宏觀辨識進行科學解釋,挖掘證據的邏輯本質,實現對高階思維的訓練,逐步形成模型認知。
例如,在探究元素周期律教學中,學生獲得第三周期元素性質遞變的實驗證據后,教師可繼續生成如下問題并引導學開展合作交流和證據推理,逐步形成模型認知。
【問題1】結合上述探究,請你總結第三周期元素的金屬性、非金屬性遞變規律,并從原子結構角度與原子得失電子能力角度解釋原因。
【問題2】如果研究其他同周期元素性質,會有怎樣的結論?
【問題3】什么叫元素周期律?元素性質呈周期性變化的本質原因是什么?
【設計意圖】依據上面科學探究活動所獲得的證據和其他事實材料,歸納總結第三周期元素性質的遞變規律,理解元素周期律的實質,使學生的思維走向深度,同時讓學生體驗到量變引起質變的規律。
五、回歸實踐應用,形成結構化認識,發展科學態度與社會責任
當學生獲得新知,形成認知模型后,教師應給予學生知識應用與遷移的機會,開展模型認知活動,進一步訓練學生高階思維,使其強化概念理解,擴展概念體系內涵。為此,教師可以通過再創設實踐情境,提出問題,鞏固深化學生對于概念的理解。
例如,在探究元素周期律的教學中,教師可結合相關真實情境進一步引導學生開展遷移應用。
【問題1】根據元素周期表,請比較S和Se的性質并判斷它們非金屬性的強弱,說出有哪些事實可以驗證你的預測?
【問題2】觀察門捷列夫的第二張元素周期表,請回答:
(1)你認為門捷列夫把Ag與Zn分別放在第I族與第Ⅱ族的理由是什么?
(2)當時就有人認為,元素周期表的對角線元素有相似性(如Li與Mg、Be和Al),你能用元素周期律予以解釋嗎?
(3)門捷列夫還成功預言了“類硅”元素Ge的存在,請同學們課后查閱資料分析Ge及其常見化合物的性質,并與相鄰元素As作比較。
【設計意圖】學生應用剛剛建立起的知識關聯結構化和認識思路結構化的“位—構—性”認知模型,回歸實際應用,進行模型認知。即解釋元素周期表中對角線元素相似,以及門捷列夫的第二張元素周期表中“類硅”引發的證據推理,訓練高階思維,發展科學態度與社會責任核心素養,同時起到本節課學習內容前呼后應的效果。
科學探究學習是發展學生科學探究素養的重要路徑,是學生逐層增進科學知識理解的過程,也是知識遷移與創新能力發展的過程。在科學探究學習過程,設計能引發學生開展探究的真實情境問題是關鍵,促進學生知識遷移整合,訓練學生的高階思維,是形成科學思維方法根本。
參考文獻:
[1]中華人民共和國教育部. 普通高中化學課程標準(2017年版2020年修訂)[M].北京:人民教育出版社,2020.
[2]陳貴新, 鐘文麗. 在自主探究中深度認識醛的性質[J].中學化學教學參考,2020(12).
[3]肖中榮, 陳進前. 基于學生認識發展的教學重構[J].中學化學教學參考,2015(7).
(責任編輯:楊強)

