生長素IAA對食用菌生長發育影響的研究進展
摘 " "要:吲哚-3-乙酸(Indole-3-acetic acid,IAA)屬于生長素吲哚衍生物家族,是最重要的植物激素之一,在植物、真菌、細菌中廣泛存在。IAA在食用菌中的作用和功能研究越來越受到重視。綜合比較了IAA的生物合成途徑,分析了IAA對食用菌生長、發育的影響,以及提高食用菌抗性和促進共生宿主植物生長的作用。最后系統總結了IAA在食用菌中可能的作用機制,為研究IAA在食用菌生長發育中的調控機制及其應用提供了理論依據。
關鍵詞:食用菌;吲哚-3-乙酸;生長;機制
中圖分類號:S646 文獻標志碼:A 文章編號:1673-2871(2024)08-008-07
Research progress of auxin IAA on the growth and development of edible fungi
CUI Xiao, KONG Weili
(Institute of Edible Fungi, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China)
Abstract: Indole-3-acetic acid(IAA)belongs to the indole derivative family of auxin and is one of the most important plant hormones, which widely presents in plants, fungi and bacteria. The role and function of IAA in edible mushrooms are receiving increasing attention. The author comprehensively compared the biosynthesis pathways of IAA, analyzed the effects of IAA on the growth and development of edible mushrooms, as well as its role in improving the resistance of edible mushrooms and promoting the growth of symbiotic host plants. Finally, the possible mechanism of IAA in edible fungi was summarized systematically, providing a theoretical basis for studying the regulation mechanism and application of IAA in the growth and development of edible mushrooms.
Key words:Edible mushrooms; Indole-3-acetic acid; Growth; Mechanism
吲哚-3-乙酸(indole-3-acetic acid,IAA)是植物中天然存在的生長素,屬于吲哚衍生物的生長素家族。2010年IAA作為第一個生長素分子被報道出來[1]。IAA是植物中最豐富和最基本的天然生長激素,幾乎控制著植物生長和發育的各個方面,如細胞分裂、伸長、果實發育和衰老,還可以增強植物對外部壓力的應對能力[2]。IAA不僅可以在植物中合成,也可以在許多與植物相互作用的微生物中合成,包括細菌和真菌[3]。目前,已經確定生長素不僅參與向性的控制,還調節許多植物發育反應,這些反應主要依賴于細胞分裂、生長和分化的時空控制[4]。除IAA外,苯乙酸(phenylacetic acid,PAA)和4-氯吲哚-3-乙酸(4-chloro-indole-3-acetic acid,4-Cl-IAA)也是植物中天然存在的生長素[4]。盡管兩者都可以被生長素信號機制感知,但4-Cl-IAA并不普遍,而PAA因作用通常較弱,對兩者的研究遠遠少于IAA[5]。
真菌產生的IAA除了調節其自身生理功能、適應外部脅迫和微生物-微生物通信外,還可以作為信號分子參與微生物和植物的相互作用,調節植物生長發育,引起植物的生理和病理變化。因此,闡明真菌中,特別是食用菌中IAA的生物合成途徑及作用,對研究微生物中IAA的功能具有重要意義。筆者在前期研究中發現,IAA可以促進平菇的生長發育[6],且色氨酸代謝通路中相關基因參與調控其生長發育[7-8],但是目前對于IAA在食用菌中作用和功能的綜述較少。因此,筆者在前期IAA對平菇生長發育影響及調控機制研究的基礎上,總結了IAA對食用菌生長發育的影響及可能的調控機制,同時比較了與植物體內IAA的可能合成途徑,以期為研究IAA在食用菌生長發育中的調控機制及應用提供理論依據。
1 IAA的合成
根據是否使用色氨酸(tryptophan,Trp)作為前體,IAA的生物合成可分為色氨酸依賴和色氨酸非依賴途徑。
1.1 色氨酸依賴途徑
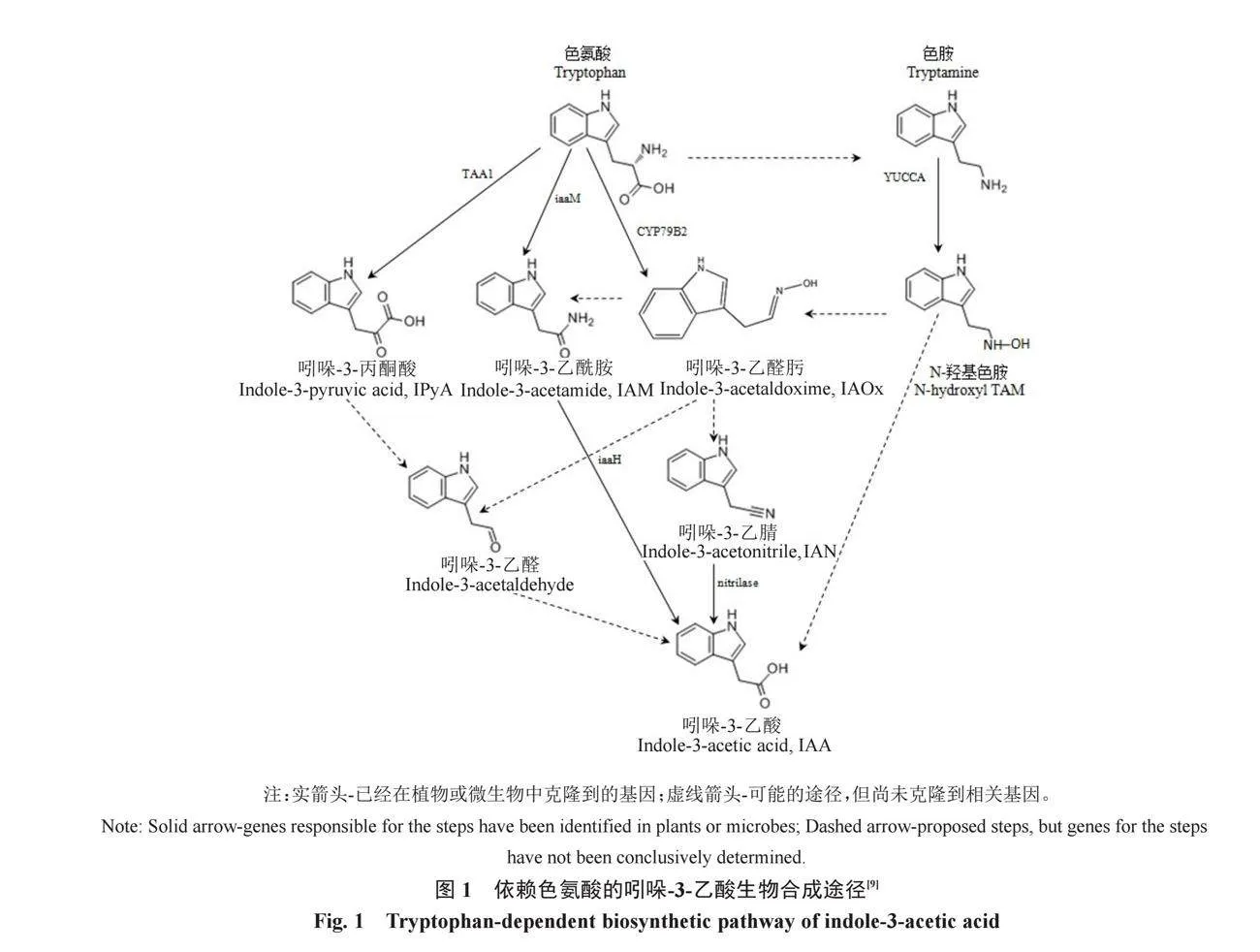
在20世紀90年代,對生長素代謝的研究已經確定芳香族氨基酸L-色氨酸是植物中IAA生物合成的前體[9]。Trp在植物中通過莽草酸途徑產生,除動物外,大多數生物都通過該途徑產生芳香氨基酸[10]。Trp依賴途徑的IAA合成不是單線的,它涉及多種平行途徑,這些途徑在IAA的產生過程中匯合,其中吲哚-3-乙醛肟(indole-3-acetaldoxime,IAOx)/吲哚-3-乙酰胺(indole-3-acetamide,IAM)和吲哚-3-丙酮酸(indole-3-pyruvic acid,IPyA)是最常見的中間體[2](圖1)。IAOx是色氨酸依賴途徑生長素生物合成中的一種特別相關分子。IAOx可以在不同氮營養條件下誘導蒺藜苜蓿(Medicago truncatula)產生SUR表型和IAA的差異信號傳導[11]。IAM合成IAA需要2個同源的IAM水解酶基因,外源性應用IAM或通過在擬南芥中過表達細菌iaaM基因產生IAM導致生長素過度產生表型[12]。IPyA途徑已被確定為植物IAA生物合成的主要和必要途徑。它由兩步反應組成,其中Trp首先通過擬南芥色氨酸氨基轉移酶1(tryptophan aminotransferase of Arabidopsis 1,TAA1)和TAA1相關蛋白(TARs)脫氨基為IPyA。IPyA然后在來自YUCCA(YUC)家族的含黃素單加氧酶催化的限速和不可逆反應中脫羧為IAA[13]。Sato等[14]研究發現,吲哚-3-丙酮酸可以調節TAA1活性,TAA1在避免IPyA過度積累或積累不足方面發揮著關鍵的調節作用,這種負反饋調節似乎是通過Trp氨基轉移酶活性的可逆性和IPyA對TAA1活性的競爭性抑制來實現的。
1.2 色氨酸非依賴途徑
在Trp生物合成有缺陷的玉米和擬南芥突變體中仍可產生IAA,這使得生長素合成的非依賴Trp途徑被發現[15]。有研究者認為,胞質吲哚合酶(cytosolic indole synthase,INS)可以通過吲哚-3-甘油磷酸轉化為吲哚,從而介導非Trp依賴途徑IAA的產生[16]。后來有研究者通過對擬南芥基因組的分析來闡明INS的途徑,發現在IAA合成起作用的酶中,酰胺酶在一般和光照條件下與INS呈共表達、正相關關系,表明酰胺酶可能參與Trp非依賴途徑[17]。Ostrowski等[18]研究玉米種子發育過程中IAA酯偶聯物吲哚-3-乙酰基-肌醇的生物合成途徑發現,1-O-吲哚-3-乙酰基-β-d-葡萄糖(1-O-indole-3-acetyl-β-d-glucose,IAGlc)合酶和吲哚-3-乙酰轉移酶(indole-3-acetyl transferase)是IAA肌醇(IAA-inositol,IAInos)合成的兩步途徑中的關鍵酶。在廣東蟲草中,IAA可以通過色氨酸依賴途徑和吲哚丙酮酸途徑合成[19]。
2 IAA對食用菌的影響
2.1 促進食用菌生長發育
IAA在促進食用菌生長發育等方面的作用極為重要。首先,IAA可以促進食用菌菌絲、菌蓋生長,增加產量。Ramachela等[20]研究了不同激素處理基質對平菇菌絲體發育、原基形成和生物量的影響,結果表明,用IAA處理的基質產生的菌蓋平均直徑可達13.42 cm。IAA對白靈菇生長發育的調節作用也較強,能夠促進白靈菇提前現蕾,提高出菇率[21]。IAA可以誘導猴頭菇子實體生長發育,0.5 mg·kg-1 IAA既能將猴頭菇生長周期縮短4 d,還可以將其產量提高22.18%,有望進一步應用到生產中[22]。Krause等[23]發現,IAA及其前體的加入可以誘導褐黃口蘑菌根的伸長和菌絲分枝;但是,IAA沒有誘導腐生菌裂褶菌(Schizophyllum commune)的形態發生變化。草菇廣泛種植于熱帶和亞熱帶地區,具有較高的商業、營養和藥用價值。乙酸鈉能顯著提高草菇子實體發育早期的IAA含量,影響草菇的子實體分化,產量提高30.22%[24]。噴灑10-5 mol·L-1的生長素可以促進草菇出菇,提高產量,而且現蕾提前,這可縮短草菇上市周期[25]。
不同濃度IAA對食用菌的影響不同。高質量濃度IAA(10~80 mg·L-1)會降低平菇菌絲生長速度;當IAA質量濃度為0.2、0.4 mg·L-1時,對平菇菌絲生長速度基本無影響[26]。在植物中有研究報告稱,高濃度的IAA會抑制種子發芽和植物生長[27],抑制情況是由高水平生長素積累刺激1-氨基環丙烷-1-羧酸合酶誘導乙烯生產引起的,導致植物生長異常和衰老。為了找出合適的IAA濃度,崔筱等[6]以平菇菌株P99為對象,研究了不同濃度的外源IAA對平菇菌絲的菌落直徑、菌絲干質量、平菇原基形成時間、菇蕾數量和平菇產量的影響,發現IAA在不同的生長階段發揮不同的作用。在菌絲體發育階段,外源IAA濃度降低會導致菌絲生長速度增快,但當IAA濃度低至10-10 mol·L-1時,菌絲生長速度變慢;在子實體發育階段,添加10-8 mol·L-1的外源生長素可增加菇蕾數量和子實體產量,生長素含量和生長素氧化酶活性的變化影響了不同濃度處理條件下的平菇生長。為縮短金福菇母種的生長周期,王謙等[28]研究了5種不同濃度的IAA對金福菇菌絲生長的影響,通過菌絲日平均生長速度篩選出適宜的質量濃度,試驗結果表明,IAA的適宜質量濃度為1.0 mg·L-1。
發酵料栽培平菇技術在整個平菇生產過程中占據較為重要的地位[29]。胡素娟等[30]研究發現,發酵后的培養料能夠抑制霉菌生長并促進平菇生長,張俊杰等[31]通過采集不同時期的平菇發酵料樣品,對其中細菌菌株產IAA的能力進行定量測定,并采用16S rRNA基因擴增及測序對產IAA能力強的菌株進行定性和系統發育分析,發現116株細菌有產IAA的能力,并確定AFX-13-3(巨大芽孢桿菌屬)和XWW-4-3(谷氨酸桿菌屬)產IAA的能力較強。
2.2 提高食用菌抗逆性
IAA還可以增強食用菌在極端條件下的耐受性。在我國香菇種植地區,高溫脅迫給我國香菇生產造成巨大損失[32-33]。周莎莎等[34]使用香菇熱敏感菌株YS3357,外源添加IAA,發現IAA能夠顯著提高熱敏感菌株的耐熱能力,增強香菇對高溫脅迫的耐受能力。高溫會對香菇菌絲體的生長產生不良影響,導致腐爛的原木或菌袋被其他病原體感染,香菇產量和品質下降。Wang等[35]發現,在香菇耐熱菌株S606菌株中,色氨酸合成限速酶鄰氨基苯甲酸(o-aminobenzoic acid,OABA)合成酶的蛋白質表達水平在熱應激24 h后顯著增加,但在熱敏菌株YS3357中的下降水平可忽略不計,而且熱應激后S606中IAA生物合成的重要酶吲哚-3-丙酮酸單加氧酶(Indole-3-pyruvate monooxygenase)LeYUCCA基因上調,但在YS3357中下調,推測色氨酸和IAA途徑在香菇菌絲體防御熱脅迫中起著重要作用,IAA可能在增強機體耐熱性方面發揮關鍵作用。此外,通過在固體培養基和液體培養基中添加20 mg·L-1 IAA可以顯著提高金針菇菌絲體的生物量,并且能顯著提高菌絲體抗凍多糖的活性,增強金針菇對低溫的耐受性[36]。在植物中,也發現了IAA可提高植物的抗逆性,研究表明,內源性吲哚-3-乙酸和一氧化氮是減輕小麥幼苗中氧化銅納米顆粒毒性所必需的[37]。
2.3 提高食用菌功能成分含量
IAA還可以提高食用菌中某些成分的含量。例如,蟲草素是真菌蟲草中的一種重要活性物質,但野生蟲草中蟲草素含量較低。有研究通過添加各種生長補充劑,在浸沒條件下提高蟲草素的產量。通過反相高效液相色譜法評價,結果表明,與未加IAA的空白對照組蟲草素產量(13.66±0.64)mg·L-1相比,補充IAA后蟲草素產量為(226.02±1.69)mg·L-1,說明在浸沒條件下使用IAA可以提高冬蟲夏草中的蟲草素產量[38]。在轉錄水平上,與蟲草素生物合成相關的基因,如NT5E、RNR、purA和ADEK顯著上調[38]。在植物中,Bunsangiam等[39]發現,外源IAA處理后青蒿中的青蒿素和二氫青蒿素酸含量可增加近2倍。說明IAA在提高生物體功能成分含量方面作用顯著。
2.4 影響真菌與共生植物的關系
有研究表明,微生物合成的生長素在植物-微生物相互作用中起著重要作用。從浮萍上分離的細菌菌株中,較高水平的IAA產生能力與其改變擬南芥幼苗根系發育能力之間的相關性是顯著的[40]。蘇云金芽孢桿菌定殖于玉米,其合成的IAA可以促進玉米生長,包括總根長、根投影面積、側根、地上部分干物質和發芽速度指數[41]。吲哚丙酮酸脫羧酶基因可以通過與吲哚-3-乙酸酰胺合成酶基因相互作用調節水稻生長素合成途徑,促進鎘脅迫下的根毛發育[42]。
外生菌根共生對森林生態系統的功能非常重要,樹木與真菌的合作可以提高樹木對抗壓力的能力。IAA可以將菌根的形成和共生植物之間的生長素信號傳導聯系起來。真菌來源的IAA起到擴散信號的作用,影響根定殖并增加外生菌根中Hartig網的形成。褐黃口蘑的土壤提取物中發現了包含IAA在內的多種植物激素,而云杉根系分泌物的植物激素模式多樣性較低,褐黃口蘑的IAA參與了早期菌根中地幔和Hartig網的形成,從而刺激植物生長[43]。肺形側耳(Pleurotus pulonarius)是一種產IAA的腐木大型真菌,前人研究表明,當與水稻(單子葉植物)和番茄(雙子葉植物)幼苗共培養時,肺形側耳表現出許多促進植物生長的特征[43]。Pham等[44]采用真菌-植物共培養肺形側耳產生的IAA研究其對植物胚芽鞘伸長、莖尖和根尖的影響,以水稻和番茄幼苗為模型系統,加入肺形側耳的培養上清液,結果顯示其可以使植株的側根數增加,而且增加水稻和番茄幼苗的主根長度,并刺激番茄幼苗莖的伸長,提高水稻和番茄幼苗的葉綠素含量和鮮質量,促進植物幼苗生長[44]。
3 IAA對食用菌生長調節的相關機制
IAA對食用菌生長發育調節的機制較復雜。有研究認為,IAA在一定程度上可以抑制超氧陰離子產生,降低脂氧合酶(LOX)活性和硫代巴比妥酸反應物(TBARS)含量,提高超氧化物歧化酶活性,進而緩解高溫脅迫下香菇菌絲體的氧化損傷[34]。Wang等[35]通過蛋白質組和轉錄組數據分析發現,熱休克蛋白(heat shock proteins,HSPs),如Hsp40(DnaJ)、Hsp70、Hsp90以及IAA關鍵酶LeTrpE、LeTrpD、LeTam-1、LeYUCCA在香菇耐熱菌株S606中的表達高于熱敏感菌株YS3357,表明色氨酸以及IAA代謝途徑在耐熱性中發揮重要作用,外源IAA可以增強香菇對熱脅迫的耐受性。Wen等[45]結合轉錄組學和代謝組學分析,系統研究了松茸子實體在冷藏過程中的代謝變化,發現IAA及其合成途徑的成分,這體現出它們作為松茸及其共生植物之間的溝通者的潛在作用,為進一步了解松茸果實采后冷藏過程中的代謝機制提供了新的信息。崔筱等[7]研究發現,外源IAA可以通過影響平菇內源IAA的分泌及生長素氧化酶活性,影響平菇生長發育過程,這些結果可為平菇生長發育期添加外源IAA提供理論依據。而且,低濃度IAA通過TRINITY_DN2732_c0_g1基因調控平菇菌絲體階段的內源激素合成,通過TRINITY_DN530_c0_g1及TRINITY_DN3832_c0_g1基因調控平菇子實體的代謝過程;而高濃度IAA通過TRINITY_DN35150_c0_g1、TRINITY_DN5314_c0_g1、TRINITY_DN43009_c0_g1基因調控平菇菌絲體階段的氧化應激機制,通過TRINITY_DN21430_c0_g1基因調控子實體階段的ATP合成[8]。
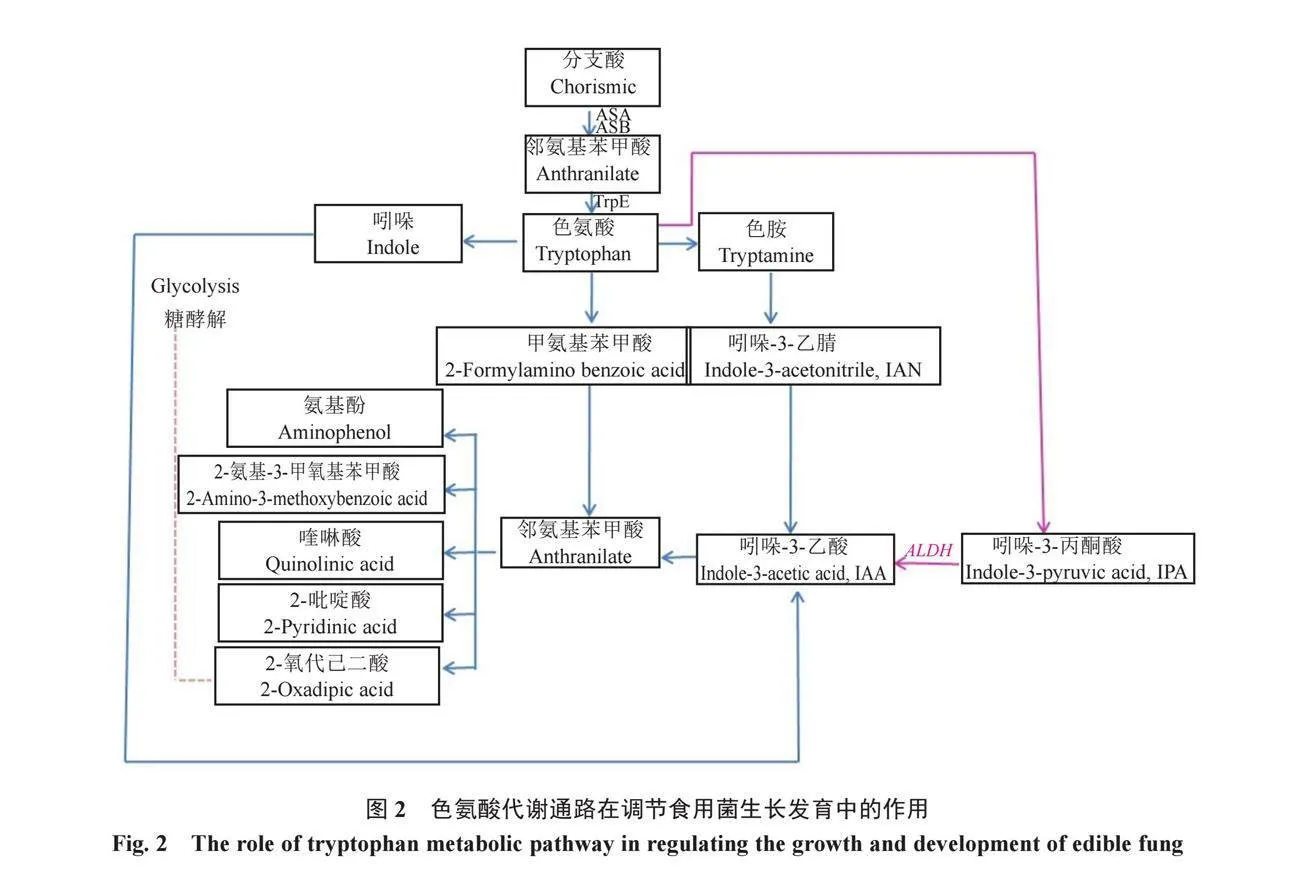
竹蓀是一種在東亞國家應用廣泛的食用和藥用真菌。Duan等[46]使用Nanopore和Illumina測序方法對竹蓀進行了基因組、轉錄組和代謝組的綜合分析,發現在菌絲體分化為子實體的過程中,菌蓋是IAA合成的主要來源,大量的L-色氨酸首先被合成并富集在菌蓋和菌柄中,大部分L-色氨蛋白代謝為色胺,再代謝為3-吲哚乙腈,然后是IAA,接下來,IAA被代謝為節點代謝產物鄰氨基苯甲酸,后者進一步轉化為2-氨基苯酚、2-氨基-3-甲氧基苯甲酸、喹啉酸、2-吡啶酸和2-氧代己二酸。最終,2-氧代己二酸通過糖酵解的下一個代謝途徑(ko00010)進行代謝,表明在菌絲體形成子實體的過程中,代謝產物L-色氨酸和色氨酸代謝途徑發揮著重要作用(圖2)。該研究還發現3個與IAA合成相關的新基因(5965_g、5966_g和6182_g),它們可能調節竹蓀子實體的合成并提高竹蓀的品質[46]。
C2H2型鋅指蛋白可以調節真核生物的發育過程和非生物脅迫反應。Ding等[47]在平菇中鑒定出18個C2H2型鋅指蛋白,用IAA處理后,只有PeosPC15_2-1046937的表達不受影響,PeosPC15_2-1091415和PeosPC105.2-1102653的表達下調,而PeosPC115-2-1079678和PeosPC 15_2-1089905的表達上調,表明不同C2H2型鋅指蛋白受到生長素的不同調節。此外,在熱和冷脅迫下,PeosPC15_2-1079678、PeosPC115-2-1089905和PeosPC15_2-1095114受冷應激和熱應激的影響而產生不同的變化,這表明IAA可能通過C2H2型鋅指蛋白參與非生物脅迫反應,可用于平菇抗逆性研究。
DnaJ蛋白是一種熱休克蛋白,作為分子伴侶在調節生物體生長發育以及適應環境中發揮關鍵作用。WANG等[48]研究表明,LeDnaJ基因沉默可導致香菇對熱脅迫耐性減弱和綠色木霉抗性缺陷,外源IAA的添加可以部分恢復2個LeDnaJ RNAi轉化體對綠色木霉的抗性和耐熱性,說明LeDnaJ可通過參與IAA生物合成的蛋白質相互作用調節香菇中IAA的生物合成,參與真菌生長、綠色木霉抗性和耐熱性。
乙醛脫氫酶(aldehyde dehydrogenase,ALDH)基因屬于高度轉錄、可誘導和嚴格控制的真菌基因,其編碼的酶通過將大量內源性或外源性醛氧化為相應的酸來提供解毒功能。IAA在真菌中的色氨酸依賴途徑,最后一步的醛氧化包括從吲哚-3-乙醛到吲哚-3-乙酸,這一步需要ALDH的參與。Krause等[23]應用基因表達、IAA化合物標記、轉運體異源表達和生物信息學研究了IAA對真菌形態發生和外生菌根的影響,發現褐黃口蘑可以通過吲哚-3-丙酮酸由色氨酸產生IAA,該生物合成途徑的最后一步由ALDH催化(圖2),而且發現基因ald1在外生菌根中高度表達,并由吲哚-3-乙醛誘導。也有研究提出,ald1通過ald5參與真菌中的IAA生物合成或IAA相關信號傳導,其中ald1受IAA前體添加的影響最大[49]。
4 結論與展望
IAA是一種植物激素,廣泛存在于植物、真菌、細菌,其在植物中的合成調控途徑研究清晰。研究表明,IAA對食用菌的生長發育起著重要的控制作用。筆者在前期研究IAA對平菇生長發育影響及調控機制研究的基礎上,綜述了生物合成途徑的最新進展,包括色氨酸依賴和非依賴途徑。此外,IAA對食用菌的菌絲生長、菌蓋大小、子實體生長均有重要作用,可以為食用菌的增產提供思路。另外,IAA對食用菌的極端條件耐受能力也有影響,這有助于開發新的運輸和貯存方式。隨著科學技術的發展,許多參與食用菌IAA合成的關鍵酶或基因已被鑒定。然而,復雜的IAA生物合成網絡,特別是一些合成途徑中各種調節基因和關鍵酶基因之間的相互作用,還沒有被完整揭示。闡明IAA在食用菌中的合成、代謝、運輸和信號轉導途徑,對合理和充分利用IAA促進食用菌生長發育、提高產量以及創造顯著的經濟、環境和社會效益等有重要意義。
參考文獻
[1] ABEL S,THEOLOGIS A.Odyssey of auxin[J].Cold Spring Harb Perspectives in Biology,2010,2(10):a004572.
[2] RUBEN C S,EDUARDOMB,KARIN L.Auxin metabolism in plants[J].Cold Spring Harb Perspectives in Biology,2021,13(3):a039867.
[3] TANG J T,LI Y K,ZHANG L L,et al.Biosynthetic pathways and functions of indole-3-Acetic acid in microorganisms[J].Microorganisms,2023,11(8):2077.
[4] GALLEI M,LUSCHNIG C,FRIML J.Auxin signalling in growth:Schr?dinger's cat out of the bag[J].Current Opinion in Plant Biology,2020,53:43-49.
[5] COOK S D.An historical review of phenylacetic acid[J].Plant and Cell Physiology,2019,60(2):243-254.
[6] 崔筱,張玉亭,劉芹,等.平菇生長發育過程中IAA含量及IAA氧化酶活性變化研究[J].天津農業科學,2020,26(10):31-36.
[7] 崔筱,胡素娟,徐柯,等.不同濃度IAA影響平菇菌絲生長的調控機制研究[J].河南大學學報(自然科學版),2021,51(4):437-448.
[8] 崔筱,張玉亭,孔維麗,等.平菇生長發育過程中對IAA響應的轉錄組分析[J].河南農業科學,2022,51(12):97-109.
[9] ZHAO Y D.Auxin biosynthesis and its role in plant development[J].Annual Review of Plant Biology,2010,61:49-64.
[10] MAEDA H,DUDAREVA N.The shikimate pathway and aromatic amino Acid biosynthesis in plants[J].Annual Review of Plant Biology,2012,63:73-105.
[11] BUEZO J,ESTEBAN R,CORNEJO A,et al.IAOx induces the SUR phenotype and differential signalling from IAA under different types of nitrogen nutrition in Medicago truncatula roots[J].Plant Science,2019,287:110176.
[12] GAO Y B,DAI X H,AOI Y K,et al.Two homologous INDOLE-3-ACETAMIDE(IAM) HYDROLASE genes are required for the auxin effects of IAM in Arabidopsis[J].Journal of Genetics and Genomics,2020,47(3):157-165.
[13] CAO X,YANG H L,SHANG C Q,et al.The roles of auxin biosynthesis YUCCA gene family in plants[J].International Journal of Molecular Sciences,2019,20(24):6343.
[14] SATO A,SOENO K,KIKUCHI R,et al.Indole-3-pyruvic acid regulates TAA1 activity,which plays a key role in coordinating the two steps of auxin biosynthesis[J].Proceedings of the National Academy of Sciences of the United States of America,2022,119(25):e2203633119.
[15] NORMANLY J,COHEN J D,FINK G R.Arabidopsis thaliana auxotrophs reveal a tryptophan-independent biosynthetic pathway for indole-3-acetic acid[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(21):10355-10359.
[16] WANG B,CHU J F,YU T,et al.Tryptophan-independent auxin biosynthesis contributes to early embryogenesis in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(15):4821-4826.
[17] ABU-ZAITOON Y M,ABU-ZAITON A,AL TAWAHA A R,et al.Evidence from Co-expression analysis for the involvement of amidase and INS in the tryptophan-independent pathway of IAA synthesis in Arabidopsis[J].Applied Biochemistry and Biotechnology,2022,194(10):4673-4682.
[18] OSTROWSKI M,CIARKOWSKA A,DALKA A,et al.Biosynthesis pathway of indole-3-acetyl-myo-inositol during development of maize (Zea mays L.) seeds[J].Journal of Plant Physiology,2020,245:153082.
[19] WANG G Z,LI M,ZHANG C H,et al.Transcriptome and proteome analyses reveal the regulatory networks and metabolite biosynthesis pathways during the development of Tolypocladium guangdongense[J].Computational and Structural Biotechnology Journal,2020,18:2081-2094.
[20] RAMACHELA K,SIHLANGU S M.Effects of various hormonal treated plant substrates on development and yield of Pleurotus ostreatus[J].Cogent Food and Agriculture,2016,2:1276510.
[21] 張紅剛,郭明慧,郭尚,等.不同生長調節物質對白靈菇生長發育的影響[J].山西農業科學,2019,47(3):366-369.
[22] VIMINHTHUAN,李雄,郭麗瓊,等.誘導物對猴頭菇子實體生長發育及產量的影響[J].食品工業科技,2017,38(12):77-80.
[23] KRAUSE K,HENKE C,ASIIMWE T,et al.Biosynthesis and secretion of indole-3-Acetic acid and its morphological effects on Tricholoma vaccinum-spruce ectomycorrhiza[J].Applied and Environmental Microbiology,2015,81(20):7003-7011.
[24] HOU L J,LI Z P,LI C T,et al.Enhanced enzymatic hydrolysis of cellulose from substrate and indole-3-acetic acid content-during the fruiting body differentiation stage by sodium acetate addition[J].Frontiers in Fungal Biology,2021,2:746313.
[25] 陳炳智.草菇子實體生長素代謝相關基因的差異表達分析[D].福州:福建農林大學,2012.
[26] 胡延如,王月,董浩哲,等.幾種常見植物激素對平菇菌絲生長速度的影響[J].食用菌,2022,44(1):4-7.
[27] PARK J M,RADHAKRISHNAN R,KANG S M,et al.IAA producing Enterobacter sp. I-3 as a potent bio-herbicide candidate for weed control:A special reference with lettuce growth inhibition[J].Indian Journal of Microbiology,2015,55(2):207-212.
[28] 王謙,劉敏,徐嘯晨,等.外源激素對金福菇菌絲營養生長的影響[J].河北大學學報(自然科學版),2012,32(3):286-290.
[29] 胡曉強,李峰,李棟,等.河南省平菇發酵料袋栽技術[J].中國食用菌,2021,40(6):96-99.
[30] 胡素娟,宋凱博,劉芹,等.玉米芯發酵料水浸提液促平菇菌絲生長的機理研究[J].河南農業大學學報,2021,55(2):273-280.
[31] 張俊杰,王京琪,劉芹,等.發酵料中促平菇生長菌株的分離與鑒定[J].河南農業科學,2023,52(5):142-149.
[32] 趙妍,王麗寧,蔣俊,等.利用雜交方法選育香菇耐高溫菌株[J].分子植物育種,2016,14(11):3145-3153.
[33] 曹現濤,邊銀丙,肖新軍,等.高溫脅迫對香菇菌絲生長及其抗哈茨木霉能力的影響[J].食用菌學報,2015,22:81-85.
[34] 周莎莎,王剛正,羅義,等.生長素及其類似物增強香菇耐高溫性的研究[J].菌物學報,2018,37(12):1723-1730.
[35] WANG G Z,MA C J,LUO Y,et al.Proteome and transcriptome reveal involvement of heat shock proteins and indoleacetic acid metabolism process in Lentinula edodes thermotolerance[J].Cellular Physiology and Biochemistry,2018,50(5):1617-1637.
[36] 秦璐婕.金針菇抗凍多糖結構分析及其冷凍保護效果研究[D].上海:華東師范大學,2022.
[37] YADAV V,GILL R A,ARIF N,et al.Endogenous indole-3-acetic acid and nitric oxide are required for calcium-mediated alleviation of copper oxide nanoparticles toxicity in wheat seedlings[J].Physiologia Plantarum,2021,173(4):2262-2275.
[38] KAUSHIK V,SINGH A,ARYA A,et al.Enhanced production of cordycepin in Ophiocordyceps sinensis using growth supplements under submerged conditions[J].Biotechnology Reports,2020,28:e00557.
[39] BUNSANGIAM S,THONGPAE N,LIMTONG S,et al.Large scale production of indole-3-acetic acid and evaluation of the inhibitory effect of indole-3-acetic acid on weed growth[J].Scientific Reports,2021,11(1):13094.
[40] GILBERT S,POULEV A,CHRISLER W,et al.Auxin-producing bacteria from duckweeds have different colonization patterns and effects on plant morphology[J].Plants-Basel,2022,11(6):721.
[41] FIGUEREDO E F,DA CRUZ T A,ALMEIDA J R,et al.The key role of indole-3-acetic acid biosynthesis by Bacillus thuringiensis RZ2MS9 in promoting maize growth revealed by the ipdC gene knockout mediated by the CRISPR-Cas9 system[J].Microbiological Research,2023,266:127218.
[42] SHAH G L A,FIAZ S,ATTIA K A,et al.Indole pyruvate decarboxylase gene regulates the auxin synthesis pathway in rice by interacting with the indole-3-acetic acid-amido synthetase gene,promoting root hair development under cadmium stress[J].Frontiers in Plant Science,2022,13:1023723.
[43] ABDULSALAM O,WAGNER K,WIRTH S,et al.Phytohormones and volatile organic compounds,like geosmin,in the ectomycorrhiza of Tricholoma vaccinum and Norway spruce(Picea abies)[J].Mycorrhiza,2021,31(2):173-188.
[44] PHAM M T,HUANG C M,KIRSCHNER R.The plant growth-promoting potential of the mesophilic wood-rot mushroom Pleurotus pulmonarius[J].Journal of Applied Microbiology,2019,127(4):1157-1171.
[45] WEN X F,GENG F,XU Y S,et al.Quantitative transcriptomic and metabolomic analyses reveal the changes in Tricholoma matsutake fruiting bodies during cold storage[J].Food Chemistry,2022,381:132292.
[46] DUAN M,LONG S F,WU X J,et al.Genome,transcriptome,and metabolome analyses provide new insights into the resource development in an edible fungus Dictyophora indusiata[J].Frontiers in Microbiology,2023,14:1137159.
[47] DING Q Q,ZHAO H Y,ZHU P L,et al.Genome-wide identification and expression analyses of C2H2 zinc finger transcription factors in Pleurotus ostreatus[J].PeerJ,2022,10:e12654.
[48] WANG G Z,ZHOU S S,LUO Y,et al.The heat shock protein 40 LeDnaJ regulates stress resistance and indole-3-acetic acid biosynthesis in Lentinula edodes[J].Fungal Genetics and Biology,2018,118:37-44.
[49] HENKE C,JUNG E M,VOIT A,et al.Dehydrogenase genes in the ectomycorrhizal fungus Tricholoma vaccinum:A role for Ald1 in mycorrhizal symbiosis[J].Journal of Basic Microbiology,2016,56(2):162-174.

