南瓜白粉病拮抗內生細菌BacilluscereusB4-2的分離鑒定及生防效果



摘 " "要:從高抗白粉病的南瓜植株內分離篩選出對南瓜白粉病有較好防治效果的內生拮抗細菌菌株,為南瓜白粉病的生物防治提供新途徑。采用孢子萌發抑制法、葉盤漂浮法和溫室盆栽試驗篩選出有較好防效的內生細菌,用形態觀察、生理生化測定和分子生物學方法進行鑒定。結果表明,從高抗白粉病的南瓜自交系22G3植株內分離獲得29株內生拮抗細菌菌株,5個菌株對南瓜白粉菌的孢子萌發抑制率在50%以上,其中菌株B4-2對白粉菌的孢子萌發抑制率最高,為88.65%。葉盤和室內盆栽試驗結果均表明,菌株B4-2對南瓜白粉病的防治效果最好,防治效果分別達79.58%和83.21%。不同稀釋倍數的B4-2發酵液對南瓜白粉病均有一定的防治效果,隨著稀釋倍數的增大,防治效果降低,其中菌株B4-2發酵液原液對南瓜白粉病的防治效果最好,達82.14%。通過形態特征、生理生化特征及基因序列分析,鑒定菌株B4-2為蠟樣芽孢桿菌(Bacillus cereus)。綜上所述,蠟樣芽孢桿菌B4-2能較好地防治南瓜白粉病,有一定的開發潛力。
關鍵詞:南瓜;白粉病;蠟樣芽孢桿菌;生物防治;防治效果
中圖分類號:S642.1 文獻標志碼:A 文章編號:1673-2871(2024)08-051-06
Isolation and identification of endophytic Bacillus cereus B4-2 against pumpkin powdery mildew and effect of biological control
LI Yali, QI Liben
(Vegetable Institute, Gansu Academy of Agricultural Sciences, Lanzhou 730070, Gansu, China)
Abstract: In order to find the new biological control method against pumpkin powdery mildew, this experiment screened the endophytic antagonistic bacteria against pumpkin powdery mildew from high resistance plants. The spore germination inhibition method, leaf disk floating method and greenhouse pot experiment method were used to select endophytic bacteria with good control effect, which was identified by morphological observation, physiological and biochemical determination as well as molecular biology method. The results showed that 29 endophytic antagonistic bacterial strains were isolated from the high resistant pumpkin inbred line 22G3. Among them, 5 strains had an inhibition rate of over 50% on the spore germination of powdery mildew, and B4-2 had the highest inhibition rate of 88.65%. Both leaf disc and potting experiments showed that the strain B4-2 had the best control effect on pumpkin powdery mildew, with the control effects of 79.58% and 83.21%, respectively. All the different dilution ratios of B4-2 fermentation had certain control effects on pumpkin powdery mildew. As the dilution ratio increased, the prevention effect decreased. The prevention effect of original B4-2 solution was the best and was 82.14%. B4-2 was identified as Bacillus cereus by morphological, physiological, biochemical and gene sequence analysis methods. In summary, B. cereus B4-2 can effectively control pumpkin powdery mildew, which has certain potential for development.
Key words: Pumpkin; Powdery mildew; Bacillus cereus; Biological control; Control efficiency
南瓜是葫蘆科一年蔓生草本植物,是我國重要的蔬菜之一。南瓜富含蛋白質、維生素、多糖和人體必需氨基酸、β-胡蘿卜素、鈣、鐵、磷等,有很高的營養價值和保健功能,有廣闊的開發前景和較高的利用價值[1]。白粉病是南瓜生產中最重要的病害之一,具有潛伏期長、發病迅速、繁殖快等特點。防治不及時可造成減產甚至絕收,可對南瓜的品質和產量造成嚴重的影響[2]。
植物內生菌是指在植物生活史的部分階段,生活于健康植物的各種組織和器官內部且沒有引起植物組織明顯病癥的微生物,包括內生細菌、內生真菌和內生放線菌[3-5]。已知所有植物物種中均有內生菌的存在[6-7]。目前,普遍認為內生細菌是從經過嚴格表面消毒的植物組織中分離出來的,與宿主植物具有共生關系且沒有對植物造成明顯損害的細菌[8-9]。由于很多內生細菌對植物沒有損傷且有拮抗病原菌的作用,所以常常被用于植物病害的生物防治[10-11]。生物防治以其安全、高效及無污染等特點已經成為植物病害防治的重要途徑。目前,用于防治金銀花、小麥和甜瓜白粉病的內生細菌已有報道[12-14]。但利用內生細菌防治南瓜白粉病的報道較少。筆者的研究旨在從高抗南瓜白粉病的植株內分離篩選出對該病害有較好防效的菌株,以期為南瓜白粉病的生物防治探尋新途徑。
1 材料與方法
1.1 材料
南瓜白粉病病原菌為單囊殼白粉菌(Podosphaera xanthii)2France生理小種。南瓜抗病自交系22G3用于內生細菌的分離,室內盆栽試驗材料為南瓜感病自交系22H6。以上材料均由甘肅省農業科學院蔬菜研究所提供。
1.2 方法
1.2.1 內生細菌的分離、純化及其發酵液的制備 2023年6月,在甘肅省農業科學院蔬菜研究所育種基地采集高抗白粉病的南瓜自交系22G3植株,取適量的根、莖、葉剪碎,在75%乙醇中浸泡1 min,放入0.1%HgCl2中浸泡60 s,再放入75%乙醇中浸泡30 s,將組織取出后用無菌水沖洗4次。在滅過菌的研缽內加入10 mL無菌水和少量無菌石英砂研磨成勻漿,靜置30 min,將0.1 mL勻漿均勻涂抹在NA平板上,置于28 ℃恒溫箱中培養48 h。選取不同的菌落在NA平板上進行純化,將純化的細菌菌株保存在NA斜面,置于4 ℃冰箱保存備用。將保存的細菌菌株接種在裝有100 mL NB液體培養基的250 mL三角瓶中,在搖床上培養48 h(170 r·min-1,28 ℃),得到的發酵液用滅菌水適量稀釋后,采用平板菌落計數法將原液制成含量為108 cfu·mL-1 的發酵液。以上試驗均在無菌環境條件下進行。
1.2.2 初篩試驗 初篩試驗采用孢子萌發抑制法。將無菌NA培養基平板用滅過菌的打孔器切成直徑為0.5 cm的圓餅,放入預先制備好的各菌株發酵液中浸泡4 h,對照為無菌水浸泡的培養基圓餅,在菌餅中加入20 μL的病原孢子懸浮液(107 個·mL-1),完全隨機放入滅菌培養皿中,每皿5個菌餅,蓋上培養皿蓋置于光照培養箱(25 ℃,光照16 h·d-1,相對濕度80%)中培養48 h,每處理3次重復。鏡檢并計算孢子萌發抑制率。
1.2.3 復篩試驗 (1)葉盤復篩試驗 " "對初篩試驗效果明顯的菌株進行葉盤復篩試驗。用直徑1 cm的打孔器從健康22H6幼葉上切下葉盤,在內生細菌發酵液(108 cfu·mL-1)中浸濕后晾干,對照為無菌水浸泡的葉盤,正面朝上懸浮在加有苯胼咪唑(25 mg·L-1)的無菌水表面,在葉盤上加入50 μL的病原孢子懸浮液(107個·mL-1),蓋上培養皿蓋置入光照培養箱(22 ℃,光照16 h·d-1,相對濕度80%)。隨機選擇5個葉盤為1個處理,3次重復。7~10 d 后調查病斑面積,并計算病情指數和防治效果。南瓜白粉病葉面病情分級標準[15]:0級,葉片無病斑;1級,病斑面積占葉面積的5%以下;3級,病斑面積占葉面積的5%~15%;5級,病斑面積占葉面積的16%~25%;7級,病斑面積占葉面積的26%~50%;9級,病斑面積占葉面積的51%~75%;11 級,病斑面積占葉面積的76%以上。
病情指數=∑(病級株數×代表級數)/(調查總株數×最高級值)×100;
防治效果/%=(對照病情指數-處理病情指數)/對照病情指數×100。
(2)室內盆栽復篩試驗 將預先制備好的內生細菌發酵液(108 cfu·mL-1)噴灑在22H6 2葉1心期幼苗葉片上,以噴滅菌水為對照,24 h后接種南瓜白粉病菌孢子懸浮液(107個·mL-1),20~24 ℃下保濕24 h。每處理5株幼苗,3次重復,隨機區組排列。7~12 d后調查病情并按公式計算病情指數和防治效果。
1.2.4 拮抗菌株溫室防病效果的測定 取22H6 2葉1心期幼苗,分別用拮抗菌株原液(108 cfu·mL-1)和稀釋10倍、100倍、1000倍液噴霧,以噴滅菌水為對照,每株15 mL,24 h后接種南瓜白粉病菌孢子懸浮液(107個·mL-1),20~24 ℃下保濕24 h。每個處理5株,3次重復,隨機區組排列。7~12 d后調查病情并計算防治效果。
1.2.5 拮抗菌株B4-2的鑒定 采用形態觀察、生理生化測定和系統發育樹分析方法,對拮抗內生細菌菌株進行鑒定。將拮抗菌株在NA培養基上劃線,28 ℃恒溫培養2 d,觀察菌落形態、顏色和大小,利用透射電鏡觀察菌體形態,同時參考《常見細菌系統鑒定手冊》[16],進行厭氧試驗、革蘭氏染色、硝酸鹽還原、檸檬酸鹽利用、V-P試驗、葡萄糖、溶菌酶肉湯、動力培養基、明膠試驗、過氧化氫酶、淀粉水解和甘露醇的生理生化特征分析。采用50 μL的PCR反應體系進行16S rDNA的擴增、測序及系統發育樹分析。使用細菌DNA提取試劑盒提取拮抗菌株基因組DNA。擴增菌株的16S rDNA采用細菌通用引物27F(5′- AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′- GGTTACCTTGTTACGACTT-3′)。PCR擴增體系(50 μL):DNA模板4 μL,上、下游引物各 2 μL,mix 25 μL,ddH2O 17 μL。PCR 擴增程序為:94 ℃預變性3 min;94 ℃變性30 s,60 ℃退火1 min,72 ℃延伸45 s,35個循環;最后72 ℃延伸10 min。擴增產物采用1%瓊脂糖凝膠電泳檢測,16S rDNA測序工作由甘肅科美意生物科技有限公司完成。將所測菌株的16S rDNA序列上傳Ezbiocloud 網站進行比對,構建系統發育樹,分析與模式菌的親緣關系。
1.3 數據分析
利用Microsoft Excel 2010 和 SPSS 20.0 軟件對試驗數據進行統計及差異顯著性分析。
2 結果與分析
2.1 拮抗內生細菌的分離及其對孢子萌發的影響
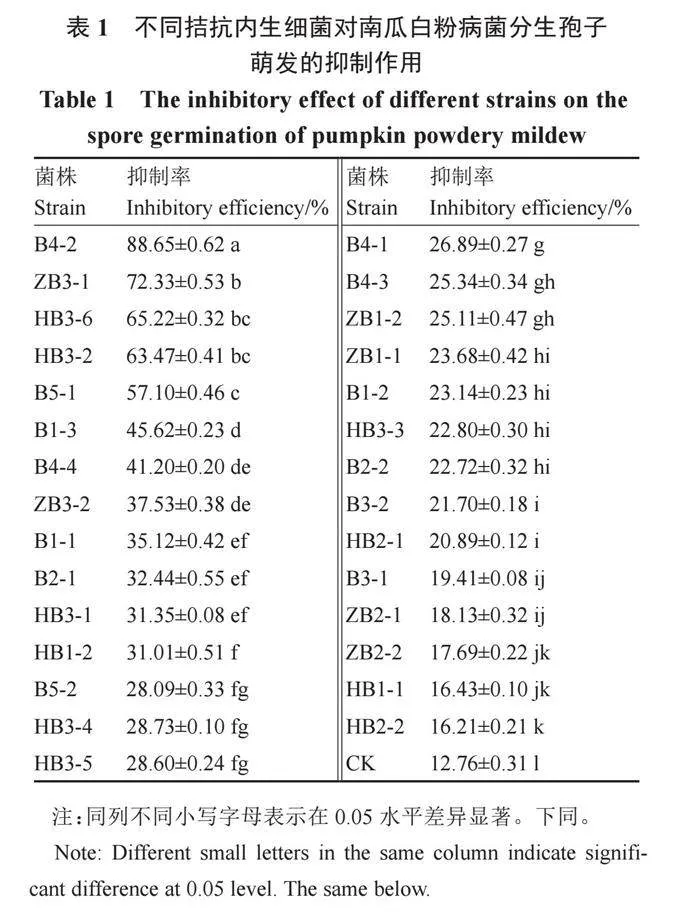
根據菌落大小、顏色和形態的不同,從南瓜高抗白粉病自交系22G3的根、莖、葉部共分離純化到29株內生細菌,其中葉部13株,編號為B,莖部6株,編號為ZB,根部10株,編號為HB。表1結果表明,內生細菌B4-2、ZB3-1、HB3-6、HB3-2、B5-1對南瓜白粉病菌分生孢子萌發的抑制率均在50%以上,其抑制率分別為88.65%、72.33%、65.22%、63.47%和57.10%,其中B4-2的抑制率最高。
2.2 葉盤試驗的防治效果
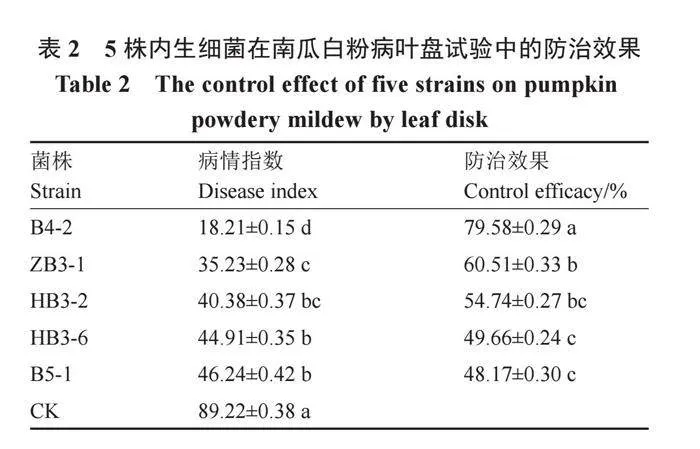
對上述試驗篩選得到的5株內生細菌B4-2、ZB3-1、HB3-6、HB3-2和B5-1進行南瓜白粉病的葉盤防效試驗。表2結果表明,5個菌株對南瓜白粉病均有一定的防治效果,且與對照差異顯著。其中,B4-2防治效果最好,病情指數僅為18.21,防效達79.58%。從圖1可以看出,經過B4-2發酵液處理的葉盤病斑面積明顯小于對照。
2.3 室內盆栽試驗的防治效果
對篩選出的內生細菌進行室內盆栽防治效果試驗。表3結果表明,內生細菌B4-2、ZB3-1、HB3-2、HB3-6和B5-1處理南瓜幼苗后,白粉病病情指數分別為14.90、33.25、38.61、41.74和44.52,且與對照均差異顯著。其中,菌株B4-2在南瓜白粉病室內盆栽試驗中防效最好,病情指數僅為14.90,防治效果達83.21%。從圖2可以看出,經B4-2發酵液處理過的南瓜幼苗病斑面積明顯小于對照。
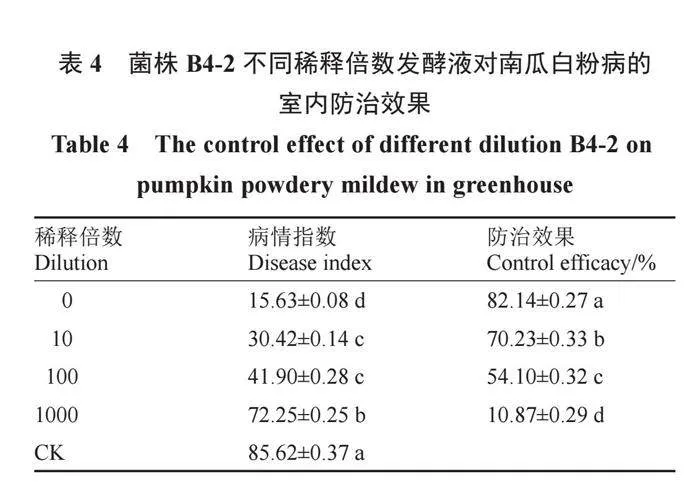
2.4 菌株B4-2不同稀釋倍數發酵液對南瓜白粉病的室內防治效果
對南瓜白粉病有顯著防治效果的B4-2發酵液原液和稀釋10倍、100倍、1000倍液噴霧南瓜幼苗。表4結果表明,不同稀釋倍數的菌株B4-2發酵液對南瓜白粉病均有一定的防治效果,隨著稀釋倍數的增大,防治效果逐漸降低。噴施B4-2發酵液原液,南瓜白粉病的病情指數最低,僅為15.63;防治效果最好,達82.14%。
2.5 菌株B4-2的鑒定
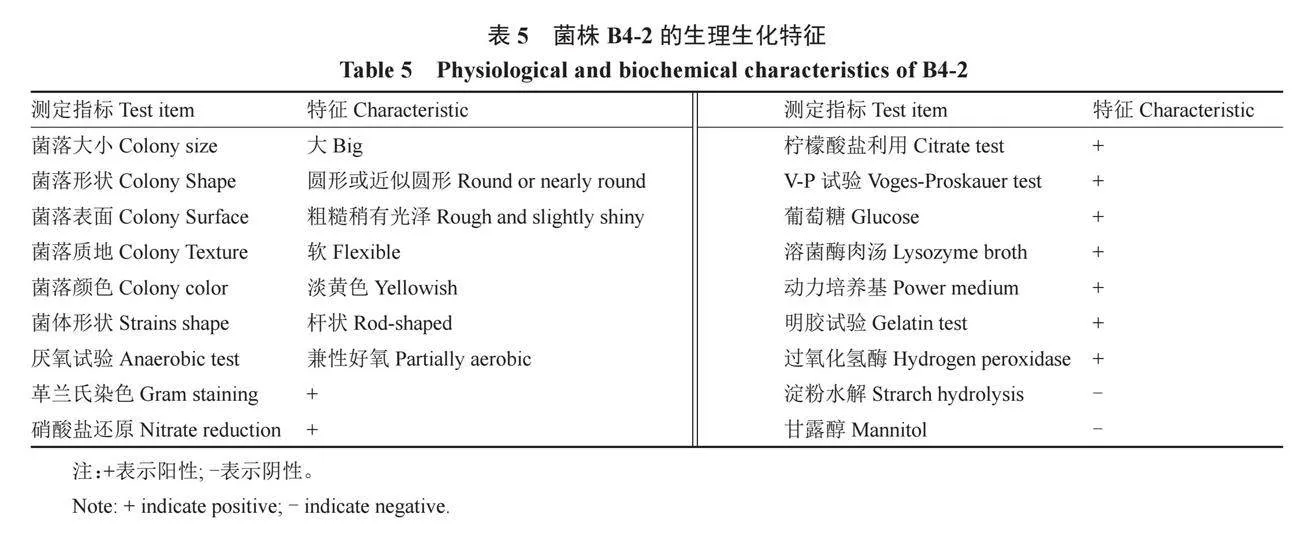
NA培養基上的菌落大,圓形或近似圓形,直徑5~7 mm,扁平,表面粗糙稍有光澤,質地軟,淡黃色。經過較長一段時間的培養后,該菌落的表面開始呈現毛玻璃狀。菌體桿狀,末端方,短或長鏈,兼性好氧。除淀粉水解和甘露醇試驗為陰性外,革蘭氏染色、硝酸鹽還原、檸檬酸鹽利用、V-P試驗、葡萄糖、溶菌酶肉湯、動力培養基、明膠試驗和過氧化氫酶生理生化指標均為陽性(表5)。
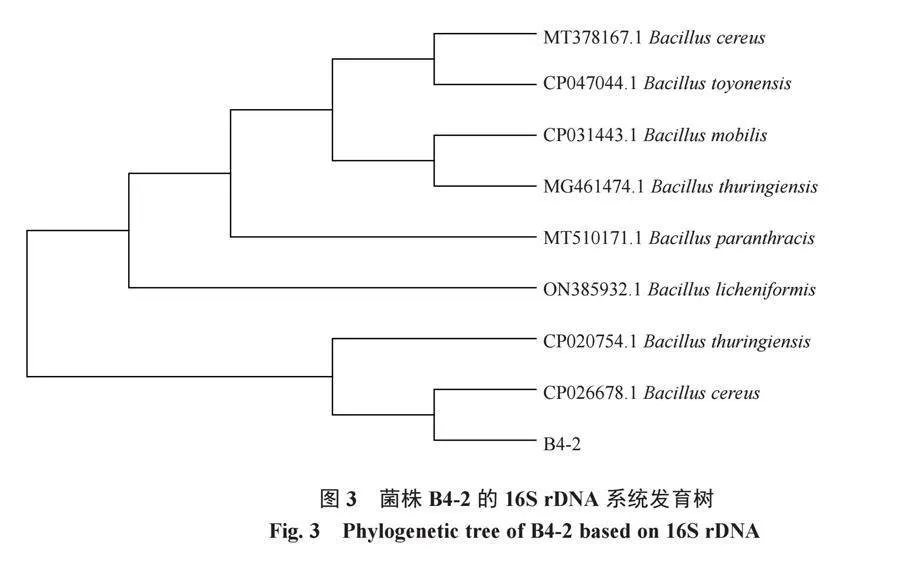
將拮抗內生細菌菌株B4-2的16 S rDNA序列在 Ezbiocloud 網站上進行比對并構建系統發育樹,圖3結果表明,菌株B4-2與蠟樣芽孢桿菌(登錄號為CP026678.1)的同源性最高,序列一致性達99.72%。結合形態、生理生化特征鑒定菌株B4-2為蠟樣芽孢桿菌(Bacillus cereus)。
3 討論與結論
生物防治可有效降低農藥殘留及對環境的污染,且對植物病害有一定的控制作用。近年來,生防菌株的獲得與應用加快了生物防治的進程[17]。內生細菌是植物體內種類和數量最多的微生物,在植物的各個組織器官中均可分離獲得。它不受植物附生細菌的影響,利用植物的獨特生態位,可在相對穩定安全的環境中生存[18-19]。植物與內生細菌可相互促進、相互依存,形成一種共生關系[20]。有些內生細菌具有抗菌、促生、與病原菌競爭生態位和營養物質、誘導植物產生抗性的作用[21-22],可用于植物病害的生物防治。筆者根據內生細菌的特點和生防優勢,從高抗白粉病的南瓜自交系22G3組織中分離獲得29株菌株。其中,菌株B4-2對南瓜白粉病具有較高的拮抗活性,菌株B4-2發酵液處理白粉病菌孢子48 h后,其對孢子萌發抑制率為88.65%;發酵液處理發病的離體葉片和盆栽幼苗7 d后,其防治效果分別為79.58%和83.21%。表明菌株B4-2在南瓜白粉病的生物防治中具有一定的開發潛力。
筆者利用形態學和分子生物學技術,將對南瓜白粉病有較好防效的內生細菌B4-2鑒定為蠟樣芽孢桿菌。前人研究表明,蠟樣芽孢桿菌在水、土壤、植物、食品及飼料中廣泛存在,且易于培養和保存。蠟樣芽孢桿菌能抵抗電磁輻射、紫外線、高溫、有害化學物質等,也能產生抗生素、抗菌肽、細菌素等多種抑菌活性物質[23-24]。目前,國內外在蠟樣芽孢桿菌生防應用方面也有相關報道。朱海云等[25]從野生銀杏中分離篩選出拮抗獼猴桃潰瘍病的蠟樣芽孢桿菌MA23,其發酵液對獼猴桃潰瘍病的盆栽防治效果達93.6%。王剛等[26]研究表明,內生細菌蠟樣芽孢桿菌B3-7可防治小麥全蝕病,其中B3-7的mota基因參與該菌株在小麥根系的內生定殖。從草莓組織中分離的蠟樣芽孢桿菌菌株BCM2能長期定殖于番茄根部,能抑制番茄南方根結線蟲的種群數量[27-28]。蠟樣芽孢桿菌菌株YN917對水稻稻瘟病有一定的防治效果,防效達65.61%~68.51%[29]。筆者的研究雖然已從南瓜植株獲得對白粉病有較好防效的蠟樣芽孢桿菌B4-2,但對蠟樣芽孢桿菌B4-2的生防機制、發酵工藝優化及生防產品的應用還需進一步研究。
參考文獻
[1] 黃子粵,劉文君,覃仁柳,等.不同品種南瓜內生細菌多樣性及PICRUSt基因功能預測分析[J].中國農業科學,2021,54(18):4018-4032.
[2] 魏照信,李波,荊愛霞.南瓜白粉病的主要影響因素及防治技術[J].中國蔬菜,2012(7):28-29.
[3] REINHOLD-HUREK B,HUREK T.Living inside plants:Bacterial endophytes[J].Current Opinion in Plant Biology,2011,14(4):435-443.
[4] SINGH L P,GILL S S,TUTEJA N.Unraveling the role of fungal symbionts in plant abiotic stress tolerance[J].Plant Signaling Behavior,2011,6(2):175-191.
[5] 劉江葦,劉穎,徐婷,等.水稻內生菌研究進展及展望[J].生命科學研究,2021,25(3):232-239.
[6] BONITO G,REYNOLDS H,ROBESON M S,et al.Plant host and soil origin influence fungal and bacterial assemblages in the roots of woody plants[J].Molecular Ecology,2014,23(13):3356-3370.
[7] KHARE E,MISHRA J,ARORA N K.Multifaceted interactions between endophytes and plant:Developments and prospects[J].Frontiers Microbiology,2018,9:2732.
[8] SANTOYO G,MORENO-HAGELSIEB G,OROZCOMOSQUEDA M D C.Plant growth-promoting bacterial endophytes[J].Microbiological Research,2016,183:92-99.
[9] WAZNY R,ROZPA DEK P,DOMKA A.The effect of endophytic fungi on growth and nickel accumulation in Noccaea hyperaccumulators[J].Science of the Total Environment,2021,768:144666.
[10] VARDHARAJULA S,SHAIK Z A,KRISHAN PRASAD VURUKONDA S S.Plant growth promoting endophytes and their interaction with plants to alleviate abiotic stress[J].Current Biotechnology,2017,6(3):252-263.
[11] 何珊,田志宏.植物內生細菌生物學效應的研究進展[J].安徽農學通報,2020,26(4):20-23.
[12] 崔文艷,羅喜燕,黃高,等.金銀花白粉病生防內生菌株的篩選、鑒定及其對白粉病的防效[J].西南農業學報,2023,36(5):958-964.
[13] 龔雙軍,向禮波,薛敏峰,等.小麥根部內生細菌ZY-1對小麥白粉菌的抑菌活性及拮抗機理[J].中國生物防治學報,2016,32(5):635-641.
[14] 馬英元,欒非時,馬鴻艷,等.甜瓜白粉病內生拮抗細菌的篩選鑒定及其防治效果的研究[J].植物保護,2011,37(2):25-30.
[15] 中華人民共和國農業部.農藥室內生物測定試驗準則 殺菌劑 第11部分:防治瓜類白粉病試驗 盆栽法:NY/T 1156.11-2008[S].北京:中國農業出版社,2008.
[16] 東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001.
[17] 張琦,劉應敏,楊東燕,等.貝萊斯芽孢桿菌SM2對番茄灰霉病的生防效果[J].中國瓜菜,2024,37(2):66-73.
[18] SENTHILKUMAR M,ANANDHAM R,MADHAIYAN M.Endophytic bacteria:Perspectives and applications in agricultural crop production[M]//DINESH K M.Bacteria in Agrobiology:Crop Ecosystems. Berlin:Springer,2011:61-96.
[19] 趙杰,田瓊金,聶蔓茹,等.紅蕓豆根腐病拮抗內生細菌的篩選和鑒定[J].山西農業科學,2023,51(10):1226-1232.
[20] 張慶琛,劉應敏,朱曉琴,等.薄荷內生細菌 X7 的分離鑒定及其對番茄黃萎病的防效[J].中國瓜菜,2023,36(2):29-34.
[21] PRIHATININGSIH N,DJATMIKO H A,LESTARI P.Endophytic bacteria:An emerging tool for biological control bacterial leaf blight of paddy[J].IOP Conference Series-Earth and Environmental Science,2021,653:012080.
[22] 高沙爾·卡依爾哈力,熱子亞·麥麥吐遜,祖麗皮亞·玉努斯.地錦草內生細菌多樣性、拮抗及促生特性測定[J].微生物學通報,2021,48(2):392-406.
[23] YUAN X M,LYU S J,ZHANG H Q,et al.Complete genome sequence of novel isolate SYJ15 of Bacillus cereus group,a highly lethal pathogen isolated from Chinese soft shell turtle (Pelodiscus sinensis) [J].Archives of Microbiology,2020,202(1):85-92.
[24] FAYAD N,AWAD M K,MAHILLON J.Diversity of Bacillus cereus sensu lato mobilome[J].BMC Genomics,2019,20:436.
[25] 朱海云,馬瑜,柯楊,等.獼猴桃潰瘍病菌拮抗菌的篩選、鑒定及其對植物病原真菌的抗性[J].生物技術通報,2021,37(6):66-72.
[26] 王剛,劉鳳英,王淼,等.內生細菌B3-7的運動性參與其在小麥根系的內生定殖和對小麥全蝕病的生物防治[J].植物病理學報,2011,41(5):526-533.
[27] 彭雙,閆淑珍,陳雙林.具殺線蟲活性植物內生細菌的篩選和活性產物[J].微生物學報,2011,51(3):368-376.
[28] 王聰.蠟樣芽孢桿菌BCM2生防南方根結線蟲的影響因素研究[D].南京:南京師范大學,2018.
[29] 周瑚,劉劍波,譚陳勇,等.蠟樣芽孢桿菌YN917對水稻稻瘟病菌的拮抗機理及應用[J].農藥,2023,62(3):213-216.

